猪皮明胶肽对肌肉的抗冻保护作用
2022-08-24路晶王颖聂文谢勇陈博徐宝才
路晶,王颖,聂文,谢勇,陈博,徐宝才
(合肥工业大学食品与生物工程学院,安徽 合肥 230031)
我国是世界猪肉生产和消费大国,猪肉供应以国内生产为主。猪肉具有肉质鲜美、营养价值高的特点。有研究发现,猪肉中富含各类氨基酸,是人体所需蛋白的良好来源[1],猪肉从新鲜屠宰到运输至销售点过程中,尤其是海外进口生鲜猪肉,肉质的保鲜及安全问题成为重点关注的对象。冷冻肉品是目前全球最普遍使用的用于长期运输、贮藏肉品的方法,相应也有大量全程低温冷链运输产业的出现。然而,在低温冷链运输过程中,由于低温冷冻及温度的不断波动,导致肉及肉制品肌肉纤维间隙产生许多冰晶,并随温度变化而发生冰晶聚集、膨大等重结晶现象,刺穿并挤压了肌肉组织,导致细胞汁液流失、色素流失及营养流失的现象发生,同时还会造成肉品蛋白质变性、脂肪过度氧化及色泽劣变等不良影响,使肉品整体品质下降[2-4]。基于以上所述,科学家及相关从业者一直在寻找可以降低肉品冷冻损伤的保护方法。抗冻蛋白是一种能够降低溶液冰点,却几乎不影响其熔点的带有一定热滞活性的物质,将其添加到冷冻肉品中,可以有效抑制冰晶生长聚集,进而减少肉品的滴水损失、营养流失[5]。传统的商业抗冻剂还会采用糖类、醇类及盐类物质作为冷冻保护剂,如蔗糖、山梨糖醇、磷酸盐等化学物质及其复配产物。但此类抗冻剂却有高糖、高热量及高盐等健康安全问题存在,不符合现代消费者对食品健康的要求。抗冻多肽,以食源性蛋白质如明胶、胶原蛋白等物质作为原料,通过酶解得到水解多肽,具有可控、可大规模生产及安全的特点,主要从食用明胶[6-7]、动物皮肤组织[8-9]及鱼鳞[10]等副产物中提取,可以显著提高原料的生产利用率,促进绿色环保事业发展,因而成为近年来有望替代糖类等传统抗冻剂的有效低温保护剂。
本研究中,用碱性蛋白酶水解猪皮明胶得到酶解物,将其超滤得到一个具有抗冻活性的组分,并将该组分注射到猪肉中,以空白组、未冷冻组及商业抗冻剂组作为对照,通过测定猪肉解冻损失探究其对肌肉的影响,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)来探究肌原纤维蛋白的降解情况,通过拉曼光谱、荧光光谱分析蛋白二级、三级结构情况,检验与评价猪皮明胶肽的抗冻活性及其对肌肉的冷冻保护作用。
1 材料与方法
1.1 材料与试剂
猪皮明胶B:漯河市五龙明胶有限公司;碱性蛋白酶(264 U/g):诺维信(中国)生物技术有限公司;蔗糖(食品级):成都太古糖业有限公司;氯化钠、氯化镁、乙二醇双(2-氨基乙基醚)四乙酸[ethylenebis(oxyethylenenitrilo)tetraacetic acid,EDTA]、磷酸二氢钠、磷酸氢二钠、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、山梨糖醇、哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES):中国索莱宝试剂有限公司;乙腈、浓盐酸:中国医药集团。以上试剂均为分析纯。
1.2 仪器与设备
YP6001N电子天平:上海精密科学仪器有限公司;HH-8数显恒温水浴锅:常州国华电器有限公司;Masterflex Model 07514-10 超滤机:Pall公司;FD-1A-50冷冻干燥机:北京博医康实验仪器公司;HCS321Gi-Y冷台电子显微照相系统:Instec公司;GL-21M高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;FA25高剪切乳化机:上海弗鲁克流体机械制造有限公司;LabRam HR Evoulation显微共焦激光拉曼光谱仪:法国Horiba Jobin Yvon公司;F-7100荧光光谱仪:日本日立公司。
1.3 方法
1.3.1 抗冻活性检测体系的确定
冷-热循环检测系统与多倍低温显微镜和电子拍照系统联合使用,检测提取所得抗冻肽的抗冻活性。整个操作过程中,利用液氮来维持试验所需的低温环境,并以50℃/min的降温速率,将放置样品的样品槽急速降温至-60℃,平衡5 min。测定冰晶大小时,将每组样品都溶解于生理盐水中,并吸取5 μL置于载玻片上,随后将载玻片快速放入冷台样品槽中封好,再以10℃/min的速率将样品升温至-8℃,保留30 min,以观察冰晶的生长状况。利用多倍显微镜观察样品中冰晶的变化,并用电子拍照系统实时拍照记录冰晶生长情况,随后,利用ImageJ软件记录并计算样品中生长的冰晶平均直径,若样品中的冰晶平均直径、数目对比空白对照组(生理盐水)有明显改善,则说明该样品抑制冰晶生长的抗冻活性较高。多倍显微镜放大100倍来记录。
1.3.2 抗冻多肽的超滤截留
向猪皮明胶中加入碱性蛋白酶,酶与猪皮明胶比为 1∶50(mL/g),pH9.0,37 ℃酶解 3 h,结束时将酶解液置于沸水浴中加热至沸10 min以完全灭活蛋白酶。酶解物冷冻干燥得到粉末后,以1∶2(g/mL)的比例溶于蒸馏水中,形成稳定的溶液。将溶液先用纤维滤膜过滤,除去不溶的杂质颗粒,以免堵塞过滤柱。将过滤后的猪皮明胶酶解物(pigskin gelatin hydrolysate,PGH)溶液利用超滤机,分别用10 kDa分子量截留柱、3 kDa分子量截留柱和1 kDa分子量截留柱超滤。最后,将截留得到的蛋白质滤液分别独立分装,进行冷冻干燥,并将所得到的粉末装入自封袋,做好标记,以备后续试验使用。之后,将每个组分的样品放置于冷台观察冰晶的生长,以冰晶的平均尺寸来表示其抗冻活性的大小。将抗冻活性最好的组分以4 mL/100 g注射到猪肉块[每块质量为(30±0.5)g]中,放置于-20 ℃冰箱 24 h,并过夜解冻,进行后续试验测定。本试验中将样品分为4组:未冷冻组、空白组(冷冻,样品不处理)、商业抗冻剂组(4 mL/100 g山梨糖醇+4 mL/100 g蔗糖)和抗冻肽组(4 mL/100 g的抗冻肽)。
1.3.3 肌原纤维蛋白(myofibrillar protein,MP)的提取
采用Li等[11]的方法提取猪肉肌原纤维蛋白。分别称取各组经解冻样品后(100±5)g,用4倍体积的分离缓冲液(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,10 mmol/L NaH2PO4/Na2HPO4,pH7.0)混合,放入均质机均质。将混合的猪肉肉糜匀浆液在2 000×g、4℃条件下离心15 min,去除沉淀,刮去上层脂肪部分及底层结缔组织,收集剩余部分,重复3次。将得到的沉淀用4倍缓冲液(0.1 mol/L NaCl,10 mmol/L磷酸钠缓冲液,pH7.0)再次分散,在 2 000×g、4℃条件下离心 15 min,弃去上清取沉淀,重复洗涤3次。参照李春强[12]的方法,在最后一次离心前,利用0.1 mol/L HCl调节蛋白质混合液pH值为6.25。将蛋白质混合液用4层白色纱布过滤以去除多余结缔组织及脂肪,再离心取沉淀,即得到粗提猪肉肌原纤维蛋白,并将其储存于4℃冰箱中,在48 h内使用。蛋白质浓度利用双缩脲法进行测定,以牛血清白蛋白(bovine serum albumin,BSA)标准蛋白为参照,调节蛋白质的浓度。
1.3.4 解冻损失
解冻损失是由猪肉样品在冷冻前及冷冻后质量差占冻前质量的百分比来衡量的。将肉样在冷冻前进行称重,装入自封袋中标记好,冷冻后将肉样取出,用厨房用纸擦干肉样表面的多余水分,此时再称重每个肉样。测量解冻损失全程都处于室温中,并用Kong等[13]提出的公式(1)来计算。
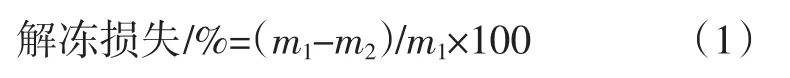
式中:m1为冷冻前鲜肉样品的质量,g;m2为冷冻后鲜肉样品的质量,g。
1.3.5 SDS-PAGE凝胶电泳
各组肌原纤维蛋白用PIPES缓冲液稀释至浓度为1 mg/mL,以1∶5(体积比)的比例与上样缓冲液混合均匀,沸水加热10 min。制胶利用预制胶试剂盒方法进行,配制5% 的浓缩胶和10% 的分离胶。制好胶后,用电泳缓冲液注满电泳槽,浓缩胶中样品上样量为10 μL,Marker上样量为 5 μL。 电泳时,当样品跑浓缩胶时将电压调到80 V,持续约25 min;当跑分离胶时将电压调到110 V,持续60 min。电泳时,当溴酚蓝到达分离胶接近底部1 cm时,停止电泳。最后,将凝胶用考马斯亮蓝染色液浸染1 h,然后用蒸馏水浸没脱色至蛋白条带清晰可见,拍照记录。
1.3.6 拉曼光谱
参考Xiong等[14]的方法采用显微共焦激光拉曼光谱仪测定样品。具体操作参数:用532 nm的绿色二极管激光作为激光光源,样品扫描范围为400 cm-1~3 600 cm-1,样品在扫描前先用激光光源照射30 min以去除肉样中蛋白质的荧光背景干扰。每次扫描进行10次,采集时间为25 s,分辨率为2 cm-1,使用内标对1 004 cm-1峰处出现的苯丙氨酸残基进行标准化。具体试验条件:间隙宽度为200 μm,光栅为600 g/mm,采集时间为10 s,扫描累积为10次,分辨率为2 cm-1,采集计数为8。每个样品的最终光谱信息通过Lab Spec 6进行校准。每个样品的二级结构含量通过Alix等[15]描述的方法进行量化。
1.3.7 内源荧光光谱
蛋白质样品的内源荧光光谱采用荧光分光光度计测定,参照曹云刚等[16-17]的方法稍加修改。将蛋白溶液用PIPES缓冲液调至0.2 mg/mL,激发波长设定为295 nm,狭缝宽度设定为10 nm,采集区间设定为300 nm~400 nm,记录样品波长吸收情况,每组做3次平行。
1.4 数据分析
每组试验样品为3个,每个样品有3份重复,最终取重复的平均值作为结果数据。本研究中获得的数据以平均值±标准差表示。不同的处理被包括为固定效应和重复作为随机效应。使用SPSS 19.0(SPSS Inc.,Chicago,USA)软件对数据进行方差分析(ANOVA),并进行邓肯检验(Duncan)(P<0.05为差异显著)。
2 结果与分析
2.1 抗冻多肽的超滤分离
抗冻多肽超滤各组分冰晶情况见图1和图2。
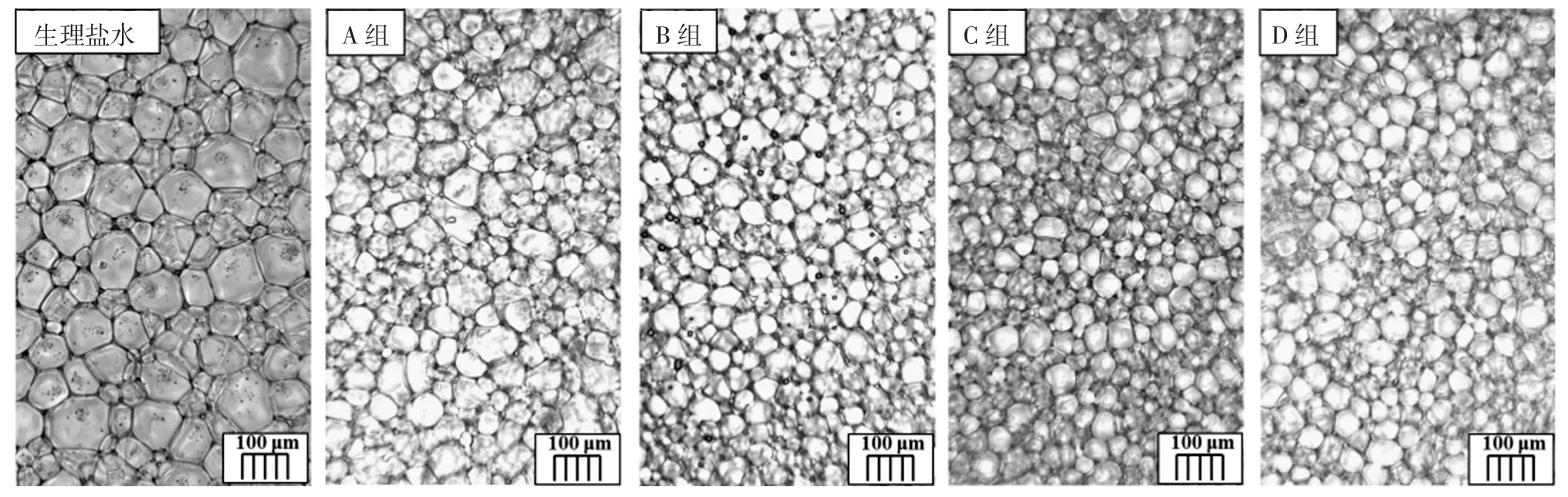
图1 超滤各组分冰晶情况Fig.1 Ice crystal situation diagram of each component of ultrafiltration
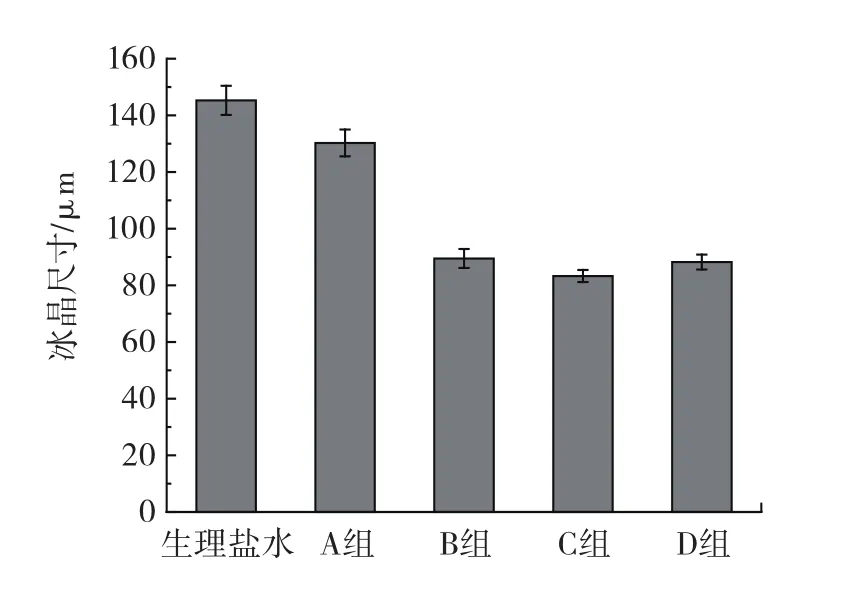
图2 超滤各组分冰晶尺寸大小Fig.2 Ice crystal size of each component of ultrafiltration
图1和图2可知,利用超滤系统得到的不同分子量范围的猪皮明胶抗冻多肽,包含4组样品:分子量>10 kDa组、3 kDa<分子量≤10 kDa组、1 kDa<分子量≤3 kDa组和分子量<1 kDa组。经过冷台的冰晶大小观察,发现1 kDa<分子量≤3 kDa组的猪皮明胶抗冻多肽冰晶的平均尺寸最小,为(83.28±2.13)μm。而以生理盐水作为空白对照组的冰晶尺寸则达到(145.27±5.15)μm,几乎为1 kDa<分子量≤3 kDa组猪皮明胶抗冻多肽的冰晶尺寸的两倍。由此可以得出结论,经超滤分离得到的1 kDa<分子量≤3 kDa组的猪皮明胶抗冻多肽的抗冻活性最好,后面将选取1 kDa<分子量≤3 kDa组的抗冻多肽来继续进行分离。
2.2 解冻损失
解冻损失通常会影响肉类和肉制品的各个方面,如外观、感官品质、质量变化和营养价值[3]。肉品的解冻损失同时也反映了其保水性的好坏,而保水性直接影响了肉品的嫩度、肉质、颜色及风味等食品感官品质。不同处理组的肌肉解冻损失见图3。

图3 不同处理组的肌肉解冻损失Fig.3 Thawing loss of each muscle in different treatment groups
由图3可以看出,空白组样品经冷冻后的解冻损失显著高于其他处理组样品,这可能是由于空白组缺乏抗冻剂保护,大冰晶的生成损伤了肌肉组织及部分肌肉细胞,导致更多的细胞汁液、水分等流失。然而猪皮明胶多肽的添加可以显著减少冷冻肉的解冻损失,与商业抗冻剂组相比,冻融循环后添加抗冻肽组肌肉的解冻损失较低(P<0.05)。 根据Wang等[18-19]的研究表明,猪皮明胶抗冻多肽具有高度灵活的二级结构,当它接近冰晶与水的界面时可以调整其骨架的构象并重新排列其含氧基团以利于吸附在冰面上。猪皮明胶抗冻多肽的这一特性意味着抗冻多肽在冷冻过程中也与水分子竞争结合到冰晶表面,抑制其再结晶过程,同时形成细小均匀的冰晶。因此,大冰晶膨胀的现象大幅减少,对细胞膜的刺穿少,肌肉组织的保水能力得以保留,从而减少了冷冻肉的解冻损失。
2.3 SDS-PAGE结果
通过测定肌原纤维蛋白的SDS-PAGE结果,可以了解到经不同处理的猪肉肌原纤维蛋白在冷冻后的蛋白质分子的交联及降解情况。各组的SDS-PAGE结果如图4所示。
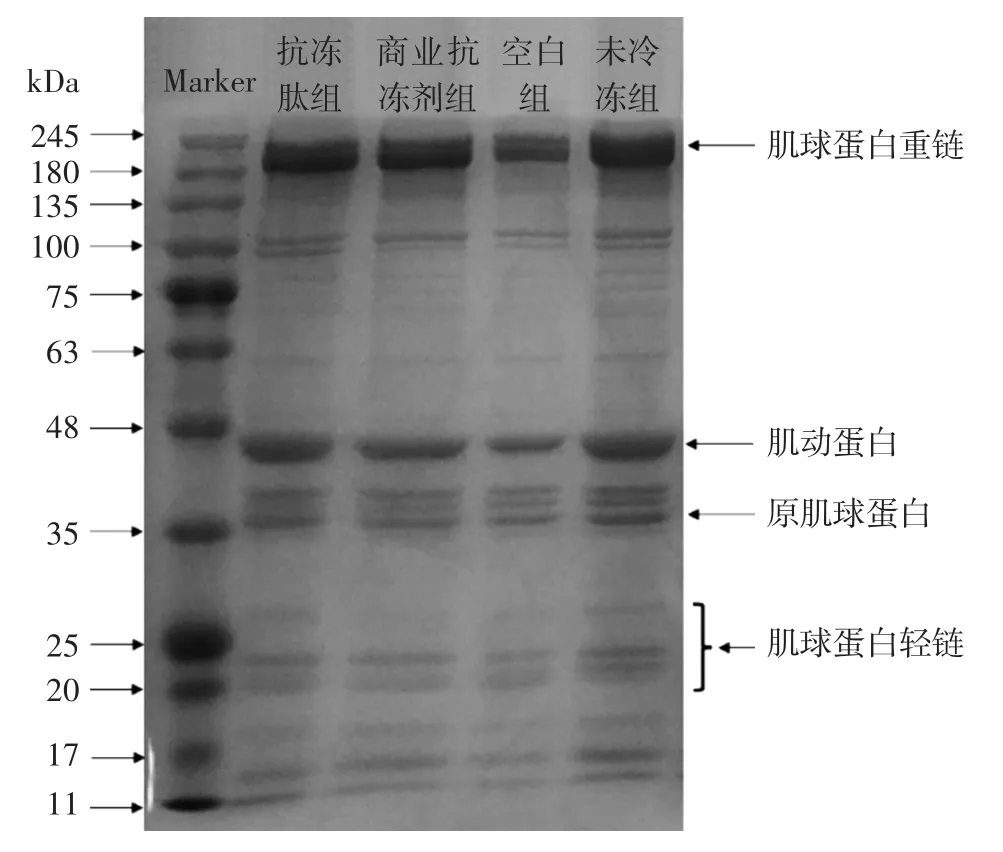
图4 不同处理组的肌原纤维蛋白SDS-PAGE凝胶电泳图Fig.4 SDS-PAGE gel electrophoresis of myofibrillar protein in different treatment groups
由图4可知,猪肉肌原纤维蛋白的主要电泳条带为肌球蛋白重链(myosin heavy chain,MHC,245 kDa),肌动蛋白(42 kDa),原肌球蛋白(36 kDa)和肌球蛋白轻链(myosin light chain,MLC,20 kDa~30 kDa),此结果与Cai等[20]的研究结论一致。各组的MHC和肌动蛋白的条带颜色最深、最宽,说明肌原纤维蛋白主要是由肌球蛋白和肌动蛋白所构成的。在4组处理中可以看出,空白对照组的MHC、MLC条带和肌动蛋白条带的颜色明显低于其他各组,而在电泳道上样时,每个泳道的蛋白量是相同的,由此可以推出,在冷冻解冻后空白组中蛋白质分子的空间构象发生了改变,导致蛋白质分子聚集并立即降解[21]。同时,由于空白组的肌原纤维蛋白在冷冻时没有抗冻剂的保护,使冰晶不断生长、聚集,对肌原纤维蛋白产生挤压、断裂等机械损伤,破坏了肌肉组织及细胞的完整性和稳定性,使蛋白质发生氧化、变性及降解,造成电泳条带显著浅于其他处理组。相比之下,抗冻多肽组的MHC、MLC及肌动蛋白条带颜色与未冷冻组最为接近,且肌动蛋白条带显著深于商业抗冻剂组,因此可以推断,经猪皮明胶抗冻多肽处理的猪肉肌原纤维蛋白,可以在冷冻后保持较高的完整性,有效抑制肌球蛋白和肌动蛋白的聚集、氧化及降解。
2.4 肌原纤维蛋白的二级结构分析
不同处理组样品的拉曼光谱(400 cm-1~3 600 cm-1)结果如图5所示。

图5 不同处理组的拉曼光谱图Fig.5 Raman spectra of different treatment groups
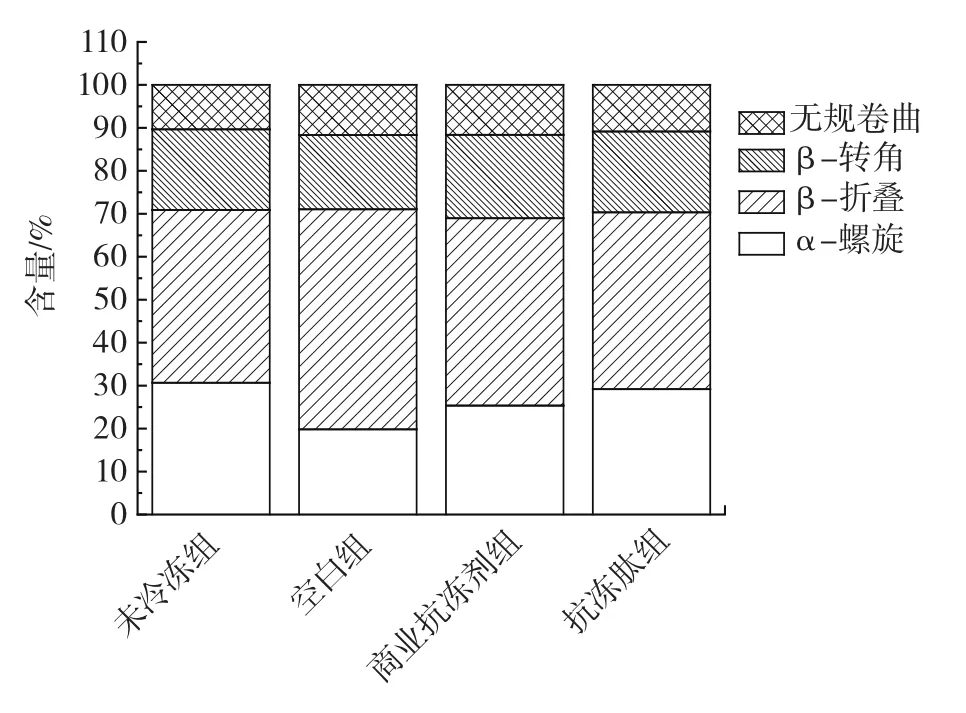
图6 不同处理组的二级结构含量情况Fig.6 The secondary structure content of different treatment groups
从图6中可以观察到,除未冷冻组外,添加抗冻多肽的肌原纤维蛋白二级结构中的α-螺旋含量最多,为29.19% ,且明显高于空白组和商业抗冻剂组,而无规卷曲的含量则最低,由此可知,添加抗冻多肽的猪肉样品肌原纤维蛋白的二级结构在冻融后能最好地保持其规律性、完整性。这可能是因为抗冻多肽的添加抑制了猪肉肌肉组织及细胞在冷冻过程中形成的大冰晶,从而最大限度地减少了对肌原纤维蛋白二级结构的冷冻损伤破坏。因此,向猪肉中添加抗冻多肽可以有效保护猪肉肌原纤维蛋白的完整性,显著提高其α-螺旋含量,保留肌原纤维蛋白的二级结构完整性、稳定性。
2.5 内源荧光光谱
内源荧光因其主要激发色氨酸残基,可以监测蛋白质的氨基酸残基及周边微环境的变化,因此可以用来表征蛋白三级构象的变化情况[24]。各组样品的荧光光谱情况如图7所示。
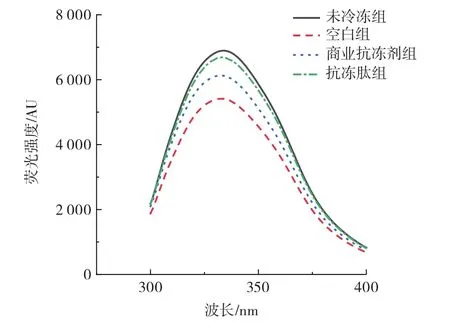
图7 不同处理组的内源荧光光谱图Fig.7 Endogenous fluorescence spectra of different treatment groups
由图7可以看出,4组样品的最大荧光强度都出现在334 nm波长处,由此说明每组的肌原纤维蛋白的色氨酸残基都处于相对疏水环境下。在4组样品中,除了未冷冻组,抗冻多肽组的最大荧光强度明显高于商业抗冻剂组和空白对照组,而空白对照组的最大荧光强度最低。由先前的研究中发现,蛋白质的荧光强度较弱可能是由羟自由基氧化所导致,羟自由基通过攻击蛋白质的肽链,使蛋白质的空间构象展开,暴露了埋藏于内部的色氨酸残基,导致蛋白分子表面色氨酸残基含量增加,使能够被激发的内源性色氨酸含量减少,最终导致蛋白荧光强度下降[25]。因此,空白组的荧光强度下降可能是由于冷冻期间冰晶的生长带来的机械损伤、氧化损伤等,致使肌原纤维蛋白结构被展开,内源性色氨酸荧光强度相应下降。以上结果表明,猪肉中添加猪皮明胶抗冻多肽可以有效缓解冷冻过程中肌原纤维蛋白的氧化损伤,降低蛋白的变性程度。
3 结论
将猪皮明胶酶解物经超滤分离的方法,得到的1 kDa~3 kDa组分抗冻活性最强,冰晶尺寸最小。向猪肉中添加4 mL/100 g猪皮明胶抗冻多肽,其肌肉解冻损失显著降低,同时也抑制了肌球蛋白和肌动蛋白的降解,肌原纤维蛋白在冷冻过程中因冰晶生长带来的挤压、断裂等产生的氧化、聚集得到了明显改善,保持了肌原纤维蛋白的二、三级结构的完整性。猪皮明胶抗冻多肽可以作为冷冻保护剂添加到猪肉中,在代替传统的糖类商业抗冻剂应用于肉类工业中具有一定的合理性和潜力。
