预后营养指数对宫颈癌放疗患者预后的预测价值
2022-08-24张志臣李悦黄磊
张志臣,李悦,黄磊
信阳市中心医院妇科,河南 信阳 464000
宫颈癌是严重威胁女性生命健康的恶性肿瘤,发病率仅次于乳腺癌,居女性恶性肿瘤第二位,宫颈癌好发于40~60 岁女性,近年来呈年轻化趋势[1-2]。外科手术仍是目前宫颈癌唯一的根治手段,但术后患者总生存率仍不理想,术后多需辅以放化疗等以延长患者的生存期。因此,探索宫颈癌进展生物学机制及预后的影响因素显得尤为重要。恶性肿瘤患者营养状况普遍欠佳,其恶化的营养状况极易导致手术切口感染、凝血异常、切口延迟愈合等,此外,营养不良还可导致免疫受损。预后营养指数(prognostic nutritional index,PNI)是将免疫和营养状况相结合的指标,多项研究对其与各种肿瘤患者预后间的关系进行分析,结果发现,PNI对恶性肿瘤患者的预后有较为重要的指导作用[3-5]。目前,中国关于PNI 对宫颈癌根治术后放疗患者预后影响的研究较少,故本研究探讨PNI 对宫颈癌术后放疗患者预后的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2015 年6 月至2017 年6 月信阳市中心医院收治的宫颈癌患者。纳入标准:①符合《2010 美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)宫颈癌筛查临床实践指南》[6]中关于宫颈癌的诊断标准,且经病理学检查确诊,临床分期为Ⅰ~Ⅲ期;②初始治疗方案均为手术治疗,无生育需求,手术方案为腹腔镜下广泛子宫全切术+盆腔淋巴结清扫术±腹主动脉旁淋巴结切除术;③一般情况良好,手术和放疗耐受性良好,且无相关禁忌证;④年龄40~60岁;⑤病历资料、随访资料均完整,可正常获取研究所需全部数据。排除标准:①初始治疗方案为放疗、化疗、介入治疗等;②合并先天性心脏病、中重度贫血、精神障碍等;③存在肝肾功能异常、严重感染等放、化疗禁忌证;④存在≥2种原发肿瘤、既往恶性肿瘤史。依据纳入和排除标准,本研究共纳入82 例宫颈癌患者,年龄40~60 岁,平均(50.13±5.04)岁;体重指数18.6~23.7 kg/m2,平均(20.44±3.61)kg/m2。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 资料收集及PNI 计算方法
收集患者的临床特征,包括年龄、分化程度、临床分期、病理类型、淋巴结转移情况、宫旁受累情况、放疗方案。根据患者入院后血常规及血生化检查结果计算PNI,PNI=血清白蛋白(g/L)+5×外周血淋巴细胞总数(×109/L)[7]。
1.3 随访
治疗结束后对所有患者进行为期3 年的随访,随访时间截至2020 年6 月,前2 年每3 个月随访1次,第3 年每6 个月随访1 次,随访内容包括妇科检查、肿瘤标志物检查、影像学检查(B 超、CT、MRI等)、细胞学检查等。记录患者的总生存率,总生存时间指初始治疗时间至患者死亡或末次随访时间。
1.4 放疗疗效评价标准
放疗前及放疗结束后1 个月内,收集患者的影像学(盆腔CT、MRI、彩超等)检查资料,比较两次检查的病灶缩小情况,参照实体瘤疗效评价标准[8]评估近期疗效:完全缓解(complete response,CR),目标病灶完全消失,且未出现新病灶;部分缓解(partial response,PR),目标病灶体积缩小≥50%;疾病稳定(stable disease,SD),目标病灶体积缩小﹤50%或增大﹤25%;疾病进展(progressive disease,PD),肿瘤病灶体积缩小≥25%或出现新病灶。
1.5 统计学方法
采用SPSS 17.0 软件对所有数据统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the cure,AUC),评估PNI 对宫颈癌患者生存情况的预测价值,cut-off值为ROC曲线上约登指数(灵敏度+特异度-1)的最大点;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank 检验;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 不同放疗疗效患者PNI 的比较
放疗结束后1 个月疗效评估结果显示,82 例宫颈癌患者中,CR 55 例,PR 16 例,SD 6 例,PD 5 例,PNI 范围为40.78~60.11,平均(49.87±4.63)。将CR+PR 患者作为有效组,SD+PD 患者作为无效组,比较两组患者的PNI,结果显示,有效组患者的PIN为(53.24±2.35),明显高于无效组患者的(46.81±2.44),差异有统计学意义(t=8.403,P=0.000)。
2.2 PNI 对宫颈癌患者生存情况的预测价值
ROC 曲线分析结果显示:PNI 评估宫颈癌患者生存情况的AUC 为0.696(95%CI:0.577~0.815),且cut-off 值为48.82 时约登指数最大,为0.378,此时灵敏度为63.41%、特异度为74.36%。(图1)
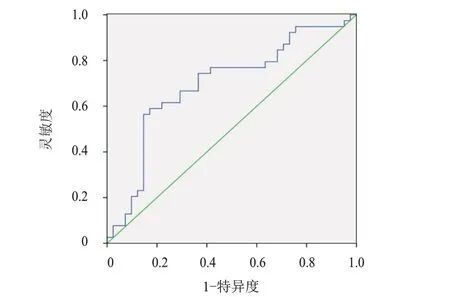
图1 PNI预测宫颈癌患者生存情况的ROC曲线
2.3 不同PNI 宫颈癌患者临床特征的比较
根据PNI 在ROC 曲线上cut-off 值(48.82)将82例宫颈癌患者分为高值组(PNI﹥48.82,n=39)和低值组(PNI≤48.82,n=43)。高值组和低值组宫颈癌患者年龄、分化程度、病理类型、宫旁受累情况、放疗方案比较,差异均无统计学意义(P﹥0.05),高值组和低值组宫颈癌患者临床分期、淋巴结转移情况比较,差异均有统计学意义(P﹤0.05)。(表1)
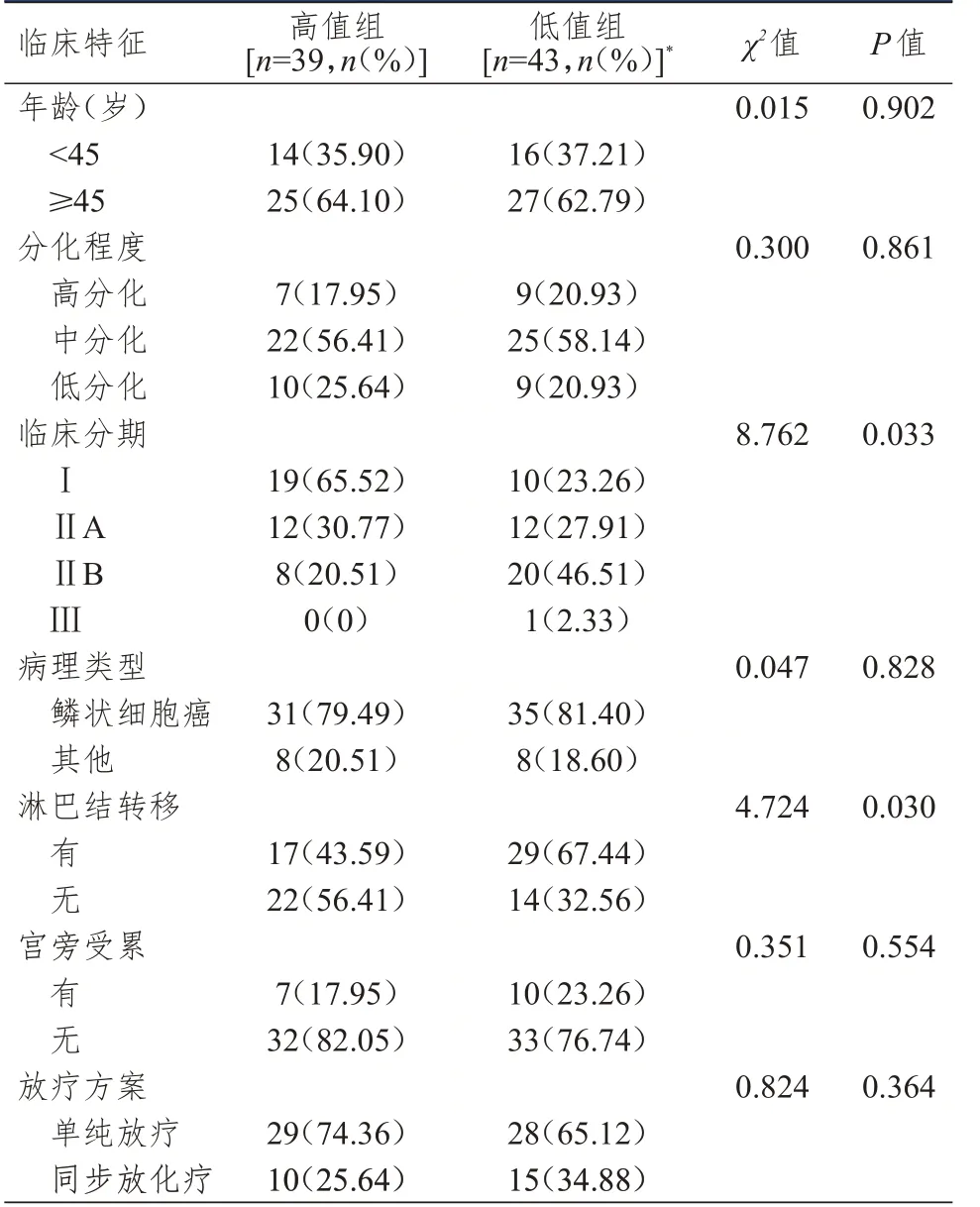
表1 高值组和低值组宫颈癌患者临床特征的比较
2.4 不同PNI 宫颈癌患者预后情况的比较
82例宫颈癌患者3年总生存率为84.15%(69/82),其中高值组患者的3 年总生存率为90.70%,高于低值组患者的74.36%,差异有统计学意义(χ2=3.996,P=0.046)。(图2)
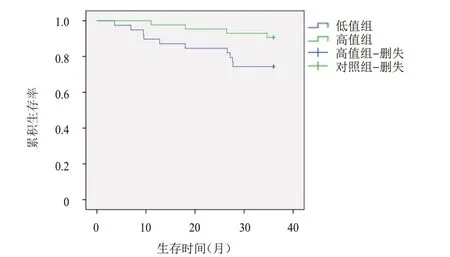
图2 高值组(PNI>48.82,n=39)和低值组(PNI≤48.82,n=43)宫颈癌患者的总生存曲线
3 讨论
近年基因组学、蛋白组学在肿瘤发生发展、侵袭、转移方面的研究不断深入,学者们逐渐发现,机体的营养状态、全身炎症反应状态、免疫调节机制等均可在一定程度上影响肿瘤的发生、侵袭、转移等过程。随着对恶性肿瘤免疫-营养学指标的研究不断深入,临床对PNI 关注度日益升高,该指标利用血清学中白蛋白水平和淋巴细胞计数进行评估,其使用的两项指标均可在某种程度上间接反映患者的营养状况和机体免疫性能[9-10]。多项临床研究结果均能证实,PNI 与肿瘤患者的预后密切相关,该指标可综合反映患者的营养状态和免疫状态,且该指标使用方式简单、便捷且高效,现已被用于多种实体瘤中[11-15]。
本研究对82 例宫颈癌根治术后放疗患者入院时PNI 进行评估,ROC 曲线分析发现,PNI 评估宫颈癌患者生存情况的AUC 为0.696(95%CI:0.577~0.815),且cut-off 值为48.82 时约登指数最大,为0.378,此时灵敏度为63.41%、特异度为74.36%,与徐莹莹等[16]的研究结果类似;同时本研究根据cutoff 值对患者进行分组,结果发现,高值组患者的3年总生存率为90.70%,高于低值组患者的74.36%,侧面证实该指标对患者预后有一定的预测价值。
本研究结果显示,高值组宫颈癌患者临床分期较低,更不容易发生淋巴结转移,这与林贵山和骆华春[17]的研究结果类似,表明PNI 对患者的预后也有一定预测作用。这可能是因为临床分期过高患者的预后相对较差,而淋巴结转移也会严重影响患者的预后。本研究还发现,PNI 高的患者放疗总有效率相对较高,进一步证实PNI 或可作为疗效预测的指标。
综上所述,PNI对宫颈癌放疗患者的预后有一定预测价值,或可作为预后评估的指标辅助临床治疗。
