线粒体内膜转位酶50 在人胃癌组织中的表达及其临床意义△
2022-08-24张王吉左云施晓婧吴倍佩倪晨张永芹
张王吉,左云,施晓婧,吴倍佩,倪晨,张永芹
苏州大学附属张家港医院肿瘤科,江苏 张家港 215600
胃癌是目前世界范围内第五大常见恶性肿瘤,也是肿瘤相关死亡的第四大原因,2020 年新增胃癌患者100 多万例,估计有79.6 万例死亡(相当于全球每13 例死亡病例中就有1 例因胃癌所致)[1]。中国是胃癌的高发国家,2020 年中国胃癌新发病例和死亡病例分别占全球的62.3%和51.4%[1]。由于胃癌早期症状不典型及患者对症状的忽视,致使中国约80%的初治胃癌患者已处于进展期和晚期[2-3]。胃癌晚期治疗以化疗、放疗、靶向治疗和免疫治疗等综合治疗为主,但治疗效果不尽如人意,5 年生存率仅为35.9%[4]。因此,了解胃癌的发生发展机制,寻找新的诊断和治疗靶点成为胃癌治疗的重中之重。线粒体内膜转位酶50(translocase of inner mitochondrial membrane 50,TIM50)是位于线粒体内膜的TIM23 复合体的一个亚基,在线粒体蛋白输入和分选中发挥重要作用[5]。人TIM50 由353 个氨基酸组成,大小约为40 kD[6]。在基础条件下,TIM50 作为线粒体蛋白前序列受体,与TIM23亚基相互作用促进前序列蛋白从线粒体外膜转位酶向TIM23 移交,也触发了TIM23 前蛋白转导通道基质侧的输入马达的组装和激活,在线粒体蛋白输入过程中起早期作用[7]。近年来,TIM50 促进多种肿瘤发生发展的作用日益受到关注。研究表明,TIM50作为潜在致癌因子在乳腺癌、非小细胞肺癌、食管癌、肾母细胞癌等恶性肿瘤中呈高表达[8-12]。但TIM50 在人胃癌中的表达国内外文献尚无报道。因此,本研究对人胃癌组织中TIM50 的表达及其临床意义进行探讨,现报道如下。
1 对象与方法
1.1 研究对象
选取2016 年6 月至2018 年7 月苏州大学附属张家港医院收治的85 例胃癌患者作为研究对象。纳入标准:①接受胃癌切除术且经病理检查确诊为胃癌;②术前未接受过放化疗。排除标准:①合并其他肿瘤;②病历资料不完整。85 例胃癌患者中,男性56 例,女性29 例;年龄:≥60 岁55 例,﹤60岁30 例;肿瘤直径:≥5 cm 58 例,﹤5 cm 27 例;病理分级:Ⅰ/Ⅱ级25 例,Ⅲ/Ⅳ级60 例;TNM 分期:Ⅰ/Ⅱ期33 例,Ⅲ/Ⅳ期52 例;有淋巴结转移60 例,无淋巴结转移25 例;有远处转移1 例,无远处转移84 例。取85 例胃癌患者的胃癌组织及癌旁组织。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 随访
以复诊或电话方式对胃癌患者术后生存情况进行随访,特殊患者必要时上门回访。总生存时间为术后至随访截止时间或死亡时间的间隔。随访时间36 个月,随访截止时间为2021 年7 月。
1.3 主要试剂
兔抗TIM50 多克隆抗体(22229-1-AP)购自美国PROTEINTECH 公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗及CY3 标记的山羊抗兔荧光二抗均购自Life 公司。
1.4 免疫组化检测
取新鲜胃癌组织及癌旁组织标本,4%甲醛固定,脱水处理后用石蜡包埋,4 μm 厚度连续切片。切片常规二甲苯脱蜡,梯度乙醇脱水,室温下3%H2O2孵育10 min。磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤3 min×3 次,抗原修复后加山羊血清室温封闭1 h;加兔抗TIM50 多克隆一抗(1∶1000),4 ℃过夜;PBS 洗涤3 min×3 次,加入HRP 标记的山羊抗兔二抗,室温孵育30 min;PBS洗涤5 min×3 次,二氨基联苯胺(diaminobenzidine,DAB)显色5 min;苏木精复染,梯度乙醇脱水,二甲苯浸泡,中性树脂封片。待其干燥后,用光学显微镜(×200)观察染色情况。
1.5 免疫组化评估
阳性细胞百分比评分:无阳性细胞为0分,1%~25%为1 分,26%~50%为2 分,51%~75%为3 分,76%~100%为4 分。染色强度评分:无染色为0 分,弱染色为1 分(+),中等强度染色为2 分(++),强染色为3 分(+++)。总评分=阳性细胞百分比评分×染色强度评分。根据总评分将患者分为两组,总评分0~4 分为TIM50 低表达组,总评分5~12 分为TIM50 高表达组。
1.6 统计学方法
采用SPSS 25.0 软件对数据进行统计分析。计数资料以例数及率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier 法绘制生存曲线,生存情况的比较采用Log-rank 检验。以P﹤0.05 为差异有统计学意义。
2 结果
2.1 TIM50 表达情况的比较
免疫组化结果显示,胃癌组织中TIM50 主要定位于细胞质中(图1)。85 例胃癌组织中58 例(68.2%)患者TIM50 高表达,27 例(31.8%)患者TIM50 低表达;85 例癌旁组织中11 例(12.9%)患者TIM50 高表达,74 例(87.1%)患者TIM50 低表达;胃癌组织中TIM50 高表达率明显高于癌旁组织,差异有统计学意义(χ2=53.886,P﹤0.01)。
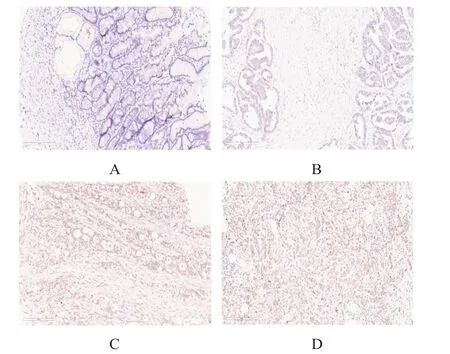
图1 胃癌组织及癌旁组织中TIM50的表达情况(免疫组化染色,×200)
2.2 不同临床特征胃癌患者的胃癌组织中TIM50表达情况的比较
不同病理分级胃癌患者的胃癌组织中TIM50表达情况比较,差异有统计学意义(P﹤0.05);不同年龄、性别、肿瘤直径、TNM 分期、T 分期、N 分期、M 分期胃癌患者的胃癌组织中TIM50 表达情况比较,差异均无统计学意义(P﹥0.05)。(表1)
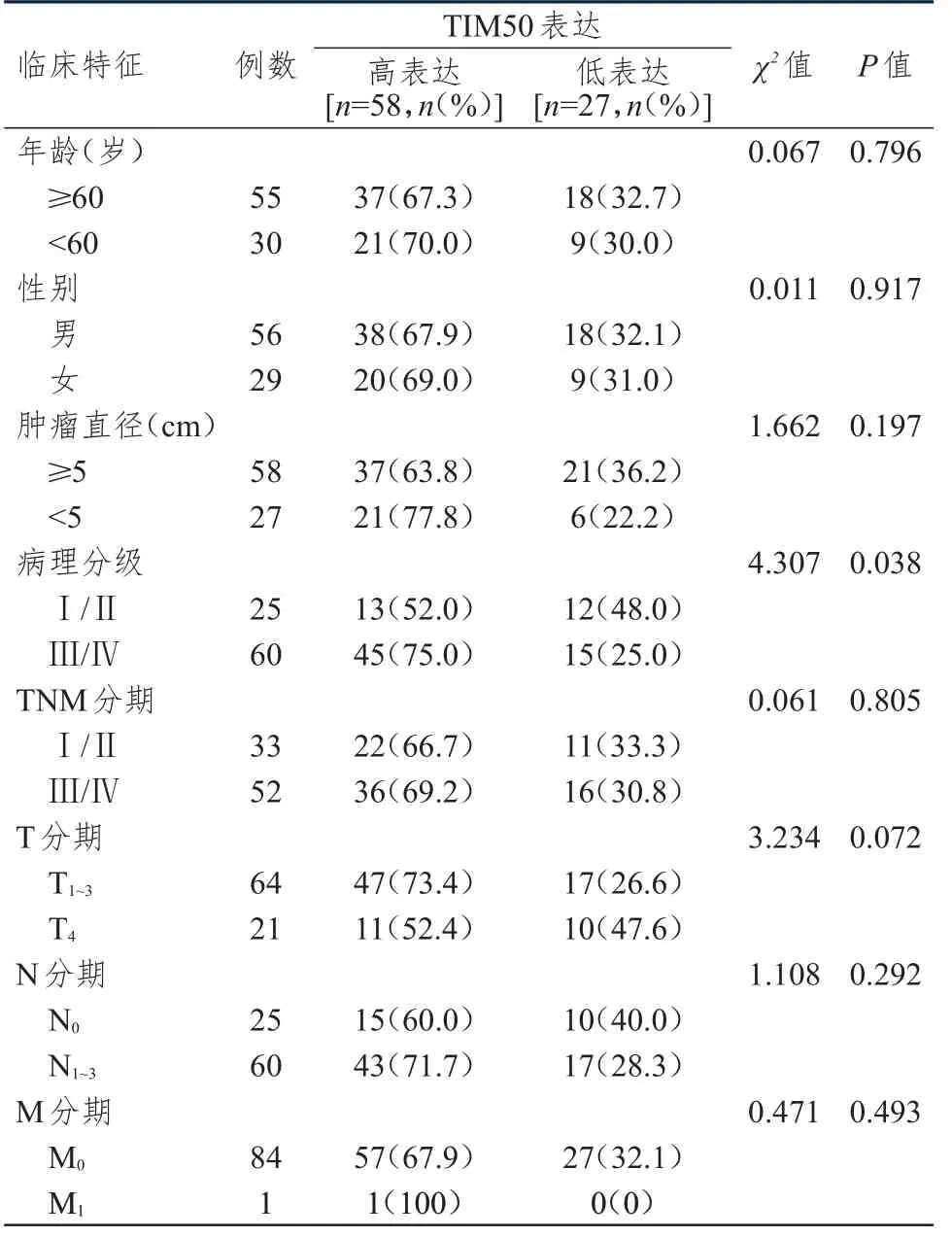
表1 不同临床特征胃癌患者的胃癌组织中TIM50 表达情况的比较
2.3 生存情况的比较
采用Kaplan-Meier 法绘制胃癌患者生存曲线,结果表明,TIM50 高表达与TIM50 低表达胃癌患者的3 年生存率比较,差异无统计学意义(χ2=1.862,P=0.172)。(图2)

图2 TIM50高表达(n=58)与低表达(n=27)胃癌患者的生存曲线
3 讨论
胃癌是中国常见的恶性肿瘤,其发病率和病死率均居第二位,严重危害居民的生命健康[13]。目前国内外研究明确胃癌的病因包括幽门螺杆菌感染、不良饮食习惯、非甾体抗炎药等,但胃癌发生发展分子生物学机制尚未明确[14]。
越来越多证据表明,TIM50 除参与线粒体蛋白输入外,还参与其他功能。研究发现,人TIM50 在肾上腺和睾丸类固醇合成中发挥重要作用[15]。此外,TIM50 也参与了白细胞介素-1(interleukin-1,IL-1)诱导的白细胞介素-1 受体相关激酶2(interleukin-1 receptor-associated kinase 2,IRAK2)线粒体易位抑制脂肪细胞氧化代谢途径[16]。有趣的是,TIM50 可以通过降低氧化应激来减轻病理性心肌肥厚[17],有望成为防治心肌肥厚和心力衰竭的新靶点。多篇报道表明,TIM50 基因突变与先天代谢缺陷疾病3-甲基戊烯二酸尿症相关,此外研究者对患者线粒体功能综合分析后发现,TIM50 突变通过靶向线粒体的几个关键方面,包括维持线粒体形态、Oxphos 组装和线粒体呼吸能力,导致线粒体功能的普遍缺陷[18-21]。
近年来研究发现,TIM50 水平与各种肿瘤细胞的生长和增殖直接相关[10]。据报道,TIM50 的表达可能通过p53 突变体的过度表达而上调,从而导致乳腺癌和非小细胞肺癌的生长和化学耐药[9]。研究表明,TIM50 可能抑制乳腺癌细胞增殖,促进细胞凋亡[11]。在非小细胞肺癌中,TIM50 水平与肿瘤大小、TNM 分期、淋巴结转移和总生存率直接相关。同一项研究还发现,TIM50 通过细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路促进肿瘤进展并预测非小细胞肺癌患者的不良预后[10]。据报道,肉瘤中发挥抗肿瘤作用的miRNA-7 可调节TIM50 的表达[22]。食管癌中,LOC100133669 表达上调与预后不良相关,在研究潜在致癌机制时发现,其与TIM50 相互结合通过抑制泛素化上调其蛋白水平。此外,LOC100133669 基因被敲低时,过表达TIM50 可挽救食管癌细胞的生长[12]。研究发现,TIM50可能是肾母细胞瘤中原癌基因MYCN的靶基因,表达水平随着MYCN的耗竭而下调[8]。为了分析TIM50在胃癌中扮演的角色,本研究检测并分析了TIM50 在胃癌及癌旁组织中的表达情况及与患者临床特征的关系。
本研究结果显示,85 例患者胃癌组织中TIM50 高表达率明显高于癌旁组织,说明TIM50 与胃癌的发生发展关系密切。研究还进一步发现,胃癌组织中TIM50 蛋白表达与病理分级有关,病理分级Ⅲ~Ⅳ级胃癌患者的胃癌组织中TIM50 阳性表达率高于Ⅰ~Ⅱ级患者(P﹤0.05);TIM50 表达与年龄、性别、肿瘤直径、T 分期、N 分期、M 分期、TNM 分期无关。该结论提示TIM50 表达与胃癌恶性程度有关。本研究还表明,TIM50 高表达患者的3 年生存率较TIM50 低表达患者低,但差异无统计学意义,考虑与随访时间太短有关,将继续随访,探求5 年生存率差异是否有统计学意义。
综上所述,TIM50 在胃癌组织中呈高表达,与胃癌的发生发展有关,TIM50 有可能成为新的临床胃癌早期诊治靶点,并对评价胃癌恶性程度、早期诊断具有重要意义。
