产气荚膜梭菌β2毒素单克隆抗体间接ELISA检测方法的建立
2022-08-16马玲玲张思雨王玉炯
吴 霜 ,马玲玲,张思雨 ,王 东,李 勇,王玉炯,曾 瑾
( 1.宁夏大学 西部特色生物资源保护与利用教育部重点实验室,银川 750021;2.宁夏大学 生命科学学院,银川 750021)
产气荚膜梭菌(Clostridiumperfringens)作为一种广泛分布于土壤、水域等环境中的革兰氏阳性厌氧菌,由美国著名病理学家Welchii和Nuttad在一具腐败尸体产生气泡的血管中首次分离获得,又称魏氏梭菌[1]。该菌是一种梭状芽孢杆菌,因能分解肌肉和结缔组织中的糖而导致组织气疽,菌体能形成荚膜,因此称为产气荚膜梭菌[2]。临床上,产气荚膜梭菌可以引起食物中毒[3]、坏死性结肠炎、肠毒血症等,也可引起气性坏疽、梭菌性肌无力等全身性疾病[4]。
产气荚膜梭菌的致病因子是其产生的多种外毒素,目前所知的产气荚膜梭菌毒素有18种之多[5],其中β2毒素是Gibert等[6]首次从仔猪坏死性肠炎病料的培养物上清液中分离得到的,是一种具有细胞毒性和致死性的强毒素,β2毒素与多种动物的胃肠道疾病有关,该毒素在患有肠炎动物粪便中的阳性检出率极高,可达80%~91%,而在正常的动物粪便中的检出率只有11.1%,此结果有力证明了β2毒素引起动物肠炎这一观点[7]。针对产气荚膜梭菌β2毒素的检测,目前主要是PCR相关的核酸检测,但该方法仅能检测菌株是否含有β2毒素的编码基因,而不能检测β2毒素基因是否表达,并对动物造成影响。Gohari等[8]报道,在使用Real-timePCR以及ELISA检测方法对加拿大安大略省的55匹患有腹泻的马的粪便进行产气荚膜梭菌毒素检测过程中,使用捕获ELISA方法检测到在7.2% 的粪便样本中存在β2毒素。Aschfalk等[9]对收集的挪威北部海岸捕获的大西洋鳕鱼粪便进行细菌学检测时,使用ELISA方法检测了产气荚膜梭菌α、β1以及ε毒素,而在检测β2毒素时仅使用PCR方法,并检测到2.1%的菌株为β2毒素基因携带菌株。本研究以纯化的产气荚膜梭菌β2毒素重组蛋白为包被抗原建立一种快速有效、可以高通量使用的间接ELISA检测方法,为产气荚膜梭菌病的流行病学调查和疫苗免疫效果评价等提供技术支撑。
1 材料与方法
1.1 材料
产气荚膜梭菌β2毒素重组表达菌株BL21(DE3)pTIG-cpb2、α毒素重组表达菌株BL21(DE3)pET28-alpha、β1毒素重组表达菌株BL21(DE3)pTIG-cpb1、ε毒素重组表达菌株BL21(DE3)pTIG-epsilon、对照菌株BL21(DE3)pET32a均由本实验室前期构建并保存[10];201份牛血清采自宁夏石嘴山市益农金禾养殖有限公司;2份产气荚膜梭菌阳性血清、21株产气荚膜梭菌杂交瘤细胞株为本实验室前期制备并保存[11]、单增李斯特菌(ATCC 19115)、沙门氏菌(CMCC 50115)、4种大肠杆菌(C83905、C83922、C83529、C83684)、铜绿假单孢菌、金黄色葡萄球菌、藤黄微球菌均由本实验室保存。
HRP-羊抗鼠IgG(ZB-2305)、HRP-山羊抗牛IgG(AI11015)、PBS粉剂(pH 7.5)购自北京中杉金桥生物有限公司;BCA蛋白检测试剂盒购自南京凯基生物有限公司;SuperBlockTMT20 BlockingBuffer购自Thermo Scientific(WB315798);邻苯二胺(OPD)购自麦克林生物有限公司;PAGE凝胶快速试剂盒购自上海雅酶生物技术有限公司;牛血清白蛋白、Tween-20、IPTG、透析袋购自索莱宝生物科技有限公司;美国BD Difco脱脂奶粉购自上海凌仪生物科技有限公司;快速封闭液(P30500)购自新赛美生物科技有限公司;6×DNA/6×Protein Loading buffer购自全式金生物技术有限公司;胎牛血清、RPMI 1640培养基购自美国Gibco公司;雅酶双色预染蛋白Marker(WJ102)购自上海雅酶生物科技有限公司;小鼠单克隆抗体亚型鉴定试剂盒购自武汉三鹰生物技术有限公司。
1.2 方法
1.2.1 菌株的表达及纯化
β2毒素重组表达菌株BL21(DE3)pTIG-cpb2冻存物划线至含氨苄青霉素的LB固体培养基上,过夜培养,挑取单菌落摇瓶37 ℃培养,菌液培养至OD600为0.6~0.8时,加入终浓度为1 mmol/L的IPTG诱导表达,取菌体裂解上清液,以AKTA纯化系统用镍亲和层析法进行蛋白纯化,所得蛋白经透析后,经SAS-PAGE、Western Blot鉴定并进行BCA定量后分装保存于4 ℃为抗原备用。
1.2.2 产气荚膜梭菌β2毒素单克隆抗体ELISA功能的筛选
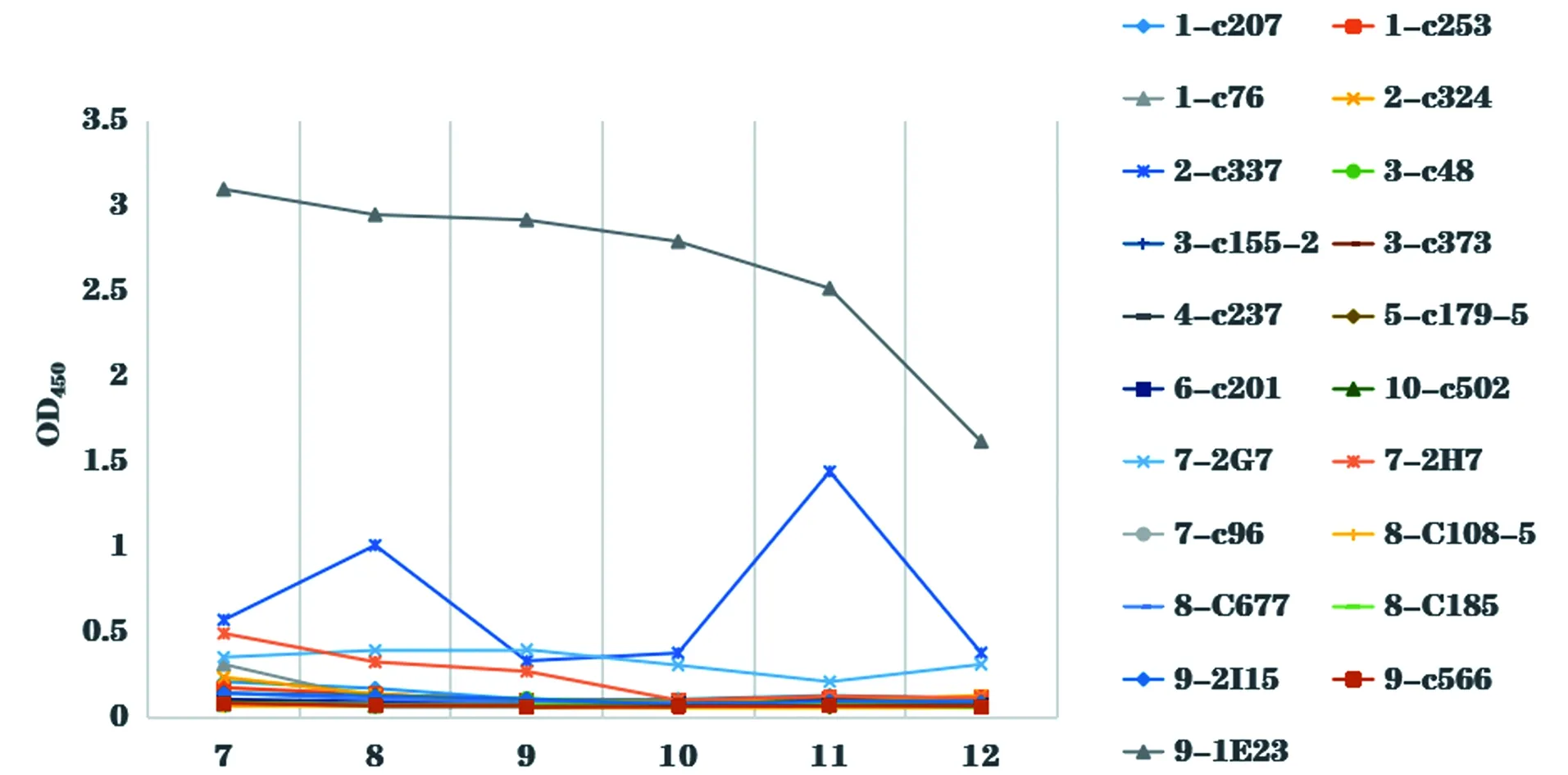
本课题组前期利用β2毒素的10个抗原肽段制备了9/1E23、2/C337、7/2H7、7/2G7等21株阳性杂交瘤细胞株[11],以纯化的产气荚膜梭菌β2毒素重组蛋白为包被抗原,4 ℃过夜,用5%脱脂牛奶37 ℃封闭2 h,以21株单克隆抗体做为一抗,分别作27、28、29、210、211、212和213的倍比稀释,同时设PBS空白对照,37 ℃作用1 h,以HRP-羊抗鼠IgG为二抗,按1∶2 000稀释,37 ℃孵育30 min,加入OPD和0.03% H2O2显色15 min后,加入终止液(2 mol/L H2SO4溶液),读取OD450值,筛选具有良好ELISA定量检测功能的抗体,作为后续建立方法所用一抗。
1.2.3 产气荚膜梭菌β2毒素单克隆抗体特异性检测
为检测产气荚膜梭菌β2毒素单克隆抗体9/1E23的特异性,对表达产气荚膜梭菌4种主要毒素的大肠杆菌菌株:BL21(DE3)pET28-alpha、BL21(DE3)pTIG-cpb1、BL21(DE3)pTIG-cpb2和BL21(DE3)pTIG-epsilon进行诱导培养,制备蛋白样进行SDS-PAGE凝胶电泳,并以产气荚膜梭菌β2毒素单克隆抗体为一抗,HRP-羊抗鼠 IgG为二抗进行Western Blot检测,验证McAb 9/1E23与α毒素、β1毒素、ε毒素以及大肠杆菌菌体蛋白是否存在交叉反应。
1.2.4 产气荚膜梭菌β2毒素单克隆抗体9/1E23的纯化
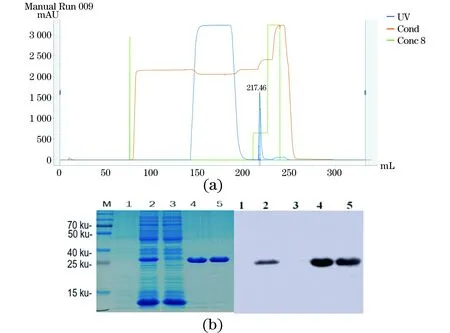
(1)单克隆抗体小鼠腹水的制备。取6只健康状态良好的BALB/c小鼠,每只腹腔注射0.5 mL的弗氏不完全佐剂进行预处理,用于后期制备腹水。将冻存于液氮罐中的McAb 9/1E23杂交瘤细胞接种至含10%胎牛血清的RPMI 1640培养基中复苏,进行细胞传代培养。待细胞生长旺盛时,调整细胞数量为5×106个/mL。每只BALB/c小鼠腹腔注射杂交瘤细胞0.2 mL。7~14 d后,收集腹部隆起的小鼠的腹水,装入离心管中8 000 r/min离心10 min,收集上清液,标记好后保存于-80℃冰箱中备用。(2)9/1E23杂交瘤细胞培养上清液的制备及纯化。复苏9/1E23杂交瘤细胞,进行细胞传代培养,待细胞状态良好后按1∶100的比例将细胞分传于75 cm2的培养瓶中,并置于CO2培养箱中直至细胞过度生长以富集抗体,约5 d后,待培养液变酸(变黄色)后,将细胞培养液转移到50 mL离心管中,室温下10 000 r/min离心10 min,收集上清液,用0.22 μm滤器进行过滤除菌,采用AKTA纯化系统使用Protein G纯化获得McAb,对纯化样品进行SDS-PAGE鉴定,并经BCA定量后加入50%甘油保存于-80℃冰箱中备用。
1.2.5 McAb 9/1E23亚型的鉴定
9/1E23杂交瘤细胞培养上清液进行1∶100稀释,加入50 μL/孔至小鼠单克隆抗体亚型鉴定试剂盒的ELISA孔中,将羊抗鼠IgA+lgIM+lgG-HRP 50 μL/孔加入样品孔中,室温孵育1 h,加入显色液观察。
1.2.6 基于McAb 9/1E23的间接ELISA检测方法的建立
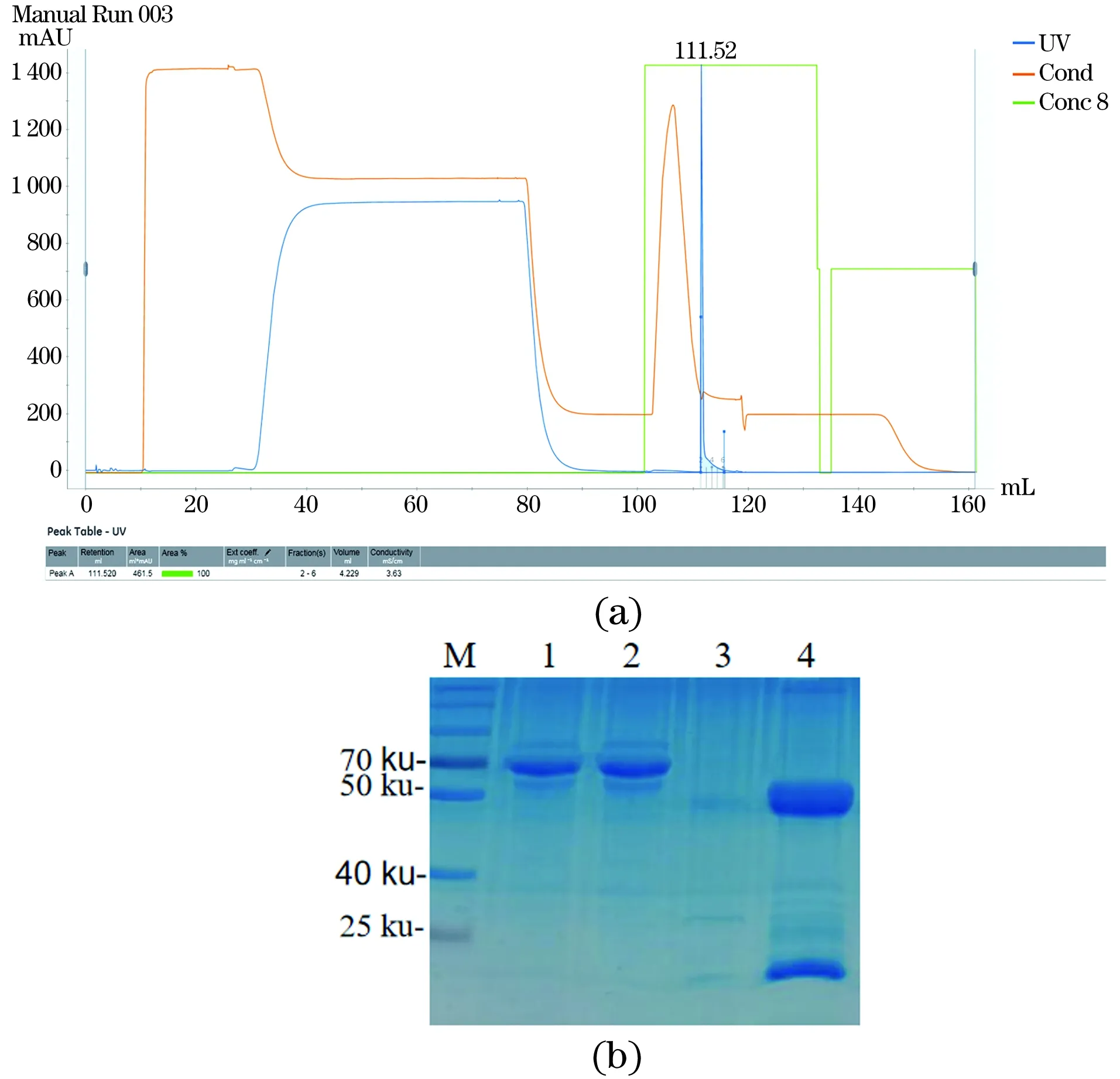
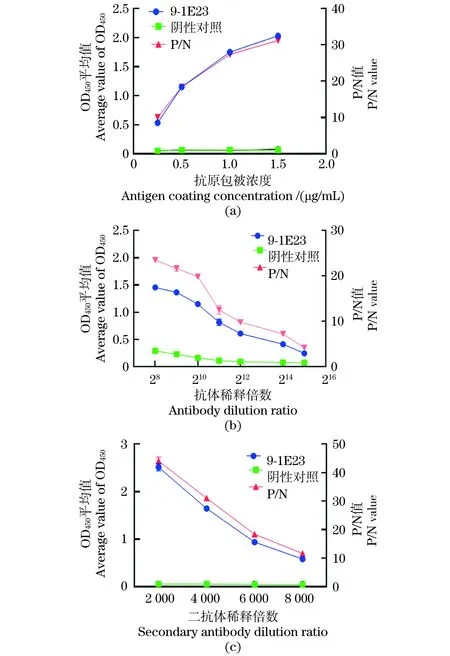
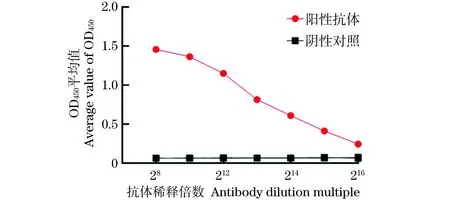
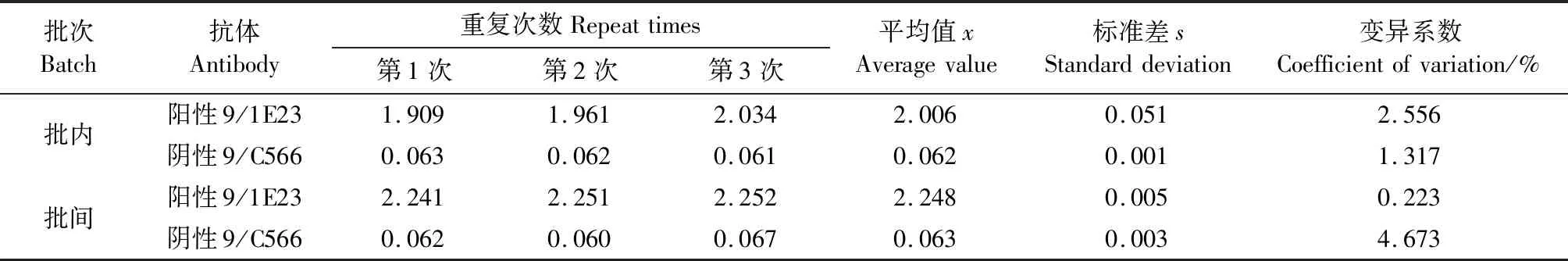
(1)特异性试验。分别以β2毒素重组蛋白、4种大肠杆菌(C83905、C83922、C83529、C83684)、单增李斯特菌、沙门氏菌、铜绿假单孢菌、金黄色葡萄球菌和藤黄微球菌的菌体培养物为包被抗原,以纯化的McAb 9/1E23为一抗,进行ELISA检测,每份样品设3个重复,验证McAb 9/1E23的检测特异性。(2)间接ELISA反应条件的优化。采用方阵滴定法,以β2毒素重组蛋白为包被抗原,以纯化的McAb 9/1E23为一抗,分别对抗原包被浓度(0.25、0.5、1和1.5 μg/mL),封闭液(1%、3%、5%牛血清白蛋白,1%、3%、5%脱脂奶粉),封闭时间(0.5、1.0、1.5和2 h),一抗稀释度(28、29、210、211、212、213和214),HPR-山羊抗小鼠IgG稀释度(1∶1 000、1∶2 000、1∶ 4 000和1∶ 8 000)等ELISA反应条件进行优化。(3)临界值的确定。利用所建立的间接ELISA检测方法,对28份阴性抗体进行ELISA测定,并计算平均OD450值(x)和标准方差(s)。当样品OD450值>x+3s时,判定为阳性;OD450值 2.1.1 β2毒素重组蛋白的SDS-PAGE、Western Blot分析及蛋白浓度的测定 培养本实验室保存的BL21(DE3)(pTIG-cpb2)菌株并利用AKTA纯化系统,采用镍亲和层析法,收集100 mmol/L咪唑峰[图1(a)],获得纯化的β2毒素重组蛋白,SDS-PAGE电泳结果显示28 ku处有目的条带[图1(b)],与所报道的β2蛋白分子质量一致;以产气荚膜梭菌β2毒素单克隆抗体9/1E23为一抗,HRP-山羊抗小鼠IgG为二抗,Western Blot结果显示,28 ku目的蛋白带能被β2毒素单克隆抗体9/1E23特异性识别。经过BCA法蛋白定量检测,纯化蛋白浓度为4.8 μg/uL,可作为后续ELISA方法的包被用抗原。 (a)BL21(DE3)pTIG-cpb2重组菌株表达蛋白纯化结果。(b)表达蛋白纯化结果SDS-PAGE及Western Blot检测结果[M:Marker;1:BL21(DE3)pET32a;2:纯化前的BL21(DE3)pTIG-cpb2菌体蛋白;3:流穿峰蛋白;4:100 mmol/L咪唑洗脱峰蛋白;5:透析后的纯化蛋白]。图1 β2毒素重组蛋白的表达、纯化及鉴定结果Figure 1 Expression,purification and identification results of β2 toxin recombinant protein 2.1.2 重组产气荚膜梭菌β2毒素蛋白质谱鉴定 由于目前商品化的产气荚膜梭菌β2毒素抗体难以获得,为了进一步确认BL21(DE3)pTIG-cpb2菌株表达的重组β2毒素蛋白的氨基酸序列与所报道的一致性,在对pTIG-cpb2载体进行核苷酸序列测定的基础上,对BL21(DE3)pTIG-cpb2菌株进行诱导表达后,切取SDS-PAGE电泳凝胶上的28 ku处目的条带,委托杭州景杰生物科技有限公司进行质谱分析,肽段质谱检测拼接后氨基酸序列(图2)经在NCBI 网站上进行Protein BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,结果显示目的蛋白肽氨基酸序列具有与产气荚膜梭菌β2毒素最相似的匹配度,表明BL21(DE3)pTIG-cpb2表达并纯化所获得的目的蛋白为重组产气荚膜梭菌β2毒素蛋白。 d:脱酰基位点;o:氧化还原位点。图2 β2毒素重组蛋白质谱分析后肽段拼接序列Figure 2 Peptide splicing sequence afterβ2 toxin recombinant protein profiling analysis 表达产气荚膜梭菌4种主要毒素的大肠杆菌菌株经诱导后制备蛋白样进行SDS-PAGE凝胶电泳[图3(b)],以产气荚膜梭菌β2毒素单克隆抗体为一抗进行Western Blot检测;结果显示McAb9/1E23经稀释1 000倍时可以特异性识别28 ku 的β2毒素重组蛋白,而与α毒素、β1毒素、ε毒素以及大肠杆菌菌体蛋白均未见交叉反应,表明制备的产气荚膜梭菌示McAb 9/1E23具有良好的特异性[图3(a)]。 (a)Western Blot检测结果;(b) SDS-PAGE凝胶电泳检测结果。M:Marker;1:BL21(DE3)pET32a;2:BL21(DE3)pET28-alpha;3:BL21(DE3)pTIG-cpb1;4:BL21(DE3) pTIG-cpb2;5:BL21(DE3)pTIG-epsilon。图3 产气荚膜梭菌β2毒素单克隆抗体特异性检测结果Figure 3 Clostridium perfringens β2 toxin monoclonal antibody specific detection results 本课题组前期利用β2毒素的10个抗原肽段制备了21株产气荚膜梭菌杂交瘤细胞株[11],本实验中对21个单克隆抗体进行ELISA检测能力的鉴定和筛选;结果显示(图4),单克隆抗体9/1E23、2/C337、7/2H7和7/2G7具有ELISA定量检测功能,并且在稀释212倍时仍可检测到目的蛋白,其中McAb 9/1E23表现尤为出色,可用于进一步建立间接ELISA检测方法的一抗使用。 图4 21株单克隆抗体的ELISA功能筛选结果Figure 4 ELISA function screening results of 21 monoclonal antibodies 2.4.1 McAb 9/1E23的纯化 制得9/1E23杂交瘤细胞培养上清液后,利用AKTA纯化系统,采用Protein G亲和柱上样,利用pH 2.7的100 mmol/L的甘氨酸-HCL溶液进行洗脱[图5(a)],收集洗脱峰蛋白并经SDS-PAGE凝胶电泳分析,可见53 ku左右的重链和23 ku左右的轻链蛋白条带[图5(b)],结果表明纯化结果较好;经过BCA法定量计算所得McAb 9/1E23蛋白浓度为2 μg/μL。 (a)McAb 9/1E23纯化峰图;(b)McAb9/1E23纯化结果SDS-PAGE结果(M:Marker;1、2:9/1E23杂交瘤细胞株培养上清液;3:纯化时流穿蛋白;4:纯化后的McAb 9/1E23)。图5 McAb 9/1E23纯化结果Figure 5 McAb 9/1E23 purification results 2.4.2 McAb 9/1E23亚型的鉴定 采用抗体分型试剂盒,对杂交瘤细胞株9/1E23培养上清液进行ELISA测定,结果表明McAb 9/1E23重链为IgG2b 型,轻链为κ型(图6)。 图6 McAb 9/1E23亚型的ELISA鉴定结果Figure 6 ELISA identification results of McAb 9/1E23 subtype 分别以β2毒素重组蛋白、4种大肠杆菌、单增李斯特菌、沙门氏菌、铜绿假单孢菌、金黄色葡萄球菌、藤黄微球菌的菌体培养物及产气荚膜梭菌其他主要毒素重组蛋白为包被抗原,以纯化的McAb 9/1E23为一抗,验证McAb 9/1E23的检测特异性。结果显示(图7),产气荚膜梭菌β2毒素蛋白包被抗原OD450为1.784,其他几种菌OD450均低于阳性临界值0.121,说明McAb 9/1E23具有良好的ELISA检测特异性功能。 图7 McAb 9/1E23特异性试验结果Figure 7 McAb 9/1E23 specificity test results 根据方阵滴定试验结果显示,β2重组蛋白包被浓度为0.5 μg/mL,McAb 9/1E23稀释比为1∶210时,OD450为1.15,OD450值为1左右,P/N大于2为18.4,此时阴性对照OD450值为0.063[图8(a)];HRP-山羊抗小鼠酶标抗体在稀释比为1∶2 000时,McAb 9/1E23的OD450为1.647,阳性抗体与阴性对照P/N值最大为31,此时阴性对照OD450为0.049[图8(b)]。因此在ELISA检测中,确定β2重组蛋白最适包被浓度为0.5 μg/mL,McAb 9/1E23抗体稀释比为1∶210,反应条件为37 ℃ 2 h,HRP-山羊抗小鼠酶标抗体的最佳稀释比为1∶2 000,最佳反应条件为37 ℃ 30 min[图8(c)],最佳封闭条件为5%脱脂牛奶,37 ℃封闭2 h。 (a)最佳抗原包被浓度的确定;(b)抗体稀释倍数的确定;(c)酶标二抗最佳稀释度的确定。图8 间接ELISA反应条件的优化结果Figure 8 Optimization results of indirect ELISA reaction conditions 利用所建立的间接ELISA检测方法,对30份阴性抗体进行ELISA测定,并计算这些样品的平均OD450值(x)和标准方差(s)。当样品OD450值>x+3s时,判定为阳性;OD450值 图9 临界值的确定Figure 9 Determination of critical value 通过统计学分析,其中阴性对照总体平均值为0.064,标准差s为0.019,故阳性临界值为0.121,阴性临界值为0.102。 将McAb 9/1E23按照倍比稀释,对建立并优化的间接ELISA检测方法进行灵敏性测试,结果显示在McAb 9/1E23稀释到1∶ 214时OD450为0.244(图10),仍在阳性临界值0.121以上,说明建立并优化好的间接ELISA检测方法灵敏性较高。 图10 优化后的间接ELISA检测方法灵敏性试验结果Figure 10 Sensitivity test results of the optimized indirect ELISA detection method 利用所建立的间接ELISA检测方法,对产气荚膜梭菌β2毒素阳性抗体(McAb 9/1E23)、阴性抗体(McAb 9/C556)进行批次和批间检测,计算变异系数,验证该方法的稳定性,结果显示3次批内检测变异系数为1.317%~2.556%,3次批间检测变异系数为0.223%~4.673%(表1),批间和批内重复的变异系数均小于5%,表明建立的该方法具有良好的稳定性。 表1 间接ELISA检测方法稳定性试验结果Table 1 Indirect ELISA test method stability test results 利用所建立的间接ELISA检测方法,分别对临床收集的201份健康牛血清、2份阳性血清、1份阴性血清样品进行ELISA检测,结果显示,检出201健康牛血清均为阴性,2份阳性血清为阳性,符合率均为100%,表明该方法检测结果可信度较高。 目前已报道的检测β2毒素在动物中的流行情况的方法较少,主要是采用基于PCR技术的核酸检测[12-16],部分文献中使用多克隆抗血清进行免疫组化或ELISA检测[13,17-18]。临床上亟需一种操作方便、灵敏性高、特异性好和稳定可靠的方法进行养殖场动物产气荚膜梭菌的流行病学调查和抗体水平的检测,而ELISA检测方法具有此优势,因此,建立一种针对产气荚膜梭β2毒素的间接ELISA检测方法非常必要[19-20]。 产气荚膜梭菌的培养较为复杂,产毒条件苛刻,而且产生的毒素种类繁杂[11],很难获得天然单一的β2毒素,而大肠杆菌表达系统作为最早开发和应用最广泛的经典表达系统,具有遗传背景清晰、选育快、成本低、表达量高、蛋白纯化容易、稳定性好、应用范围广等优点。本课题组利用基因重组技术构建并筛选获得BL21(DE3)pTIG-cpb2重组大肠杆菌,实现了β2重组毒素的大量表达,并利用AKTA纯化系统的金属离子亲和层析法获得纯化的重组β2毒素。同时,目前未见有产气荚膜梭菌β2 毒素的检测抗体出售,因此我们在对表达载体进行核苷酸测序的基础上,对重组β2毒素蛋白进行了质谱鉴定,进一步确认重组β2毒素的氨基酸序列,同时还解决了因外源表达时混有细菌蛋白干扰检测的问题。本研究建立的ELISA检测方法以纯化的重组β2 毒素为包被抗原,未见其他菌体或毒素的阳性血清发生交叉反应,提高了该方法的特异性。 本课题组前期利用β2毒素的10个抗原肽段制备了21株阳性的杂交瘤细胞株,其中的McAb 9/1E23具有良好的Western Blot、ELISA和免疫荧光检测功能[11]。本研究在前期工作基础上从21株单克隆抗体中筛选出了4株具有良好ELISA检测功能的杂交瘤细胞株,分别为9/1E23、2/C337、7/2H7和7/2G7,选取其中1株(9/1E23)作为一抗,以HRP-羊抗鼠IgG为二抗,通过优化反应条件,建立了产气荚膜梭菌β2毒素抗体间接ELISA检测方法。在灵敏性试验中,本研究建立的ELISA检测方法可以检测到稀释倍数达1∶214的抗体,表明该方法的灵敏性较好;在稳定性实验中,本方法的批间、批内重复变异系数均小于5%,表明该方法的重复性好;同时在符合性试验中,本研究建立的ELISA检测方法的阴性符合率为100%,由于本次进行检测的201份牛血清,采集于宁夏石嘴山市益农金禾养殖有限公司待转场的健康牛群,因此未见有β2毒素阳性血清检出;而阳性血清为本实验室保存的使用本实验室构建的产气荚膜梭菌β2毒素重组融合蛋白免疫的小鼠血清[11],本次阳性复合率为100%,表明该方法检测结果可信度高。2 结果及分析
2.1 β2毒素重组蛋白的表达、纯化及质谱鉴定

2.2 产气荚膜梭菌β2毒素单克隆抗体特异性检测

2.3 产气荚膜梭菌β2毒素单克隆抗体ELISA功能的筛选
2.4 9/1E23单克隆抗体的纯化及亚型鉴定
2.6 间接ELISA反应条件的优化结果

2.5 特异性实验

2.7 临界值的确定

2.8 间接ELISA检测方法灵敏性试验
2.9 间接ELISA检测方法稳定性试验
2.10 符合性试验
3 讨论与结论
