RNA支架系统介导大肠杆菌生产甲羟戊酸
2022-08-16董洪钢刘春立刘秀霞杨艳坤白仲虎
董洪钢,刘春立,刘秀霞,李 业,杨艳坤,白仲虎
(1.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122;2.江南大学 工业生物技术教育部重点实验室,无锡 214122;3.江南大学 生物工程学院,无锡 214122)
甲羟戊酸是合成萜类化合物的重要前体化合物,萜类化合物被广泛应用于医药、化妆品、香料和着色剂等方面,是甲羟戊酸代谢途径中间代谢产物[1]。甲羟戊酸途径存在于原核细胞和高等植物叶绿体中[2]。如图 1所示,甲羟戊酸代谢途径上游途径:乙酰辅酶 A在乙酰辅酶 A硫解酶和HMG-CoA 合成酶催化下缩合生成3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)。接着,HMG-CoA在HMG-CoA还原酶作用下生成甲羟戊酸 (MVA)。下游途径:MVA 经焦磷酸化和脱羧作用形成异戊二烯焦磷酸(IPP),经异构化转化为二甲烯丙基焦磷酸(DMAPP)。且上游甲羟戊酸中间代谢产物HMG-CoA大量积累会影响细胞生长[3]。

图1 甲羟戊酸途径Figure 1 Biosynthetic pathways of mevalonate
复杂代谢途径在引入异源宿主时,原本存在宿主中的天然调节系统常常会丢失,这可能导致相关外源代谢途径产生代谢物失衡,或者造成异源代谢途径中有毒中间代谢产物积累,抑制细胞生长[4]。研究人员受自然细胞组织启发,利用蛋白质及核酸在细胞体内构建不同种类人工区室化系统,以提高异源代谢途径效率[5-9]。Dueber等[10]通过蛋白质-蛋白质之间相互作用在大肠杆菌中构建蛋白质区室系统,引入甲羟戊酸合成途径,甲羟戊酸产量提高77倍。Müller等[11]将葡萄糖氧化酶(GOX)和辣根过氧化物酶(HRP)通过与DNA支架固定化,与无支架酶相比,两种支架系统反应效率均得到提高。Delebecque等[12]将RNA支架区室系统应用于氢气生产中,大幅提高氢气产量。现已将RNA支架系统设计为离散0维(0D)RNA支架,1维(1D)RNA支架和2维(2D)RNA支架。0D RNA支架具有共聚集代谢通路中的酶、减少有毒中间代谢产物积累和高产目标化合物的潜力[8,13-14]。RNA支架系统理论上包含两个模块:模块一为表达RNA支架;模块二为表达RBDs及代谢通路中的酶。
研究利用RNA支架系统提高大肠杆菌甲羟戊酸产量。首先,设计0D PP7 RNA支架系统。通过RNA凝胶迁移实验(RNA-EMSA)体外验证RNA适配体和其相对应RBDs是否存在相互作用。随后,构建RBDs与荧光蛋白融合表达的菌株以评估0D RNA支架系统效率。最后,构建异源MVA途径生产甲羟戊酸工程菌,并应用0D PP7 RNA支架系统以提高其甲羟戊酸产量。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
研究中大肠杆菌DH5α和BL21(DE3)分别应用于质粒克隆及全细胞催化。质粒pACYCDuet-1、pETDuet-1用于异源基因表达及0D PP7 RNA支架系统构建。合成基因及引物均来自金唯智(苏州);所用菌株及质粒如表 1所示。

表1 菌株和质粒Table 1 The strains and plasmids used in this study

续表1(Continued Table 1)
1.1.2 试剂和仪器
主要包括岛津高效液相色谱LC-20A;岛津气相色谱质谱联用仪(GCMS-QP2020 SYSTEM);蛋白纯化仪AKTA purifier UPC10(美国通用电气公司)。所用其他材料及设备参照文献[15]。
1.1.3 培养基和培养条件
Luria-Bertani(LB)培养基:酵母提取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L。用于培养大肠杆菌。M9培养基:33.7 mmol/L Na2PO4,22.0 mmol/L KH2PO4,8.55 mmol/L NaCl,9.35 mmol/L NH4Cl,1 mmol/L MgSO4,0.3 mmol/L CaCl2,1 mg/L生物素,1 mg/L维生素B1,0.134 mmol/L EDTA,31 mmol/L FeCl3·6H2O,6.2 mmol/L ZnCl2,0.76 mmol/L CuCl2·2H2O,0.42 mmol/L CoCl2·2H2O,1.62 mmol/L H3BO3,0.081 mmol/L MnCl2·H2O,3 g/L酵母提取物和20 g/L葡萄糖。用于甲羟戊酸生产。所有培养基中氨苄青霉素和氯霉素终浓度为100 mg/L和30 mg/L。
1.2 方法
1.2.1 载体构建
使用引物对BamH Ⅰ-mvaE-F/PstⅠ-mvaE-R、BamH Ⅰ-mvaS-F/PstⅠ-mvaS-R、BamH Ⅰ-ΔPP7-mvaE-F/PstⅠ-mvaE-R,以实验室前期构建的质粒为模板扩增基因mvaS、mvaE、ΔPP7mvaE,在pACYCDuet-1的第一个多克隆位点通过BamH Ⅰ和PstⅠ双酶切连接插入基因片段,得到质粒pACYCEH、pACYCSH、pACYCPEH。
使用引物对PET-PP7-F/PET-PP7-R线性化载体pETANTIPB,使用T4 PNK酶磷酸化PCR片段,通过T4连接酶构建重组质粒pETANTIP。引物对PP7-EGFP-F/PP7-EGFP-R和EGFP-PP7-F/EGFP-PP7-R融合基因GFP及ΔPP7。随后以pACYCDuet-1为模板骨架,通过同源重组构建质粒pACYCPGFP。以质粒pACYCPGFP为模板,使用引物对PP7-EGFP-F/pACYC-GFP-R线性化载体,使用T4 PNK酶磷酸化片段后通过T4连接酶构建重组质粒pACYCGFP。柔性蛋白接头连接mvaS和mvaE,并通过同源重组以质粒pACYCPGFP模板扩增骨架构建重组质粒得到pACYCPES。以质粒pACYCPES为骨架通过线性化构建质粒pACYCES。

表2 研究所用引物Table 2 Primes used in this study
1.2.2 RNA-EMSA实验
经超声破碎后胞内蛋白样品通过AKTA purifier纯化仪进行纯化。PP7 RNA探针由金唯智(苏州)合成,引物序列为rGrGrCrArCrArGrArArGrArUrArUrGrGrCrUrUrCrGrUrGrCrC,RNA-EMSA试剂盒购自赛默飞世尔,实验方法参考说明书(https:∥assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0011686_LightShift_Chemiluminescent_RNA_EMSA_UG.pdf)。
1.2.3 表达荧光蛋白菌株培养条件
平板上随机挑选3个菌落PCR验证为阳性克隆,接种至LB种子培养基于37 ℃,220 r/min恒温振荡培养箱过夜培养。次日转接至培养基LB中,当OD600至0.6~0.8添加 0.5 mmol/L IPTG 并降温至30 ℃诱导荧光蛋白表达。24、48 h取1 mL样品检测细胞密度及荧光强度。
1.2.4 荧光强度检测
样品稀释至适当浓度后,于F97 PRO荧光分光光度计和759S紫外可见分光光度计进行荧光和细胞密度的测定。单细胞荧光强度通过FACSArica III(BD Bioscience,Franklin Lakes,NJ,USA)测定。
1.2.5 甲羟戊酸发酵及样品制备和测定
发酵实验:在平板上随机挑选3个菌落PCR验证为阳性克隆,接种至LB种子培养基于37 ℃,220 r/min恒温振荡培养箱中过夜培养。次日按发酵液体积1%转接至发酵培养基M9中,OD600至0.6~0.8添加0.5 mmol/L IPTG并降温至30 ℃诱导蛋白表达发酵生产甲羟戊酸。24、48 h取1 mL样品检测细胞密度和甲羟戊酸产量。
样品制备及测定:取280 μL发酵液上清液与70 μL 300 mmol/L HCl和过量无水硫酸钠混合,将甲羟戊酸从酸形式转化为内酯形式。向每个样品中添加350 μL乙酸乙酯并在漩涡仪上以最大速度振荡3 min,离心取有机层。对上层乙酸乙酯层甲羟戊酸内酯含量采用GC/MS分析测定,色谱条件见参考文献[16]。
2 结果与分析
2.1 0D PP7 RNA 支架设计
RNA支架系统由表达RNA支架和表达融合RBDs及代谢通路中的酶组成。RNA结合结构域源自PP7病毒外壳蛋白,RBDs与其相应RNA适体紧密结合[17-18]。可以通过简单互补配对原则对核酸二级结构进行预测。RNA适配体PP7二级结构由RNAfolds(http:∥rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfolds.cgi)预测,见图2(a)。0D PP7RNA支架理论模型如图2(b)所示:蓝色线条代表这两段序列前后可以通过碱基之间互补配对原则形成二聚体,而RNA支架适配体理论上可以与RBDs相互作用募集RBDs。代谢通路中的酶与RBDs融合表达时,RNA支架系统通过RNA适配体与RBDs相互作用实现酶在空间上共聚集。

图2 0D PP7 RNA支架的示意图Figure 2 Schematic overview of the artificial 0D PP7 RNA scaffolds
2.2 RNA-EMSA体外验证适配体和RBDs相互作用
构建表达mvaE,mvaS,ΔPP7mvaE菌株(方法见1.2.1),分别使用引物对BamH Ⅰ-mvaE-F/T7Terminator Primer(2770bp);BamH Ⅰ-mvaS-F/PstⅠ-mvaS-R(1152bp);BamH Ⅰ-ΔPP7-mvaE-F/T7Terminator Primer(3180bp)以平板中的单菌落为模板进行菌落PCR验证,挑选条带大小正确的克隆送测序,获得正确克隆,菌落PCR验证图见图3(a)和(b)。RNA-EMSA实验结果如图3(c)。泳道1确认探针位置。相比泳道1,泳道2和4均无迁移,而泳道3呈现迁移。说明PP7适配体与蛋白MVAS、MVAE之间无相互作用,与ΔPP7之间存在相互作用。
2.3 应用荧光蛋白GFP评估RNA支架系统效率
质粒pETDuet-1与质粒pACYCPGFP、pACYCGFP及质粒pACYCduet-1共转化至大肠杆菌BL21(DE3)中,得到3个重组菌株(BLCCG、BLCPG、Control),以评估RBDs对GFP表达的影响程度。发酵实验(方法见1.2.3)结果如图4所示:IPTG诱导48h后,相比对照菌株BLCCG,表达RBDs菌株BLCPG的GFP相对强度提高129%[图4(b)];质粒pETANTIP和pACYCGFP共转化至大肠杆菌BL21(DE3)中,得到重组菌株(BLPCG)以评估RNA支架对GFP表达影响程度。相比对照菌株BLCCG,表达RNA支架的菌株BLPCG的GFP相对强度提高126%[图4(b)];将表达RNA支架质粒pETANTIP与pACYCPGFP共转化至大肠杆菌BL21(DE3)中,得到重组菌株BLPPG。相比对照菌株BLCCG,表达0D PP7RNA支架系统菌株BLPPG的荧光强度提高375%[图4(b)];同时,细胞绿色荧光蛋白强度也进行流式细胞仪检测,由实验结果可知:BLCCG中荧光强度平均值为15021,细胞占65.4%[图4(c)]。表达RBDs菌株BLCPG荧光强度平均值为34768,细胞占92.9%见[图4(d)];表达RNA支架菌株BLPCG荧光强度平均值为48471,细胞占86.7%[图4(e)]。表达RNA支架系统菌株BLPPG荧光强度平均值为69634,细胞占99.0%[图4(f)]。
2.4 构建异源途径合成甲羟戊酸
克隆来源于Enterococcusfaecalis(E.faecalis)编码乙酰辅酶A硫解酶/HMG-CoA还原酶基因mvaE及3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)合酶基因mvaS[19]。通过(GGGGS)3蛋白接头融合蛋白MVAE和MVAS,克隆得到pACYCDuet-1。菌落PCR验证见图5(a)经测序确认得到重组质粒pACYCES。将质粒pACYCES转化至大肠杆菌BL21(DE3),获得异源MVA途径合成甲羟戊酸工程菌BLCES。随后进行发酵实验,通过GC/MS检测发酵液中甲羟戊酸,样品制备和测定见1.2.5。实验结果如图5所示:(b)~(d)分别为1g/L 甲羟戊酸标样,对照菌株及菌株BLCES发酵液上清液GC检测结果。(e)和(f)为甲羟戊酸内酯质谱图。甲羟戊酸内酯保留时间为13.27min,图5(d)保留时间为13.27min出峰,且信号强度显著高于对照菌株,特征离子与甲羟戊酸内酯一致。以上结果表明异源MVA代谢途径已成功构建。

(a)菌落PCR验证结果,1~10为质粒 pACYCEH转化子菌落PCR条带,11~19为质粒 pACYCSH转化子菌落PCR条带,M1为DL10000 Maker;(b)菌落PCR验证结果,1~6为质粒pACYCPEH转化子菌落PCR条带,M1为DL10000 Maker;(c)1~4分别为PP7 probe、PP7 probe &MVAE、PP7 probe &ΔPP7MVAE和PP7 probe &MVAS。图3 RNA-EMSA 体外验证适配体和RBDs的相互作用Figure 3 In vitro validation of the binding of aptamers to RBDs by RNA-EMSA
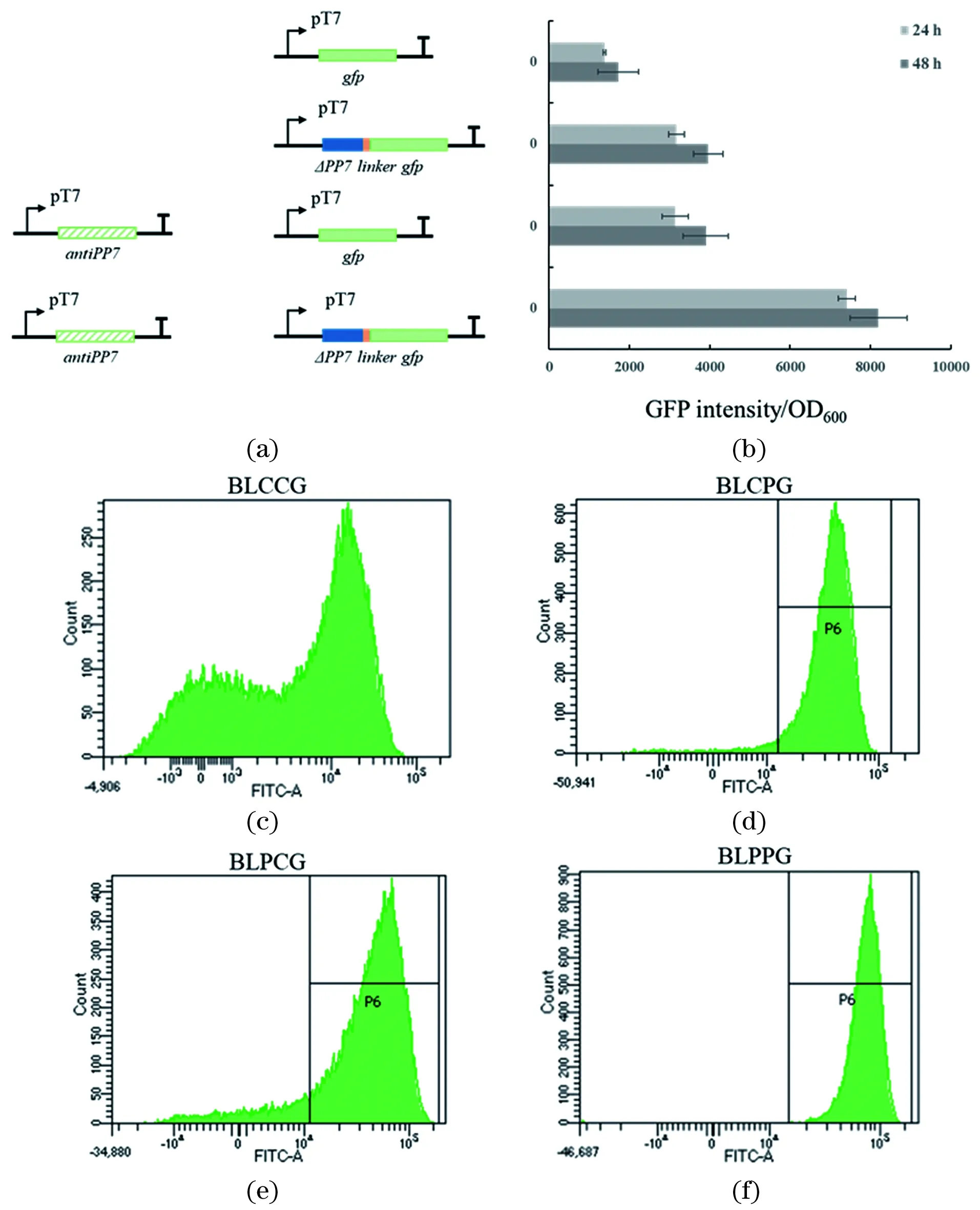
(a)评估0D PP7 RNA支架系统效率菌株构建示意图;(b)BLCCG、BLCPG、BLPCG、BLPPG相对GFP荧光强度;(c)~(f)BLCCG、BLCPG、BLPCG和BLPPG流式细胞仪荧光定量结果。图4 荧光蛋白GFP评估RNA支架系统效率Figure 4 Evaluation of RNA scaffold system efficiency by fluorescent protein GFP
2.5 应用0D RNA支架系统提高甲羟戊酸产量
共转化质粒pACYCES、pACYCPES、pETANTIP和pETDuet-1,得到4个菌株(BLCES、BLPES、BLCPES和BLPPES),进行发酵实验(方法见1.2.5)。基于前期预实验,IPTG诱导24h取完待测样后,补加终浓度为10g/L葡萄糖。
反应原理图如图6(a)所示,上图示意无支架系统胞内反应理论模型,下图示意存在RNA支架系统胞内反应理论模型。甲羟戊酸产量如图6(b),IPTG诱导48h后,相比对照菌株BLCCES,表达RNA支架菌株BLPCES甲羟戊酸产量提高了47%,达2.49g/L。表达RBDs菌株BLCPES甲羟戊酸产量略有提升,提高了14%,达1.95g/L。表达RNA支架系统菌株BLPPES甲羟戊酸产量增加了84%,达3.13g/L。
细胞密度如图7(a)所示,OD600为3~6。碳源消耗如图7(b)所示,IPTG诱导24h后,不同菌株发酵液中残糖浓度降到4g/L左右。补充碳源后,相应碳源消耗量与相对应甲羟戊酸产量吻合,菌株BLPPES碳源消耗最多,甲羟戊酸产量最高。
3 讨论
研究在大肠杆菌中引入0D PP7RNA支架系统,基于上游MVA途径外源基因,构建生成甲羟戊酸工程菌。相比对照菌株BLCCES,表达0D PP7RNA支架系统工程菌BLPPES提高甲羟戊酸发酵浓度至3.13g/L。首先设计0D PP7RNA支架系统,并通过RNA-EMSA体外证明RNA支架系统中适配体与RBDs存在相互作用。以GFP评估0D PP7RNA支架系统效率,结果表明:与对照相比,表达RNA支架系统菌株BLPPG荧光强度提高了375%。利用0D RNA支架系统提高大肠杆菌生产甲羟戊酸的研究发现,表达RNA支架菌株甲羟戊酸产量比对照略有提升,与使用GFP评估RNA支架系统效率结果趋势一致。表达0D PP7RNA支架系统菌株甲羟戊酸产量最高,说明RNA支架系统可提高大肠杆菌生产甲羟戊酸的产量。因此,RNA支架系统有潜力应用于复杂代谢途径(如异戊二烯合成途径)提高目标化合物产量。

(a)菌落PCR验证结果;标样(b)、对照(c)以及重组菌株BLES的GC检测结果(d);(e)(f)甲羟戊酸内酯质谱图。图5 异源MVA途径菌株构建验证Figure 5 Construction and verification of heterologous MVA pathway strains

(a)有无RNA支架反应示意图;(b)甲羟戊酸产量。图6 表达RNA支架系统对合成甲羟戊酸的影响Figure 6 Effect of expression RNA scaffold system on synthesis of mevalonate

(a)菌株细胞密度;(b)发酵液中残糖浓度和甲羟戊酸产量。图7 细胞生长及碳源消耗情况Figure 7 Cell growth and carbon source consumption
