吗啡成瘾消退及纳洛酮对前额叶脑电功率谱的影响
2022-08-16李春春王晓琴王功伍
李春春,王晓琴,王功伍,4,曹 军
(1.云南师范大学 生命科学学院 生物能源持续开发利用教育部工程研究中心和云南省生物质能与环境生物技术重点实验室,昆明 650500;2.云南师范大学 体育学院,昆明 650500;3.云南大学 生态与环境学院 云南省植物繁殖适应与进化生态学重点实验室,昆明 650500;4.昆明医科大学第一附属医院国家卫健委毒品依赖和戒治重点实验室,昆明 650032)
吗啡(morphine,MOP) 等阿片类药物作为麻醉镇痛药,临床用量大,长期使用易致耐受和成瘾[1]。成瘾药物可致脑功能异常,停药后会出现戒断症状,引发渴求和复吸。如何避免复吸则是成瘾治疗研究的关键。根据条件反射学说,在条件反射(即记忆)建立后,若反复仅给条件刺激而不给非条件刺激,可使该条件反射减弱甚至消失,即消退(extinction)。消退虽非原记忆的遗忘,是新记忆的形成,但消退记忆的建立可抑制原成瘾记忆的提取,并有望用于药物成瘾复吸的治疗[2-4]。有研究证明前额叶(prefrontal cortex,PFC)在成瘾记忆表达和消退中发挥的重要作用[2,5-6],并试图通过各种手段刺激腹内侧PFC治疗非物质成瘾[7]。脑电图(electroencephalograph,EEG)功率谱是研究脑功能状态的重要手段。急、慢性给MOP均可使猴[8-10]或大鼠[11-12]PFC的EEG-γ频段活动受到抑制,而阿片类受体拮抗剂纳洛酮(naloxone,NLX)可阻断这种效应[11]。和晓明等[13]发现,NLX处理可使已建立条件位置偏爱(conditioned place preference,CPP)的MOP成瘾大鼠PFC下边缘(infralimbic,IL)亚区θ和γ频段功率提高。潘群皖实验室的系列研究[14-17]表明,在大鼠MOP或海洛因成瘾戒断或消退中PFC前边缘(prelimbic,PL)和IL两亚区EEG功率谱特定频段功率等指标发生事件相关性改变。但MOP成瘾记忆已消退动物PFC的EEG功率谱状态尚未见报道。鉴于PFC在药物成瘾中的重要作用,本实验在MOP-CPP成瘾小鼠模型的基础上,探讨训练消退(training extinction,TE)和NLX干涉对PFC-EEG功率谱的影响,为阐明阿片类药物成瘾消退的电生理机制提供实验证据。
1 材料与方法
1.1 实验动物
昆明小鼠40只,雌雄各半,由辽宁长生生物提供,许可证:SCXK(辽)2015—0001;实验开始时为5周龄,体重为38~46 g。动物房湿度约55%±5%,温度20 ℃~24 ℃,12 h/12 h明暗交替。动物分笼饲养,自由饮食,实验前在实验室内适应1周,每天抓握、抚摸,以减少应激效应。实验流程如图1(a)所示,所有操作均遵照国家和云南省实验动物管理规定。
1.2 方法
1.2.1 CPP实验
CPP实验分为适应、筛选、训练、测试等阶段,详见文献[18]。使用动物行为视频分析系统(北京天鸣宏远,Xeye Aba V3.2)记录15 min内动物在各箱的活动时间。适应2 d。将小鼠分为MOP-自然消退(natural extinction,NE)组、MOP-训练消退(training extinction,TE)组、SAL-NE组和SAL-TE组(均n=10)。训练以时间较短一侧为伴药箱,间隔24 h交替给盐酸吗啡(沈阳第一制药厂)或生理盐水SAL (h.)。MOP为剂量递增给药(10、15、20、25和30 mg/kg),注射后放入CPP箱,训练10 d后,进行第1次测试(Test 0)。吗啡剂量和给药方式参照文献[19-21]。CPP分数=伴药箱时间/(伴药箱时间+非伴药箱时间)×100%。
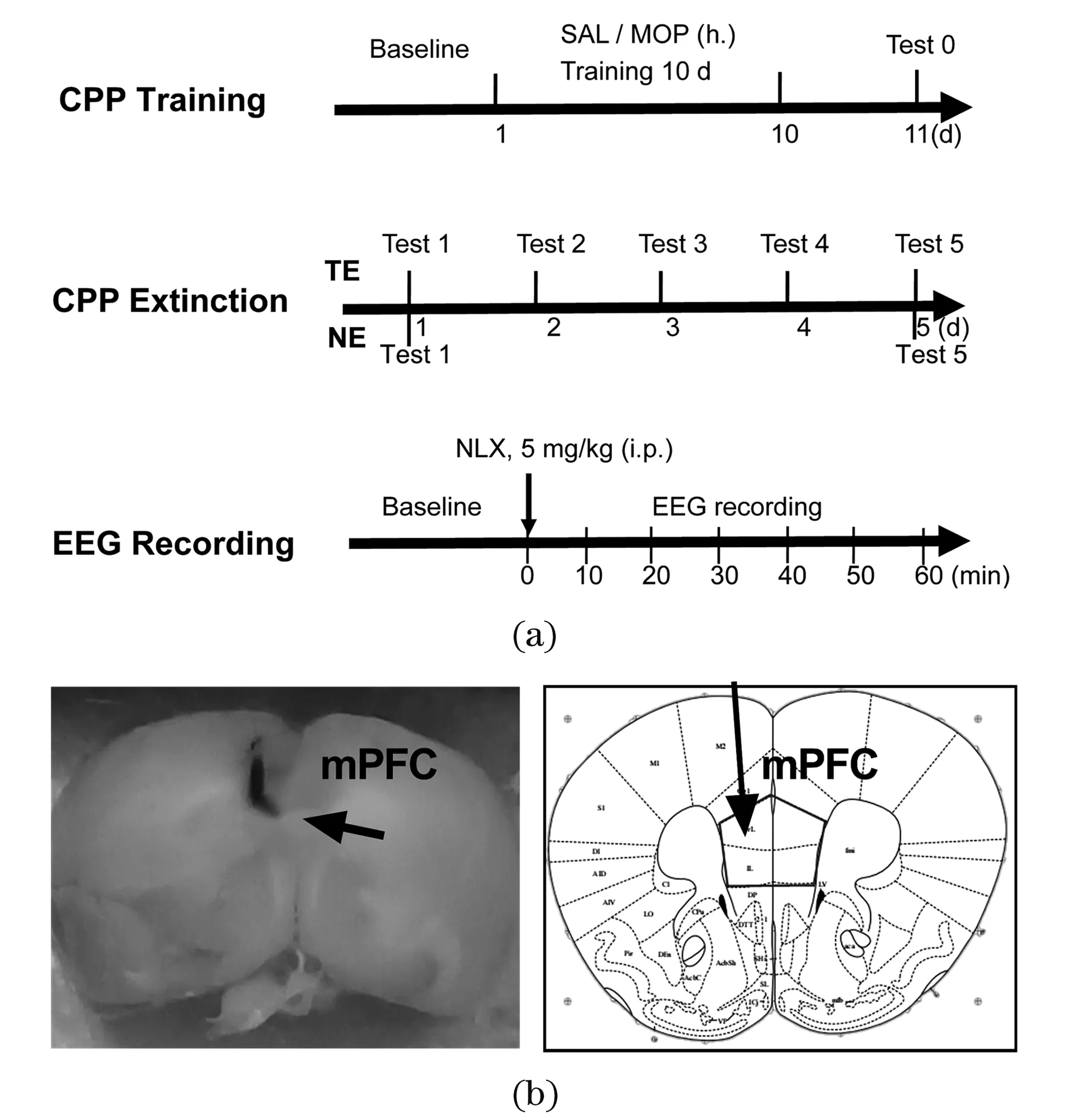
(a)CPP行为学和EEG记录实验流程图;(b)记录电极尖端的位置。CPP:条件位置偏爱;SAL:生理盐水;MOP:吗啡;NLX:纳洛酮;mPFC:内侧前额叶;NE:自然消退;TE:训练消退。图1 实验流程图及EEG记录电极在小鼠脑中的位置Figure 1 Timeline of behavioral and EEG experiment and position of EEG recording electrodes in mouse brain
1.2.2 MOP-CPP消退
CPP建立后即进行消退(5 d)。MOP-TE组和SAL-TE组动物均在SAL注射后将动物置于偏好箱中,其他同训练期。每天TE结束6 h后测试。MOP-NE组和SAL-NE组在MOP-CPP建立和测试后不做任何处理,5 d后再测试1次(Test 5)。
1.3 EEG信号采集和功率谱数据处理
行为实验完成后,戊巴比妥钠(60 mg/kg,i.p.)麻醉小鼠,常规备皮后固定于脑定位仪(深圳瑞沃德)中,暴露颅骨,钻孔并插入绝缘不锈钢电极(Φ150 μm,尖端裸露300 μm),参考电极位于嗅球上方。根据小鼠脑图谱[22],以前囟为原点确定记录电极坐标(mm):AP+1.5,ML±0.5,DV-2.6。使用生理信号采集系统(RM6240,成都仪器厂)记录EEG,待信号稳定10 min(基线)后,注射NLX(5 mg/kg,i.p.,上海源叶生物),再连续记录60 min,每10 min取10 s EEG数据,经FFT变换为功率谱数据,计算总功率(1~100 Hz)及δ(1~4 Hz)、θ(4~8 Hz)、α(8~12 Hz)、β(12~30 Hz)、γ1(30~45 Hz)和γ2(55~100 Hz)功率。相对功率=(绝对功率-基线功率)/基线功率×100%。
1.4 组织学检查
EEG记录结束后,通过电极向脑内通正向直电流(6 V,10 s)。然后麻醉处死动物,灌流SAL和4%甲醛溶液(含1%亚铁氰化钾)固定,取脑后再固定7 d,振动切片(100 μm),焦油紫染色,镜检电极位置。
1.5 统计分析
2 结果与分析
2.1 组织学检查
组织学检查表明,多数动物电极位于内侧前额叶(mPFC)中央区域,见图1(b)。将电极位置不对的数据排除后,每组有8只动物用于数据分析。
2.2 CPP建立及消退
CPP建立。独立样本t检验表明,两给药组基线CPP分数差异不明显(T21.358=-0.865,P=0.397),而CPP训练后MOP组分数显著高于SAL组(T26=-6.905,P=0.000)。配对样本t检验也表明,SAL组经10 d训练,其CPP分数仍与基线无差异(T14=1.281,P=0.221);而MOP组则较基线增加(T12=-9.047,P=0.000),说明MOP-CPP模型建立成功(表1)。
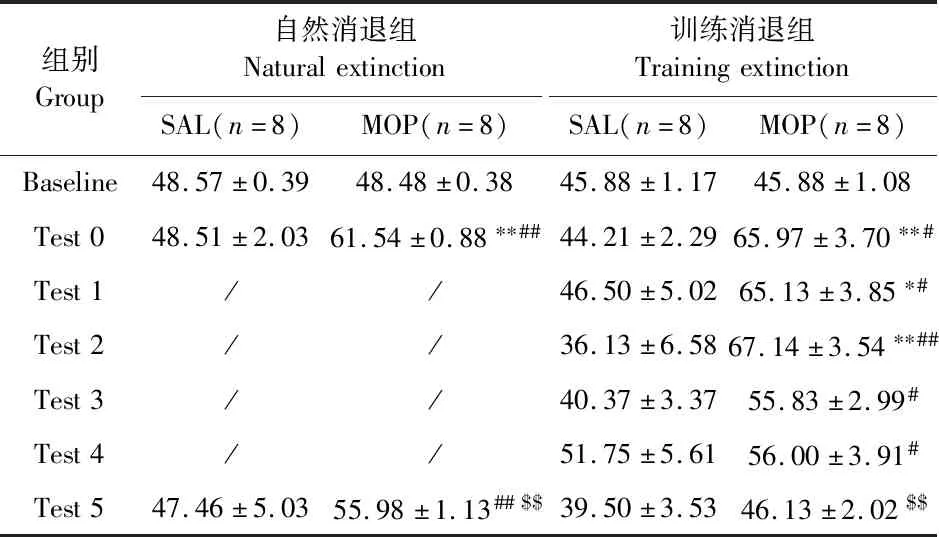
表1 小鼠MOP-CPP测试及训练消退CPP分数Table 1 Mouse MOP-CPP score of test and training extinction
CPP消退。GLM-RM分析表明,MOP-TE组和MOP-TE组具有明显的时间主效应(均F2,14≥22.495,P=0.000),但MOP-NE组经自然消退(NE)5 d后CPP分数仍高于基线(GLM-RM配对比较:P=0.001),说明NE不能使MOP-CPP完全消退。而MOP-TE组CPP分数随训练消退(TE)天数增加而逐渐下降,5 d后已降至基线/SAL组水平(P≥0.494),低于MOP-NE组(P=0.043),提示TE处理能有效促进MOP-CPP消退。
2.3 EEG功率
2.3.1 线性总功率
绝对总功率。功率谱曲线如图2所示,具体数据见图3(a)所示,方差分析表明,注射NLX前各组间存在差异(F3,18=3.473,P=0.038);多重比较表明,MOP-TE组总功率低于SAL-TE组和MOP-NE组(均P≤0.030),而其余3组间无差异(均P≥0.335)。注射NLX后,各时段均有组间差异(均F3,20≥4.913,P≤0.011)。GLM-RM组内效应分析表明,绝对总功率存在时间主效应(F2.361,37.777=40.876,P=0.000),说明其随NLX处理时间延长而升高。时间×药物、时间×消退和时间×消退×药物交互效应均不明显(均F2.361,37.777≤3.014,P≥0.053),提示绝对总功率随时间增加的趋势受药物和消退处理的影响均较弱,主要是NLX的独立效应。GLM组间比较提示,EEG总功率组间差异主要受药物和消退方式两种因素共同影响,故药物×消退交互所致组间差异显著(均F1,16≥10.253,P≤0.006),说明药物和消退方式可相互作用而非独立影响因素。药物和消退处理虽对总功率单独影响较小,但两者交互作用可使MOP-TE组功率降低。
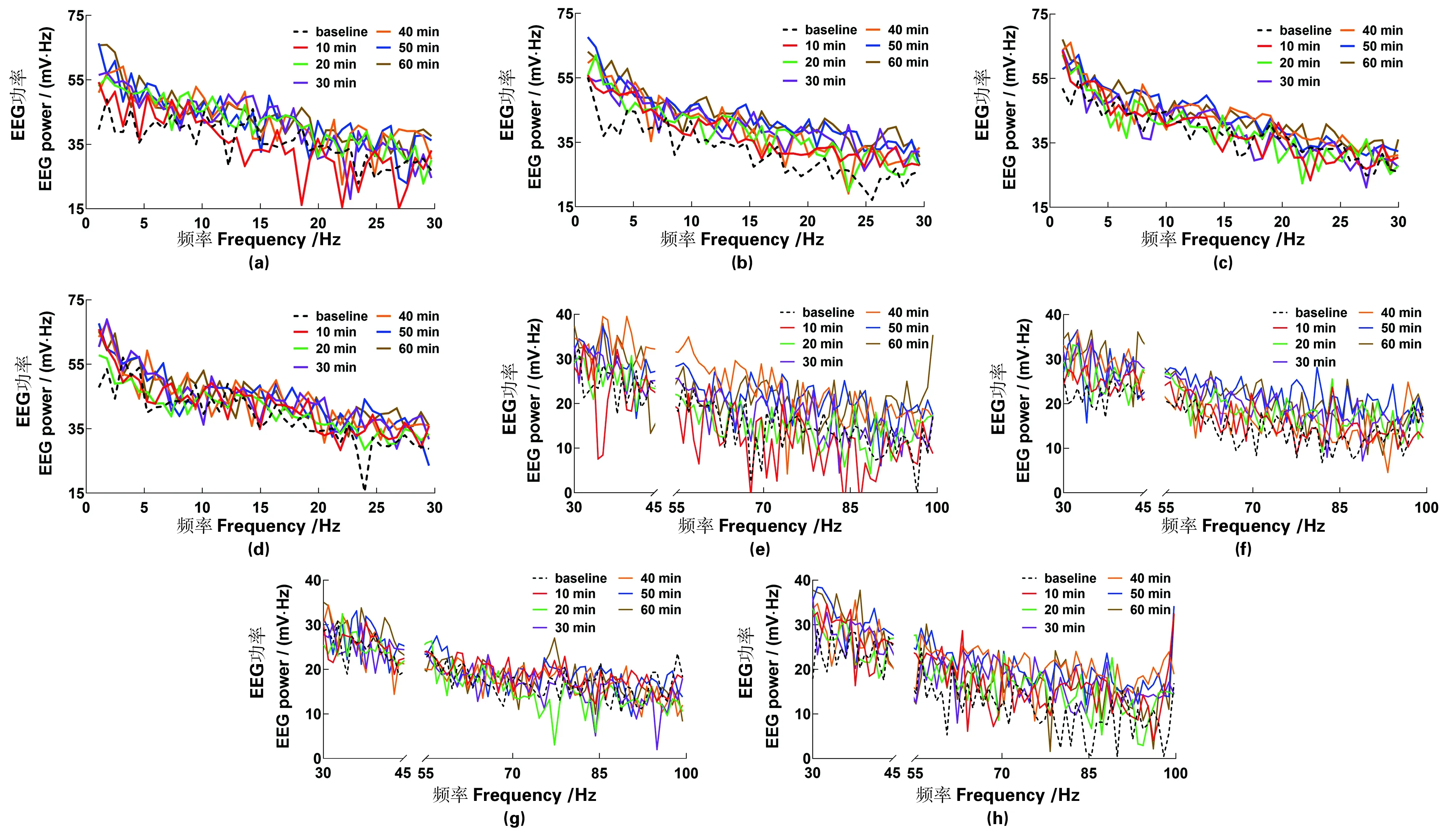
(a)~(d) δ-β,1~30 Hz;(e)~(h) γ1-2,30~100 Hz;(a)和(e) SAL-NE;(b)和(f) SAL-TE;(c)和(g) MOP-NE;(d)和(h) MOP-TE。图2 MOP-CPP消退和NLX处理小鼠的PFC-EEG功率谱代表性曲线Figure 2 Representative curves of mouse PFC-EEG power spectrum treated by MOP-CPP extinction manners and NLX
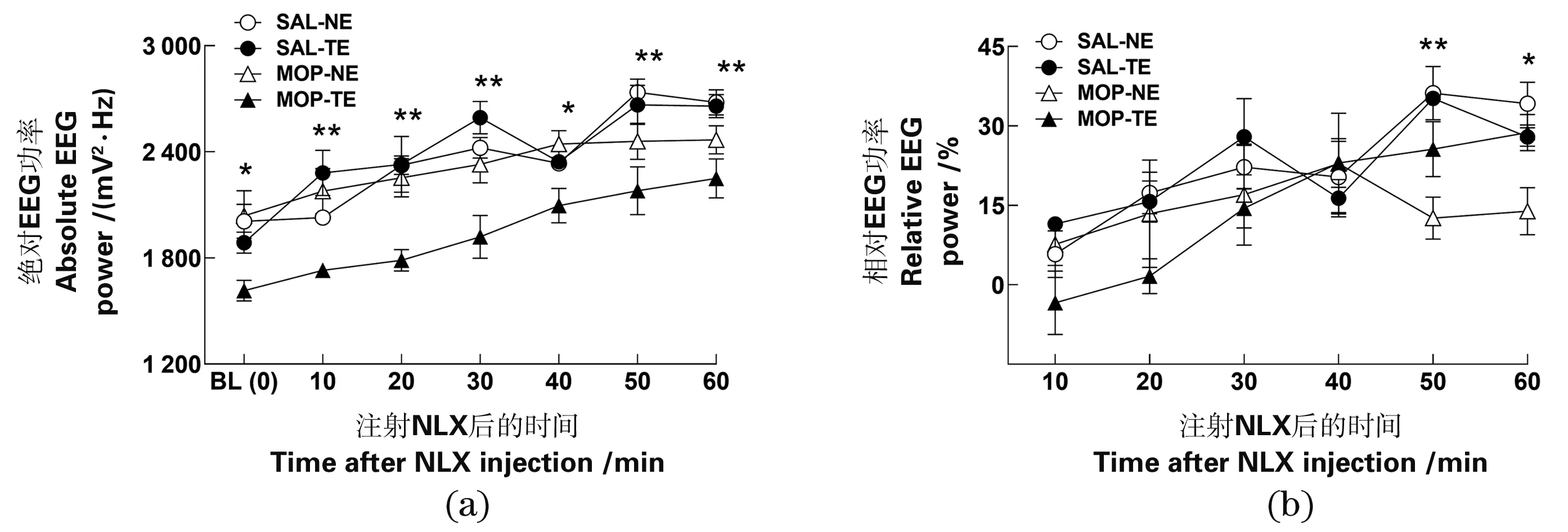
(a)绝对功率;(b)相对功率。* 为P<0.05;** 为P<0.01,单因素方差分析。BL:基线;SAL:生理盐水;MOP:吗啡;NE:自然消退;TE:训练消退;NLX:纳洛酮。图3 不同消退方式和NLX处理对小鼠PFC-EEG总功率的影响Figure 3 Effect of different extinction treatments and NLX on the total EEG power in the mouse PFC
相对总功率。如图3(b)所示,单因素方差分析表明,NLX注射后10~40 min时间段组间差异较小(均P≥0.215),仅50 min和60 min存在组间差异(均F3,14≥5.364,P≤0.011),多重比较表明该时间段MOP-NE组相对总功率降低(均P≤0.010)。GLM-RM组内效应分析表明,相对总功率也具有时间主效应(F5,55=23.095,P=0.000),即EEG总功率在NLX注射后随时间上升,与绝对总功率表现相似。时间×药物和时间×消退交互效应均不明显(均F5,55≤1.684,P≥0.154),说明NLX所致相对总功率的增长不受MOP药物和消退方式的单独影响;药物×消退交互效应对NLX提高有较强影响(F5,55=4.609,P=0.001),提示NLX虽与药物或消退的交互效应不强,但相对总功率仍受时间×药物×消退三因素交互作用影响。GLM-RM组间效应分析表明,相对总功率的组间差异不明显 (均F1,11≤3.527,P≥0.087)。
2.3.2 线性功率谱成分
基线功率谱。方差分析表明,θ、α、β和γ1的基线功率存在组间差异(均F1,18≥3.343,P≤0.042;图4),其中MOP-TE组功率降低,而其他3组相似。θ、α、β基线组间差异主要来自消退处理(θ、α、β:F1,18≥5.766,P≤0.027);γ1基线差异可能部分来自药物处理(MOP-CPP,P=0.027)。这些频段基线的组间差异应是总功率基线组间差异的主要来源。
NLX对EEG功率谱的影响。GLM-RM组内效应分析表明,注射NLX后,各频段功率在整体上均随时间延长而增加,具有时间主效应(均F≥13.760,P=0.000)。其中时间×药物交互效应主要影响θ和γ2频段(均F≥3.717,P≤0.019);时间×消退交互效应主要影响θ频段(F2.686,48.355=11.867,P=0.000);时间×药物×消退三因素交互效应主要影响δ和θ频段(均F≥4.729,P≤0.007)。GLM组间效应分析表明,δ和α组间差异来自药物和消退两独立因素;θ组间差异来自药物、消退和消退×药物交互作用3种情形;β组间差异受消退和消退×药物交互作用影响;而γ1组间差异来自药物和消退×药物交互作用的影响(均F≥5.767,P≤0.027)。各频段具体表现如图4、图5所示。
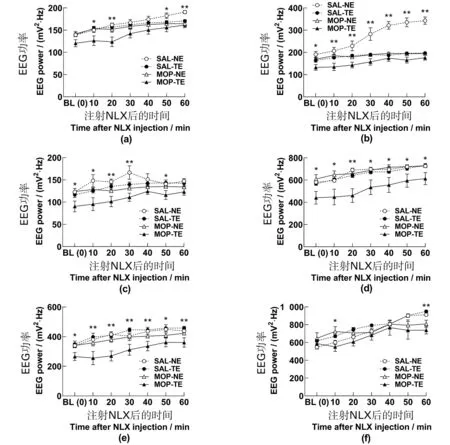
(a)δ;(b)θ;(c)α;(d)β;(e)γ1;(f)γ2。* 为P<0.05,** 为P<0.01,单因素方差分析。BL:基线;SAL:生理盐水;MOP:吗啡;NE:自然消退;TE:训练消退;NLX:纳洛酮。图4 MOP-CPP消退和NLX处理对小鼠PFC-EEG功率谱各频段成分功率的影响Figure 4 Effect of MOP-CPP extinction and NLX treatment on the PEC EEG power spectrum in mice

(a)δ;(b)θ;(c)α;(d)β;(e)γ1;(f)γ2。* 为P<0.05,** 为P<0.01,单因素方差分析。BL:基线;SAL:生理盐水;MOP:吗啡;NE:自然消退;TE:训练消退;NLX:纳洛酮。图5 MOP-CPP消退和NLX处理后小鼠PFC-EEG功率谱各频段成分功率的变化Figure 5 Effect of MOP-CPP extinction and NLX treatment on the PEC EEG power spectrum in mice (Δ%)
3 讨论
3.1 TE处理对MOP-CPP成瘾小鼠PFC-EEG功率谱的影响
阿片类药物成瘾戒断后易复吸,寻找可有效消除复吸的方法一直是研究热点。CPP模型主要用于检测动物在特定情境下对奖赏物的成瘾记忆[23]。研究以MOP隔日剂量递增方式处理10 d后,小鼠CPP分数较SAL组及自身基线明显提高,MOP-CPP模型建成。以此为基础,经5 d消退,TE组CPP分数已降至基线水平,而NE组CPP分数仍较高(表1)。该结果与以往采用恒定剂量(10 mg/kg)造模和TE处理效果[24-26]一致,证明TE处理可有效促进MOP-CPP的消退。我国学者也据此创造性提出成瘾记忆的提取-消退法去解决复吸问题[3-4]。但人类成瘾记忆线索众多,仅靠消退记忆不能完全抑制复吸[27-28],研究则提示成瘾消退动物与正常动物在PFC-EEG功率方面仍有区别。
PFC是成瘾记忆表达和消退的关键脑区[2,6]。早期研究发现MOP等阿片类药物急、慢性处理可影响大鼠或猴PFC-EEG活动状态,抑制PFC-γ振荡[8-12],而NLX则对MOP急性处理或CPP大鼠PFC-θ/γ功率有改善作用[11,13]。研究则首次探讨了MOP成瘾记忆已消退动物PFC-EEG功率谱状态和NLX的影响,发现MOP-TE组PFC-EEG总功率降低,而NLX有改善作用。这说明MOP不仅可急性抑制EEG功率,也可在MOP成瘾记忆形成后发挥长久影响,即便成瘾记忆消退,抑制性影响依然存在,提示成瘾消退动物的PFC功能异常,有复吸可能。值得注意的是,MOP-CPP未消退的MOP-NE动物,其PFC-EEG功率却与SAL组接近,提示TE或消退记忆可能对MOP成瘾动物PFC-EEG有抑制作用。MOP-NE组的成瘾记忆未见消退,这可能在一定程度上维持了较高的PFC-EEG功率,使其基线水平接近SAL组。MOP-CPP和TE单独处理组(MOP-NE和SAL-TE)EEG功率相近,但受两因素叠加作用的MOP-TE组总功率和θ、α、β及γ1等频段功率均降低,这也许是TE处理消除了MOP成瘾记忆的影响所致。
3.2 NLX处理对MOP-CPP成瘾消退小鼠PFC-EEG功率谱的影响
研究发现,NLX虽可使PFC-EEG功率总体呈增加趋势,但功率谱成分的改变有组间差异。SAL-NE组δ、θ和α频段功率在NLX处理后迅速提高,而SAL-TE组与MOP-NE组则增速较缓,提示这些EEG频段受消退影响。但也可能是由于SAL-TE处理程序与MOP-TE相同,重复注射SAL有痛觉刺激却无MOP的麻醉镇痛作用,从而使动物产生应激所致。另外,MOP-TE组虽然各频段基线功率较低,但其θ、α和γ2频段在NLX处理后的增速高于MOP-NE,这提示TE处理对成瘾动物PFC-EEG功率谱有正性调控,但TE影响阿片类药物成瘾的具体机制及其与复吸的关系仍有待深入研究。
4 结论
研究首次发现TE处理可使MOP-CPP消退小鼠PFC-EEG总功率和θ、α、β和γ1频段功率降低,而NLX可以促进EEG功率谱功率提高。研究基于以往研究结果[13],进一步证明,PFC-EEG功率谱,特别是θ、α和γ频段功率是PFC参与阿片类药物成瘾及其消退的重要电生理指标。
