结核分枝杆菌诱导宿主Ⅰ型干扰素应答及其免疫调控功能研究进展
2022-08-16姚志鸿张志芳胡苏洁徐正中焦新安
姚志鸿,张志芳,胡苏洁,刘 慧,陈 祥,,徐正中,,焦新安,
(1.扬州大学 江苏省人兽共患病学重点实验室/江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009;2.扬州大学 农业农村部农产品质量安全生物性危害因子(动物源)控制重点实验室,扬州 225009)
引发结核病的结核分枝杆菌是一种人兽共患胞内病原菌,其可以采取多种免疫逃逸策略,如干扰吞噬溶酶体的形成、抑制自噬效应、调控巨噬细胞凋亡以及抗原提呈效应等,从而促进其胞内存活[1]。
I型干扰素家族主要包括α-干扰素(IFN-α)和β-干扰素(IFN-β)在内的多个不同成员组成。所有I型干扰素均可以被干扰素受体(interferon receptor,IFNAR)1和2亚基组成的异二聚体受体识别,通过信号传导和转录刺激因子(signal transducers and activators of transcription,STAT)1和2进而激活干扰素刺激基因(interferon stimulated gene,ISG)家族[2-3]。研究证明Ⅰ型干扰素有利于结核分枝杆菌对宿主的感染和致病过程,但也有报道显示其可以诱导宿主产生针对细菌的免疫应答,因此I型干扰素在结核分枝杆菌感染过程中具有参与感染和抗感染的两面性。结核病对全球公共卫生的重大威胁以及多耐药菌株的出现[4],需要采取更有效的防控策略进行应对。破译结核感染过程中I型干扰素及其信号通路的调控机制将有助于理解结核病的致病和免疫机制,从而为干预这一重要因子实现趋利避害提供新思路。现就I型干扰素在结核感染中的免疫调控功能作一综述。
1 I型干扰素为活动性结核的标识并加剧结核致病过程
近年来,较多研究在患者样品中检测到高水平I型干扰素,表明I型干扰素可能为活动性结核的重要标识。结核病患者的早期感染阶段,I型干扰素α/β受体信号下游基因在活动性结核病患者的血液中明显上调表达[5]。在不同地理区域、具有不同遗传背景和流行病学背景的患者中也证实了这一发现。在南非结核病患者中的调查显示,潜伏性结核感染(Latent TB infection,LTBI)患者、活动性结核患者相较于健康人群,其血浆IFN-α表达显著上调,并且ISG转录活性更强[6]。另一项在264名印度新德里结核患者的研究中,未经治疗的结核病患者IFN-α基因表达水平较健康人群更高[7]。同时在发展为活动性结核的患者早期检测中,也发现干扰素刺激基因(包括STAT1、IFITs、GBPs、MX1、OAS1、IRF1等)的表达水平上调[8-9]。鉴于活动性结核早期I型干扰素应答的活化,或许可以作为诊断靶标,通过监测I型干扰素应答水平了解疾病发展阶段。
结核分枝杆菌感染过程中I型干扰素应答对宿主的免疫调控作用被广泛研究,I型干扰素可能加剧结核分枝杆菌的致病过程,并在小鼠和人的系列研究中被广泛证实。Zhang等[10]报道由IFNAR1基因突变而导致的I型干扰素信号受损反而增强了患者对结核病的免疫抵抗力。利用小鼠模型研究显示,具有结核分枝杆菌易感遗传背景(A129,129S2)小鼠的IFNAR缺陷可提高HN878超强毒株感染后的存活率[11]。另外有研究表明持续且高水平的I型干扰素应答在加剧小鼠结核病方面起着不利作用[12]。在缺失GM-CSF信号的情况下,I型干扰素可以诱导中性粒细胞胞外陷阱(neutrophil extracellular trap,NET)形成,从而促进分枝杆菌生长和病理损伤[13]。小鼠和人的体内外试验均表明I型干扰素能抑制IL-1α、IL-1β以及TNF-α等防御结核感染的重要细胞因子表达[14],并且限制前列腺素E2以导致感染细胞坏死,从而增强细菌扩散传播[15]。Depaus等[16]报道TNF-α和IL-12等其他促炎细胞因子的表达也会受到外源性IFN-α或IFN-β的负调控。I型干扰素可以在体外诱导巨噬细胞产生免疫抑制细胞因子IL-10[17],并因此增加小鼠易感性且抑制IL-12和TNF-α的分泌[18]。有研究表明,高水平的I型干扰素表达不仅仅抑制促炎细胞因子,还影响Th1辅助细胞的免疫应答反应[19-20]。I型干扰素还被证明可以促进肺泡巨噬细胞的早期细胞死亡,并促进髓样细胞的局部积聚,致使感染和肺部炎症的扩散[21]。鉴于I型干扰素在结核感染中的负面作用,或许具有作为抗结核药物靶标的潜力,还需进一步探究。
2 I型干扰素及信号通路促进宿主抗结核免疫应答
与先前认为结核分枝杆菌诱导宿主产生I型干扰素以促进其致病过程的观点相反,近来多项研究表明,在某些情况下I型干扰素还可以诱导宿主免疫防御功能,从而对结核分枝杆菌产生不利影响。I型干扰素家族中IFN-α和IFN-β被证实在结核感染中均具有宿主免疫保护效应。联合使用IFN-α与PGE2后,结核分枝杆菌抗原刺激的患者外周血单核细胞产生自噬水平显著增强[22]。通过IFN-α和牛分枝杆菌卡介苗的加强免疫策略可以诱导Th1型细胞因子表达(IFN-γ、IL-12、TNF-α、IL-17),并降低胞内菌量[23]。小鼠I型干扰素受体基因缺失将导致肺部细菌载量增多和病理损伤加重,而且Ifngr-/-Ifnar-/-双基因缺失小鼠与Ifngr-/-单基因缺失小鼠相比更易被感染[24]。此外,胞质DNA传感器环状GMP-AMP合酶(cyclic GMP-AMP synthase,cGAS)和干扰素基因刺激因子(stimulator of interferon genes,STING)基因敲除小鼠巨噬细胞的IFN-β转录水平较低,并且其细菌载量和死亡率显著高于正常小鼠[25]。
Banks等[26]报道I型干扰素通过诱导巨噬细胞表达NO,从而有效杀伤入侵结核分枝杆菌。cGAS-STING-TBK1-IRF3/7 通路诱导的IFN-β可以有效清除小鼠体内分枝杆菌感染[27]。此外,即便在IFN-γ信号缺失的情况下,I型干扰素也在小鼠结核感染中发挥了不可或缺的作用[28]。I型干扰素具有促进炎性因子表达、活化免疫细胞的作用,相应结核分枝杆菌组分及I型干扰素本身具有作为结核疫苗佐剂的潜力,其应用价值和前景还需进一步评价。
3 结核分枝杆菌感染过程中I型干扰素的表达及通路活化
较多体内外试验均已证实结核分枝杆菌能够诱导I型干扰素表达并发挥免疫调控功能,并且其信号通路和分子机制已被多数研究者初步探明。Banks等[26]报道I型干扰素应答与结核分枝杆菌菌株毒力和宿主易感性有关,耻垢分枝杆菌与结核分枝杆菌强毒株(CDC1551、H37Rv)相比,可以诱导更高水平的I型干扰素应答。有研究使用结核分枝杆菌的强毒临床分离株(包括HN878,W4和CDC1551)感染小鼠,结果显示毒力更强的HN878和W4株诱导较高水平的I型干扰素[11]。还有研究认为诱导较高水平I型干扰素的结核分枝杆菌菌株可能毒力更强,由于IL-12依赖的宿主Th1应答减弱[29],而该效应会对宿主造成有害影响,这一特性依赖于结核分枝杆菌毒力因子ESAT-6分泌系统-1(ESX-1)[20]。以上研究都显示I型干扰素表达水平与结核分枝杆菌毒力呈正相关。
结核分枝杆菌诱导I型干扰素表达的信号通路主要包括TLR4介导的TRIF-TBK1-IRF3通路,以及胞内分枝杆菌或线粒体DNA介导的STING-TBK1-IRF3通路。Carmona等[30]报道宿主免疫细胞表面及胞内模式识别受体可以直接识别结核分枝杆菌组分以诱导I型干扰素转录。此外,结核分枝杆菌感染宿主细胞后,在胞内释放的分枝杆菌DNA或细胞线粒体DNA可被胞液传感器cGAS识别,产生环状二鸟苷酸-腺苷酸(cyclic di-GMP-AMP,cGAMP),进而活化STING-TBK1-IRF3信号通路进而诱导I型干扰素表达[12]。胞质DNA传感器cGAS对启动抗结核感染的干扰素应答是必不可少的,且依赖于ESX-1VII型分泌系统[31],其细菌DNA与cGAS结合后,cGAS随后激活STING-TBK1-IRF3途径,导致I型IFN基因转录上调[32]。随后,释放的I型干扰素可以通过与细胞表面IFNAR1-IFNAR2异源二聚体受体结合,进而活化STAT二聚体化并诱导下游干扰素刺激基因(ISG)转录[33]。cGAS-STING-TBK1途径是天然免疫细胞识别进入胞浆的病毒和细菌病原体的主要途径,但包括结核分枝杆菌在内的不同细菌进化出了不同的机制来启动这一应答[34]。结核分枝杆菌诱导I型干扰素应答的能力与一系列因素存在相关性,尤其是菌株背景差异,但其他的一些因素,如宿主本身是否存在影响仍未知。
4 结核分枝杆菌组分对I型干扰素应答的调控作用
I型干扰素的免疫防御功能可能不利于结核分枝杆菌的感染及胞内存活,结核分枝杆菌采取一系列策略进而下调宿主I型干扰素应答水平。一方面,结核分枝杆菌通过抑制I型干扰素诱导信号通路活化及其转录表达,如结核分枝杆菌及其TLR2配体可以抑制TLR9依赖的I型干扰素表达(图1中的A)和MHCI类抗原交叉提呈[35]。结核分枝杆菌磷酸二酯酶可以通过水解细菌来源的c-di-AMP和宿主来源的cGAMP而抑制STING通路的活化,进而下调I型干扰素表达(图1中的B)[36]。另一方面,结核分枝杆菌还可以通过多种途径抑制I型干扰素受体信号通路活化以及下游一系列干扰素刺激基因(ISG)的表达。研究表明,结核分枝杆菌通过抑制I型干扰素介导的酪氨酸激酶(tyrosine kinase 2,TYK2)和Janus激酶(Janus kinase 1,JAK1)的激活和下游STAT1和STAT2磷酸化,从而影响宿主细胞I型干扰素刺激基因转录谱[26](图1中的C)。有报道显示结核分枝杆菌可以通过IL-10依赖的途径诱导STAT3活化,并下调iNOS表达和NO合成[37],且IFN-α/β诱导的STAT3的激活可以下调I型干扰素介导的IP-10表达。更重要的是,STAT3隔离STAT1并抑制DNA结合的STAT1同源二聚体的形成[38](图1中的D)。结核分枝杆菌抑制I型干扰素信号通路,从而促进胞内存活和实现持续感染,这可能是结核分枝杆菌免疫逃逸策略之一,但是目前的机制研究还不全面,还需继续深入探究。
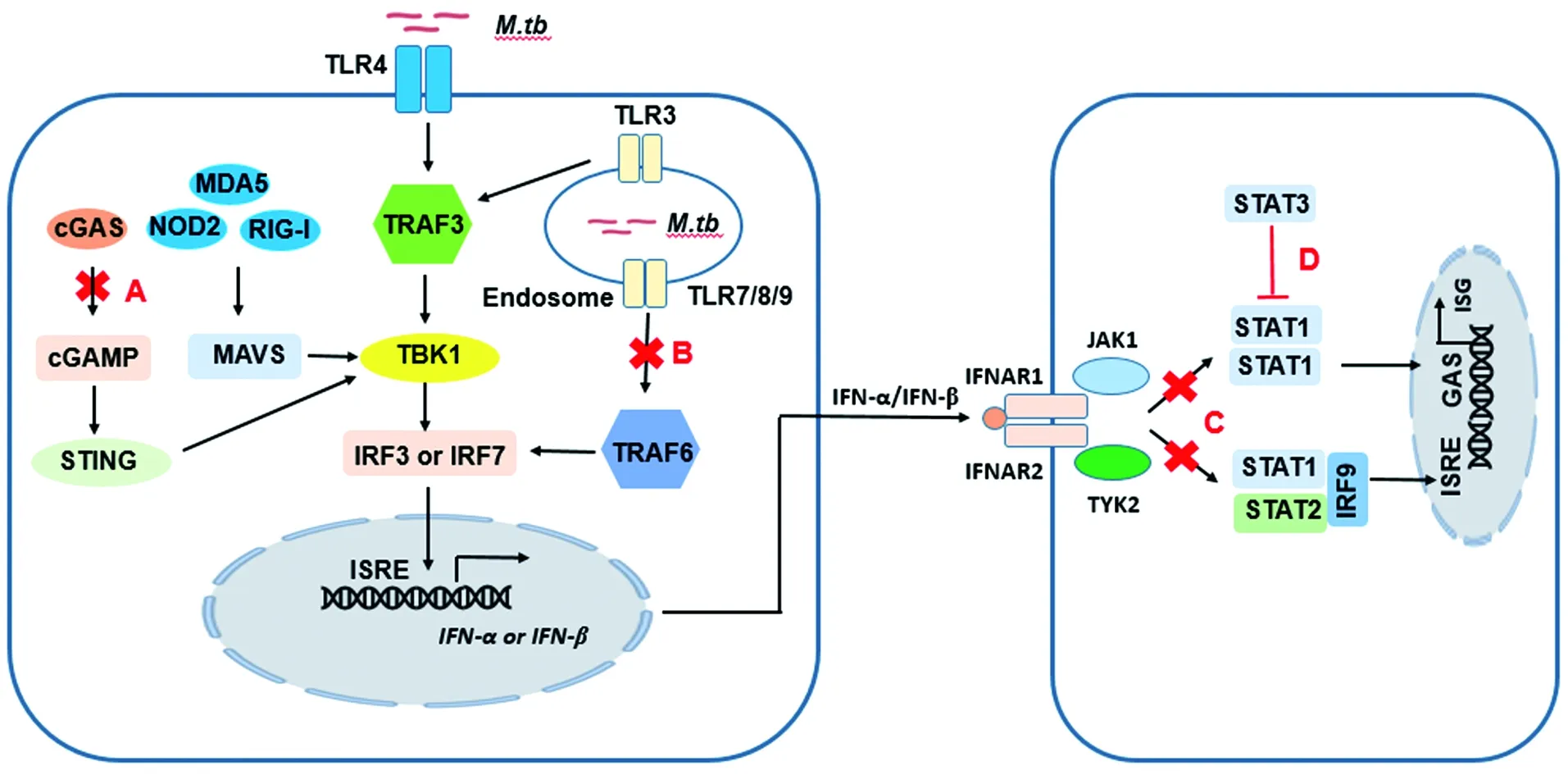
图1 结核分枝杆菌调控宿主I型干扰素信号通路Figure 1 Regulation of type I interferon pathway during Mycobacteriumtuberculosis infection
5 总结
虽然I型干扰素在宿主抵御病毒感染过程中被认为发挥积极作用,但其在细菌感染中的作用并不完全清楚,并且因细菌类型和感染部位的不同而有所差异。越来越多的研究证明I型干扰素在结核分枝杆菌感染中发挥着重要的作用,但是矛盾的是I型干扰素似乎同时充当着促进感染致病和免疫防御的双面角色,其分子机理仍有待深入探究。目前普遍认为持续高水平的I型干扰素会抑制宿主的免疫防御而有利于结核感染,结核感染前期低水平的I型干扰素可以诱导免疫保护细胞因子的分泌表达,发挥一定的抗结核感染作用,因此I型干扰素在不同感染阶段、不同水平条件下,呈现不同的免疫调控功能。另外,鉴于试验模型的不同,相关文献报道出现差异甚至相反的试验结果,因此需要更多体内外试验来佐证这些观点。
结核分枝杆菌通过宿主细胞表面及胞内不同识别受体,一方面活化TRAF-TBK1-IRF3、STING-TBK1-IRF3应答信号通路,诱导宿主I型干扰素表达,随后通过IFNAR-JAK1/TYK2-STAT信号通路,促进下游I型干扰素刺激基因的转录表达;另一方面为了保证其在宿主细胞内的存活及增殖,进化形成一系列免疫逃逸策略,抑制I型干扰素信号通路中关键信号分子活化,调控I型干扰素应答水平。但是目前关于结核分枝杆菌哪些组分参与调控宿主I型干扰素应答还不十分明确,通过各种有效的筛选技术,如转座子突变库、CRISPR-Cas9突变库等继续探寻结核分枝杆菌效应组分,将为深入理解结核分枝杆菌逃逸宿主免疫应答的分子机制,为抗结核药物靶标筛选及疫苗研制具有重要意义。
