芳炔前体参与的芳烃1,2,3-三官能化反应*
2022-08-16韦海龙刘雪梅王满学
韦海龙,刘雪梅,王满学,黄 剑
(西安石油大学化学化工学院,陕西 西安 710065)
芳炔化学至今已有近百年的发展史。早期的研究中芳炔的的生成条件比较苛刻,在反应中官能团的兼容性较差,在合成化学中未能得到广泛应用。最近二十年来由于条件温和的生成芳炔的反应的发现,芳炔参与的新型反应得以迅速发展[1-6]。因其可高效地实现芳烃邻位双官能化,近年来芳炔化学引起了越来越多的合成化学家的研究兴趣。从现有的报道来看,简单芳炔的反应大多局限于芳烃的邻位双官能化,利用芳炔反应在芳环上一次性引入三个及以上的官能团的化学转换鲜有报道[7-8]。
1 芳烃的1,2,3-功能化反应及其化合物的合成应用
早在20世纪80年代,Hart小组就采用2,6-二卤代碘苯为原料,在芳基格氏试剂的作用下,首先在中间的碘上发生金属卤素交换生成一个新的2,6-二卤代格氏试剂,然后该格氏试剂通过脱去卤化镁生成1,2-芳炔继续与格氏试剂发生亲核反应,然后得到2,3-芳炔中间体,继续与格氏试剂发生亲核反应,生成2,6-二取代芳基格氏试剂,再与亲电试剂反应生成1,2,3-三取代芳烃[9]。由于反应中使用了格氏试剂作为芳炔活化条件,反应条件苛刻,冠能团兼容性不好,反应局限于与格氏试剂的反应,如图1所示。

图1 格氏试剂参与的1,2,3-三取代芳烃的合成Fig.1 Grignard reagent participated synthesis of 1,2,3-trisubstituted arene
近年来,Li小组在利用芳炔前体合成多取代芳烃方面做了大量工作。2015年,他们报道了一个新颖的利用芳炔前体TPBT与硫代酰胺合成2,4-二取代苯并噻唑的多米诺反应[10],如图2所示。与传统的芳炔前体只有邻位两个反应位点不同,TPBT在反应中可提供三个反应位点,生成三个新的化学键。他们认为,反应中生成的3-三氟甲磺酸基苯炔中间体A与硫代酰胺发生硫亲核加成,生成的2,3-芳炔中间体B再与氮亲核试剂发生环化反应生成两可离子中间体C。最终的产物取决于中间体C的羰基是否具有α-H,羰基没有α-H时将发生分子内羰基迁移生成2,4-二取代苯并噻唑,羰基具有α-H时将发生1,5-氢迁移生成2-取代苯并噻唑,如图3所示。

图2 高效构建2,4-二取代苯并噻唑Fig.2 Efficient construction of 2,4-disubstituted benzothiazoles

图3 建议的机理Fig.3 Proposed mechanism
值得一提的是得到的产物2,4-二取代苯并噻唑可以容易地转化为相应的羧酸、酰胺和腈类衍生物,如图4所示。这些衍生物的骨架广泛存在于一系列具有生物活性的化合物中,表明该方法在结构多样化方面是多功能的。

图4 合成上的应用Fig.4 Synthetic applications
随后,Li小组利用多米诺芳炔前体TPBT和磺酰胺合成了三取代的1,3-二氨基苯类化合物[11]。非常有趣的是,在100 ℃下采用甲苯作溶剂、碳酸钾作芳炔活化试剂时产物为三取代的1,3-二氨基苯;改变反应条件,在室温下采用乙腈作溶剂、氟化铯作芳炔活化试剂时,产物则变成1,3-二氨基苯,如图5所示。
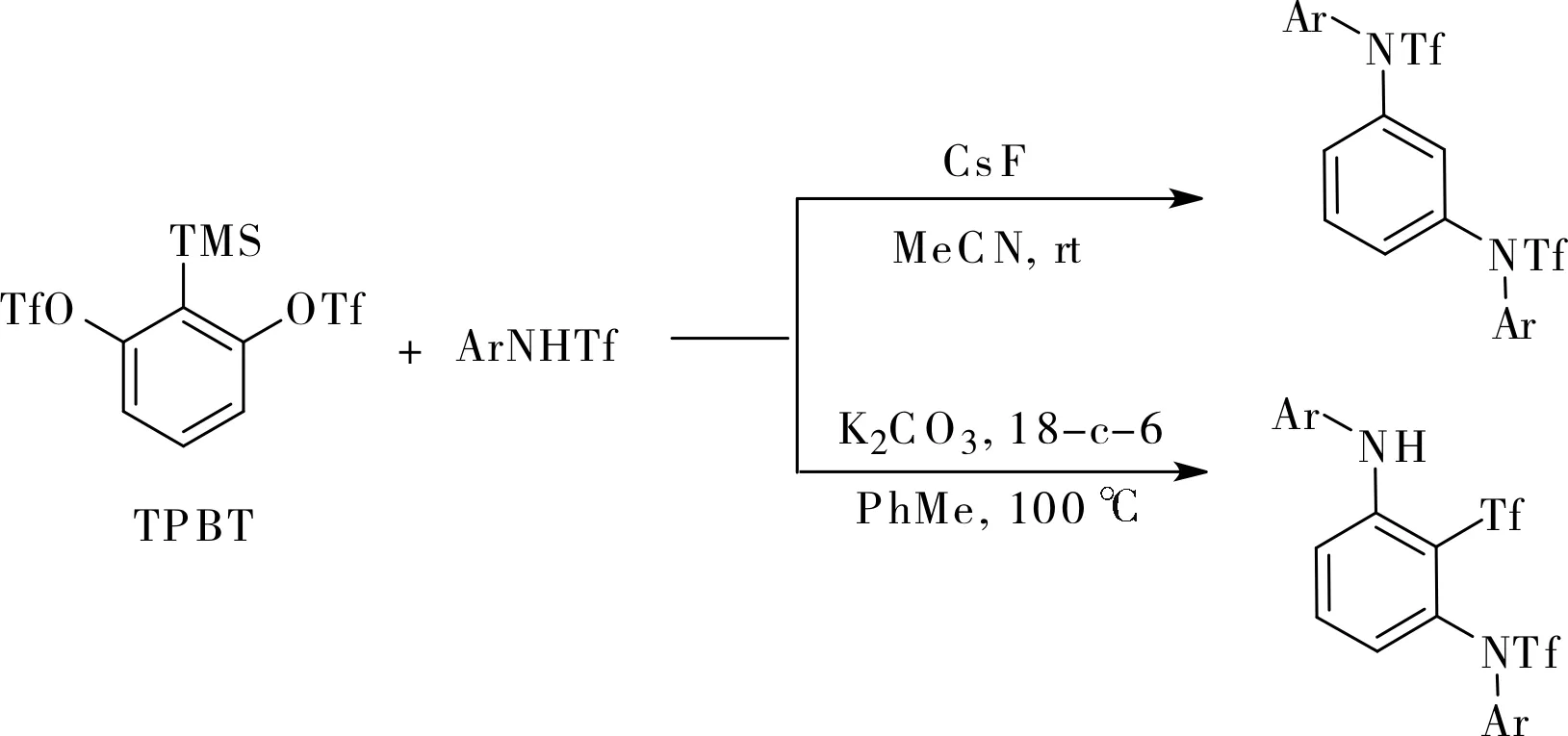
图5 1,3-二氨基苯的合成Fig.5 Synthesis of 1, 3-diaminobenzens
2016年,Li小组报道了一个利用芳基烯丙基亚砜实现的芳炔的1,2,3-三官能化反应[12],如图6所示。他们通过实验推断,反应中原位生成的苯炔先与亚砜发生[2+2]环加成,环加成产物A上的烯丙基从硫原子迁移到氧原子上生成两可离子中间体B,然后发生氧鎓离子Claisen重排生成中间体C,最后开环氧原子烷基化生成最终产物(图6)。产物1,2,3-三取代芳烃可以在适当的条件下很容易转化为其它类型的化合物。例如,氧原子上的烷基可在BBr3的 作用下脱除,生成的酚羟基与邻位的烯丙基很容易发生碘环化反应然后在强碱作用下脱除HI生成苯并呋喃,如图7a所示;分子中的硫醚可被氧化为砜,然后在Ni的催化下与格氏试剂发生偶联反应,如图7b所示。
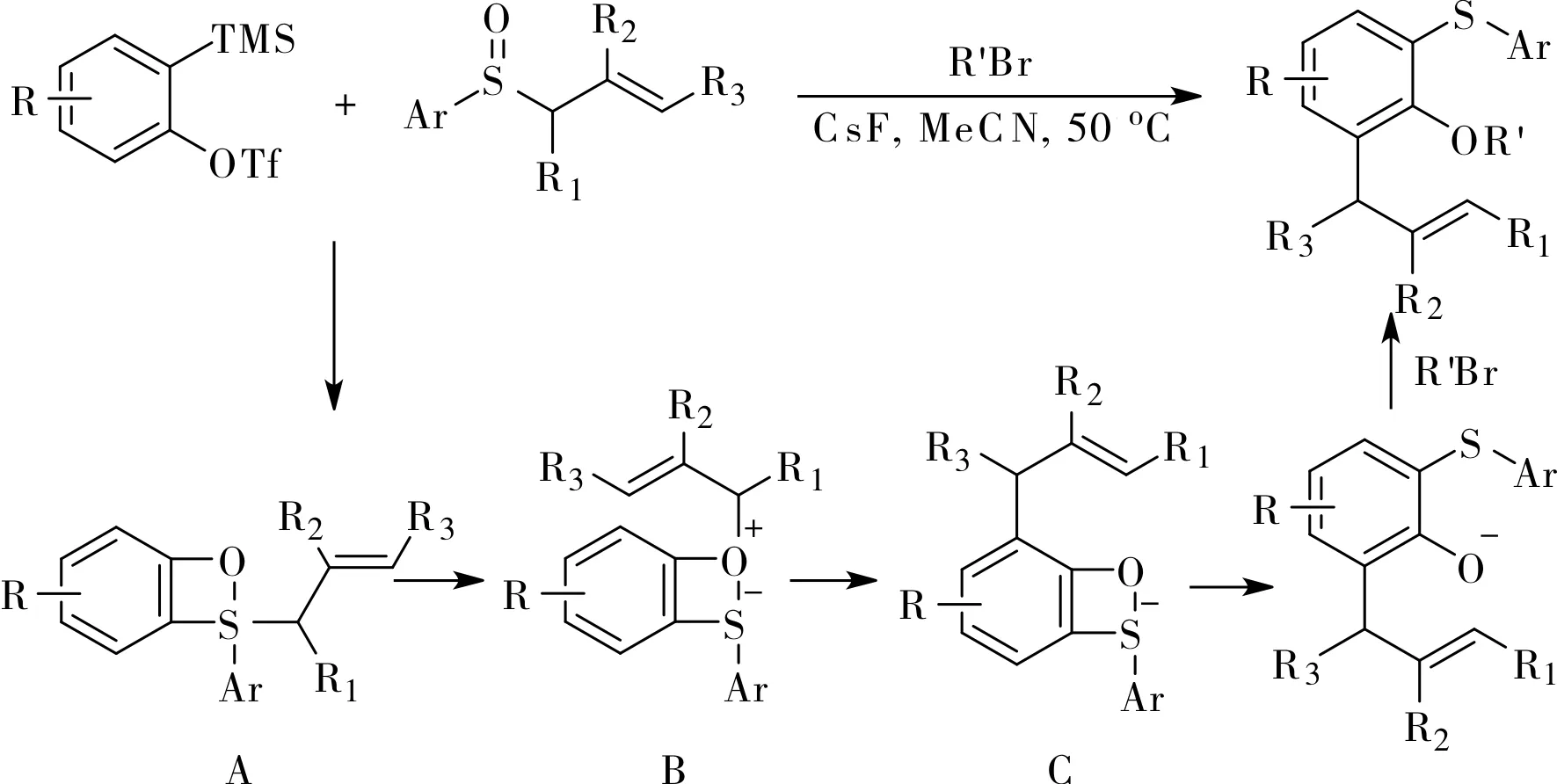
图6 利用芳基烯丙基亚砜实现芳炔的三官能化Fig.6 Aryne trifunctionalization with aryl allyl sulfoxides

图7 产物的修饰Fig.7 Elaboration of the products
在后来的研究中,Li小组采用3-三氟甲磺酸基芳炔的[2+2]环加成产物作芳炔前体,通过Grob碎裂化的方式,生成的2,3-芳炔中间体发生不同类型的反应,成功获得了采用其它方法较难获得的多取代苯化合物[13],如图8所示。利用该方法可以快捷地合成消炎镇痛药非诺洛芬(Fenoprofen)和卡洛芬(Carprofen),如图9a所示,他们还将这一方法进一步应用到抗癌新药Niraparib的高效合成中,如图9b所示。

图8 利用3-三氟甲磺酸基芳炔的[2+2]环加 成产物的Grob碎裂化选择性的生成芳炔Fig.8 Selective Aryne formation via Grob fragmentation from the [2+2]cycloadducts of 3-Triflyloxyarynes

图9 合成修饰Fig.9 Synthetic elaboration
Hosoya小组也报道了一个利用3-三氟甲磺酸基芳炔的[2+2]环加成产物作芳炔前体合成多取代苯化合物的多米诺反应[14]。该反应在亲芳基试剂存在下利用有机锂试剂打开苯并环丁酮的四元环,产物为α-芳基酮。机理研究表明,反应中经历了羰基加成产物的C-C键断裂并伴随三氟甲磺酸根的离去,生成了2,3-芳炔中间体,如图10所示。

图10 三氟甲磺酸基取代的苯并环丁酮、 有机锂试剂和亲芳基试剂的三组分偶联反应Fig.10 Three-component coupling of triflyloxy-substitutedbenzocyclobutenones, organolithium reagents, and arynophiles
受到Li和Hosoya两个小组工作的启发,Wu小组和Sha小组合作报道了一个利用芳炔前体合成多取代色烷化合物的多米诺反应[15]。他们在色烷分子内引入三氟甲磺酸基和苯并环己酮结构单元,在苯基锂的作用下四元环打开并伴随三氟甲磺酸根的离去,生成的6,7-色烷型芳炔中间体与2,5-二甲基呋喃发生Diels-Alder反应,产物为三取代色烷,如图11所示。
2019年,Li小组在前期工作的基础上,将苯乙烯结构作为2,3-芳炔的反应端,利用1,2-苯二炔的亲核,Diels-Alder环加成串联得到了具有[6,n,6,6]和[6,5,6,6,6]骨架结构的苯并稠环结构[16],如图12所示。他们还将这一方法用于麦角碱骨架的合成,如图13所示。含氮杂环产物经吡啶的氮甲基化和硼氢化钠还原一锅法两步操作,再脱除对甲苯磺酸基并氧化脱氢便得到麦角碱骨架,该路线简洁高效。

图12 通过芳炔的亲核反应与Diels-Alder 串联实现芳环的三官能化Fig.12 Arene trifunctionalization through aryne nucleophilic, Diels-Alder cascade

图13 麦角碱骨架的合成Fig.13 Synthesis of ergot alkaloid skeleton
Hoye小组将1,3-二炔作为2,3-芳炔的反应端,利用1,2-苯二炔的亲核,六脱氢Diels-Alder(HDDA)环加成串联反应得到了萘炔,再与分子链末端的亲芳基试剂发生加成反应最终得到含有萘结构单元的稠环体系[17],如图14所示,该方法可用于克级规模的制备。如果在磺酰胺的分子链中增加一个1,3-二炔单元,在第一次六脱氢Diels-Alder环加成后,生成的萘炔将与另一个1,3-二炔单元再发生一次六脱氢Diels-Alder环加成,生成的蒽炔与分子链末端的亲芳基试剂发生加成反应,最终得到具有蒽结构单元的更大的稠环体系,如图15所示。
最近,Li小组在前期工作的基础上,进一步发展了利用3-硅基苯炔快速合成多取代芳烃的策略[18],他们在筛选3-硅基取代芳炔前体时发现,当含硅基团是三甲基硅(TMS)、三乙基硅(TES)、 三正丁基硅(n-Bu3Si)及三丙基硅(TPS)时,得到的唯一产物是去硅基化产物1,2,3-取代产物;而当使用二甲基叔丁基硅(TBS)或三异丙基硅(TIPS)时,得到1,2,3,5-四取代产物,如图16所示。后一种情况包含了苯炔对亚砜硫氧双键的插入、阴离子[3,6]-重排及苯环上的1,3-硅迁移过程。

图14 利用1,3-二炔和1,2-苯二炔等效物合成萘Fig.14 Synthesis of naphthalene from 1,3-diynes and 1,2-benzdiyne equivalents

图15 合成更大的稠环芳烃Fig.15 Synthesis of larger polycyclic arenes

图16 3-硅基芳炔的1,2,3-三官能化和1,2,3,5-四官能化Fig.16 3-silylaryne 1,2,3-trifunctionalization and 1,2,3,5-tetrasubstitution
2 结 语
多取代苯环结构广泛存在于具有生物活性的天然产物、药物分子及有机功能材料结构中。如何高效快捷精准地构建特定组合的多取代芳烃在合成化学领域中具有重要的研究意义。虽然利用苯炔中间体可快速合成各种二取代芳烃,但传统苯炔反应的瓶颈是无法同时在苯炔环上其它位点官能化,不能发挥其在制备多取代芳环结构中的作用。突破传统苯炔二取代反应的局限性,发展苯炔多位点官能化方法,通过1,2-苯二炔及简单芳炔参与的串联过程两条途径,实现芳炔的多官能化转化,简单快捷地合成多种天然产物和药物分子,必将引起越来越多的合成化学家的研究兴趣。
