基于高通量测序技术对6 种黄酒酒曲中微生物多样性的研究
2022-08-16谷晓东刘怡琳席晓丽陈志周马艳莉王印壮李素萍
谷晓东,刘怡琳,席晓丽,陈志周,3,,马艳莉,,,刘 旭,王印壮,李素萍
(1.河北农业大学食品科技学院,河北保定 071000;2.南阳理工学院张仲景国医国药学院,河南南阳 473004;3.河北农业大学机电工程学院,河北保定 071001)
黄酒是我国一种传统的发酵酒精饮品[1],其历史悠久,大概已有7000 多年[2],是中国民族酒类之一,与啤酒、葡萄酒并称为世界三大古酒[2-3]。因其营养丰富,且具有独特的风味[4],素有“酒中之祖、液体蛋糕”之美誉,深受消费者的喜爱[5]。我国黄酒产地颇多,分布广泛[6],通常传统工艺是以富含淀粉的糯米、黍米、小米、玉米、高粱等谷物为原料[7],以曲药作为糖化发酵剂,经过浸米、蒸米、摊凉、落缸、拌曲、发酵、压榨、澄清、过滤、杀菌等过程酿造而成[8]。红谷是河南省南阳盆地的特色农作物,外壳呈红色,脱壳后得到的小米也称红小米,其性温,是药食两用食材,具有清热止渴、滋阴补肾、健脾暖胃之功效[9],且富含多种营养物质、比例协调[10]。红谷黄酒是以红谷为原料经过传统工艺酿造而成。
与传统酿造食品相同,黄酒的酿造过程也是开放式发酵,环境中的微生物会与主要酿造微生物一起参与发酵过程,从而影响黄酒风味物质的形成[11-12]。酒曲是酿造传统黄酒的重要原料之一,常被誉为“酒之骨”[13],酒的好坏与酒曲密不可分。酒曲中含有种类繁多的微生物,既有细菌,又有酵母、霉菌等真菌[14]。霉菌、酵母和细菌被认为能产生大量的酶,用于细胞新陈代谢和随后的小分子生成,这些酶有助于最终产品中风味的形成[1]。微生物的多种代谢产物对酒的风味、口感、质量、功能都有着非常重要的作用。因此,对于酒曲微生物的多样性分析在黄酒品质的稳定和提升等方面有着重要的现实意义[15]。
高通量测序技术可以准确大规模的分析微生物的组成,客观全面的分析微生物的群落结构[16]。沈馨等[17]采用高通量测序技术对3 个孝感凤窝酒曲的细菌多样性分析发现,凤窝酒曲中存在大量的核心细菌菌群。Cai 等[18]对8 个发酵剂样品进行了高通量测序,鉴定出10 属酵母和霉菌,11 属细菌;真菌多样性分析表明,发酵剂样品中的真菌成分存在显著差异,发酵剂微生物群主要以根霉属为主,表明其在甜黄酒酿造过程中淀粉水解中的重要作用。朱小芳等[19]通过现代分子生物学技术,研究了传统黄酒浸米浆水中的细菌群落结构,发现乳酸菌是浸米浆水中的优势细菌,种类繁多且数量占据优势。因此,高通量测序技术具有高通量、高分辨率、成本低、能够双向测序等优点,能够准确快速的分析出样品中复杂的微生物群落结构,是样品中复杂微生物多样性分析的最佳方法[20-21]。
黄酒生产用曲分为大曲(例如大米红曲、小米红曲、麦曲)、小曲(例如中药曲、药曲),也有人使用黄酒曲酿酒。本研究所选用的酿酒原料“红谷”是一种新兴的黄酒酿造原料,在其研究过程中多为原料特性及工艺研究,而哪种酒曲更适用于其发酵酿造高品质黄酒还未被研究。故本研究采用高通量测序技术对黄酒6 种不同酒曲微生物多样性及群落结构进行分析,旨在为后续红谷黄酒发酵最优酒曲的选择及研究提供理论参考。
1 材料与方法
1.1 材料与仪器
大米红曲(JQ1)福建省古田县程久红粬有限公司;小米红曲(JQ2)河南南阳润之酒业;麦曲(JQ3)随州市大洪山绿色生态保健食品有限公司;中药曲(JQ4)江苏微康生物科技有限公司;黄酒曲(JQ5)安琪酵母股份有限公司;酒药(JQ6)湖北楚寨发酵制品有限公司;红谷 河南南阳当地超市;甲醛(38%)洛阳市化学试剂厂;氢氧化钠 天津市风船化学试剂科技有限公司;葡萄糖、苯酚 天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸 天津市光复精细化工研究所;酒石酸钾钠、无水亚硫酸钠天津市光复科技发展有限公司;盐酸 洛阳昊华化学试剂有限公司;以上试剂均为分析纯;Power-Soil®DNA Isolation Kit 试剂提取盒 深圳市安必胜科技有限公司;KOD FX Neo 聚合酶、KOD FX Neo缓冲液 东洋纺(上海)生物科技有限公司;脱氧核苷三磷酸(dNTP)上海源叶生物科技有限公司;ddH2O上海谱振生物科技有限公司;OMEGA DNA 纯化柱 广州飞扬生物工程有限公司。
5424R 型高速冷冻离心机 上海力申科学仪器有限公司;PAL-α型糖度计 日本爱拓公司;ME204E型电子分析天平 梅特勒-托利仪器(上海)有限公司;PHS-3C 型pH 计 上海仪电科学仪器股份有限公司;DYY-5 型琼脂糖凝胶电泳仪 北京六一仪器厂;101 型电热鼓风干燥箱 北京市永光明医疗仪器厂;725N 型紫外可见分光光度计 上海仪电分析仪器有限公司;DZKW-4 型电热恒温水浴锅 北京中兴伟业仪器有限公司;ZNCL-BS 型磁力搅拌器 上海卓越仪器设备有限公司;NanoDrop 2000 超微量分光光度计 上海在途生物科技有限公司。
1.2 实验方法
1.2.1 不同酒曲红谷黄酒发酵过程中理化指标的测定 选择不同酒曲(大米红曲、小米红曲、麦曲、中药曲、黄酒曲、酒药)进行发酵实验,料液比(红谷:酒曲:水)控制在1:0.16:0.5(g/g/mL)将蒸熟晾凉后的红谷、酒曲、水混合均匀,落料品温控制在28~30 ℃;前发酵维持7 d,发酵温度为28~32 ℃;后发酵时间为23 d,控制温度25~26 ℃酿造红谷黄酒并对成品中的基本理化指标进行测定,并进行感官品鉴。样品分析前采用8000 r/min 离心10 min,取上清液测定。酒精度、pH、总酸、氨基态氮含量:按照GB/T 13662-2018《黄酒》测定;总糖、还原糖含量:采用3,5-二硝基水杨酸(DNS)法测定[22];可溶性固形物:使用糖度仪直接测定;出糟率:参照油卉丹[23]的方法。
1.2.2 黄酒感官品评 如表1,感官品鉴参考黄酒国标要求,邀请11 名经过培训的专业评价员在感官评定实验室评定打分:第一步,小组成员观察,品尝和嗅探黄酒,以识别和记录所有感官属性。第二步,小组成员讨论并确定属性,然后根据提供的标准建立最终的描述符。黄酒的4 个描述词包括色泽(透明,较透明和浑浊),香气(浓郁和较浓郁),口感(爽口,较爽口和不爽口)和风格(协调,较协调和不协调)。在最后一步,要求小组成员通过量化每个感官描述符来表达自己的判断。
1.2.3 DNA 的提取和PCR 扩增 采用PowerSoil®DNA Isolation Kit 试剂提取盒提取酒曲微生物宏基因组的总DNA,用1%琼脂糖凝胶电泳检测DNA提取结果,用NanoDrop 2000 超微量分光光度计检测DNA 提浓度和纯度。以提取的DNA 为模板,根据引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rDNA 的V3 和V4 区扩增。根据引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')对真菌ITS1区域的扩増。
DNA 模板50 ng,正向和反向引物各0.9 μL,KOD FX Neo 聚合酶0.6 μL,KOD FX Neo 缓冲液15 μL,脱氧核苷三磷酸(dNTP)6 μL,加入ddH2O 定容至30 μL。PCR 扩增程序:98 ℃预变性2 min;98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,30 个循环;72 ℃延伸5 min,4 ℃保存。
1.2.4 高通量测序 PCR 产物通过1.8%琼脂糖凝胶回收,利用OMEGA DNA 纯化柱进行纯化,用1.8%琼脂糖凝胶电泳检测,文库构建和测序由北京擎科生物科技有限公司Illumina Novaseq6000 PE250平台来完成。以上DNA 的提取、PCR 扩增及高通量测序均由北京擎科生物科技有限公司完成。
1.3 数据处理
测序得到的数据是双端序列的,首先将成对的Reads 拼成一条序列,对拼接效果进行质量控制和过滤,然后根据引物序列和序列首末两端的barcode 进行区分样品并得到有效序列,经过校正序列方向后,即为优化数据。使用Usearch 软件,对前述得到的优化序列按97%的相似度进行操作分类单元(Operational Taxonomic Units,OTUs)划分,构建稀疏曲线(Rarefaction curves),计算样品中微生物均匀度和丰富度指数,并统计分析细菌和真菌群落信息。
2 结果与分析
2.1 不同酒曲红谷黄酒发酵过程中理化性质分析
由表2 可知,小米红曲酿造的样品酒精度最高,达到13.78%vol,与其他组有显著性差异(P<0.05)。其他发酵组的样品酒精度都大于11%vol,满足《黄酒》标准酒精度≥8.0%vol 的要求。红谷黄酒采用半固态法酿制,酒曲是决定能否正常发酵以及发酵产品质量好坏的决定性因素。在酿酒期间,红谷黄酒的酒精度随发酵进行而剧升,酵母等微生物快速繁殖,将前期产生的可发酵糖转化成酒精[18],物料下沉,7 d左右酒醪上层液体澄清,之后缓慢发酵,25~30 d 发酵完成。
各发酵酒样中pH 在3.5~4.6 范围内(表2),符合黄酒酸度要求。氨基态氮是以氨基酸形式存在的氮元素,它的含量高低影响了黄酒的感官等级和质量风格。根据GB/T 13662-2018《黄酒》标准,非稻米黄酒的氨基态氮含量≥0.16 g/L 即表示发酵达到要求。发酵醪液中乳酸杆菌等微生物分泌的酸性蛋白酶,能分解表皮蛋白,可溶于水的小分子氨基酸、呈味肽等活性成分被分泌出来[24]。在发酵组中,用小米红曲酿造的黄酒中氨基酸态氮水平较高,使红谷中的蛋白质资源得到了有效的利用,增加了酒体鲜味。
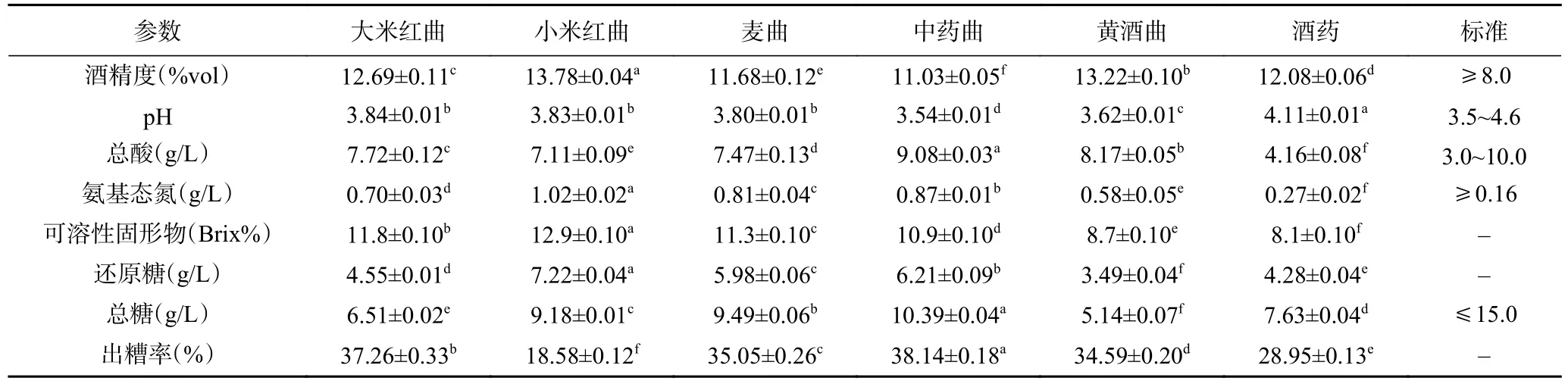
表2 不同酒曲酿制的红谷黄酒理化指标Table 2 Physiochemical indexes of red millet Huangjiu brewed with different koji
在酿造期间,原料在各种水解酶的作用下,细胞内容物溶出,发酵醪中可溶性固形物也增加[25]。各发酵组间差异显著(P<0.05),由表2 可知,小米红曲酿造的黄酒的可溶性固形物含量较高,为12.9Brix%。
由表2 可知,总糖和还原糖呈现相似特征,以黄酒曲和酒药为发酵剂酿制的黄酒样品显示出较好的还原糖代谢能力。六种酒曲酿造黄酒样品的出糟率高低依次为小米红曲<酒药<黄酒曲<麦曲<大米红曲<中药曲,发酵组之间存在显著性差异(P<0.05)。出糟率与原料的淀粉利用率是成反比的,所以造成这种情况的原因是小米红曲中的微生物发酵时能分泌大量的糖化酶,落料后饭粒能很好糖化溶解,增加了淀粉的利用率,而中药曲发酵时醪液呈糨糊状,从而降低淀粉酶解速率。
2.2 不同酒曲黄酒的感官评价
黄酒的感官分析,即通过产品的外观、香气、口味、风格得到黄酒的整体印象,可以直观反映黄酒香气强弱及优劣程度。6 组黄酒感官评价结果如表3。在感官指标方面,黄酒外观呈红色(大米红曲、小米红曲),白色(酒药),黄色(麦曲、中药曲、黄酒曲),清透明亮,有晶莹光泽,酒液底部显示少量聚集物,有黄酒独有的浓郁、爽口感。6 组黄酒按感官评分由高到低依次为小米红曲,大米红曲,黄酒曲,酒药,麦曲,中药曲。由此而言,这表明酒曲的种类对黄酒酿造有重要影响。

表3 不同酒曲酿制的红谷黄酒感官品评价Table 3 Sensory evaluation of red millet Huangjiu brewed with different koji
2.3 红谷黄酒酒曲中微生物多样性分析
基于ITS1 和16S rRNA 测序,观察到的OTU稀疏曲线、ACE 指数、丰富度(Chao 1)指数、香浓(Shannon)指数、相对丰度被用于评估6 种黄酒酒曲样品中的真菌和细菌多样性、丰度。测序数据和分析表明,ITS1 和16S rRNA 基因的文库通常构建良好。
2.3.1 OTU 聚类及稀释曲线分析 为了解并分析试验样本测序结果包含的菌属等信息,对Reads 在97.0%的相似度水平下进行预聚类、并将其分类为OTUs,每个OTU 对应于一种代表序列,然后基于OTU 进行物种注释,利用聚类程序Usearch 软件,对这些序列进行聚类后,各样品OTU 的个数不同,黄酒酒曲样品中所含OTU 数量如表4。
由表4 可知,6 种黄酒酒曲中,细菌和真菌OTU总数分别为477 和214,细菌OTU 数目均大于真菌OTU 数目。JQ3、JQ4 中细菌、真菌OTU 数目最多,JQ1 中细菌、真菌OTU 数目最少。

表4 不同酒曲样品细菌和真菌OTU 数目Table 4 Number of bacterial and fungal OTUs in different rice wine kojis samples
在相同的测序深度下,还可以比较不同样本中OTU 的数目,在一定程度上评判样本的多样性高低。稀释曲线如图1 所示,对于细菌,当测序量小于10000 时,OTU 数目快速增加,在序列数目为10000~70000 之间时,除发酵剂JQ2 样品外,随着序列数的増加,OTU 数目增加走势趋于平缓,表明测序趋于饱和,当前测序结果可以足够反映样本中微生物多样性。对于真菌,当序列数目小于20000 时,样本的OTU 快速增加;当序列数目大于20000 时,除发酵剂JQ3 和JQ1 样品快速增加外,大部分样本的OTU缓慢增加。虽然真菌稀释曲线还未达到平台期,但是每个样品测序覆盖率均超过99.95%;这表明即使测序深度和测序量的增加可能会继续发现新的种属,但是酒曲中的微生物多样性却不会随测序的增大而改变,当前测序结果可以足够反映样本中微生物多样性[26]。
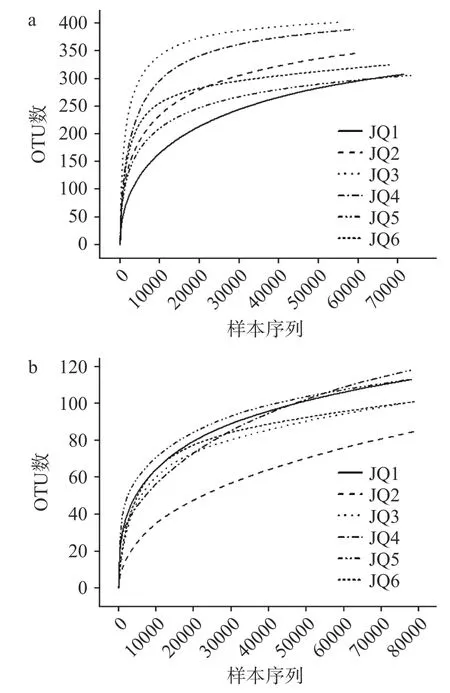
图1 细菌和真菌稀释曲线Fig.1 Bacteria and fungi rarefaction curve
2.3.2 不同酒曲微生物的Alpha 多样性分析 由表5可知,6 种酒曲样品经测序后共获得445483 条高质量细菌序列。在97%相似度情况下,细菌ACE 指数在332.99~411.07 之间,Shannon 指数在3.73~6.02之间,Chao 1 指数在349.05~460.14 之间,覆盖率范围99.91%~99.99%。JQ3、JQ4 的细菌Chao 1 指数和ACE 指数均处于较高的数值,这表明JQ3、JQ4的细菌群落丰富多较高,其群落结构较为复杂。如图2a 所示,随着测序量的增加物种的数量也在增加,但是Shannon 曲线却进入平缓期,趋于稳定,这表明物种数量达到饱和,即使有新的细菌物种产生,但是细菌的多样性也不会随着测序量的增加而发生变化。
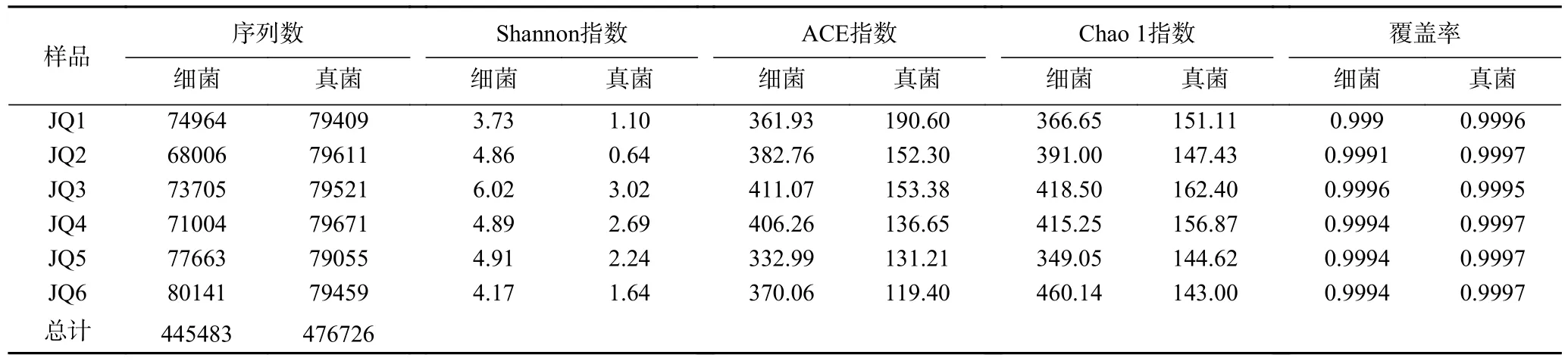
表5 不同酒曲细菌和真菌多样性指数表Table 5 Diversity index of bacteria and fungi in different rice wine kojis samples
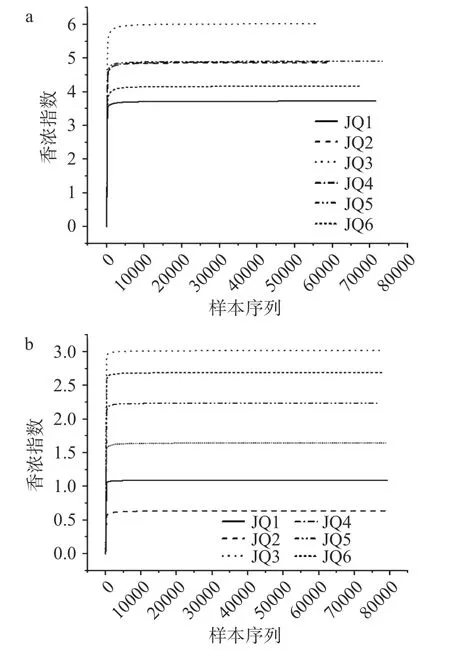
图2 六种酒曲中细菌和真菌的Shannon 指数图Fig.2 Shannon index of bacteriaand fungi in six rice wine kojis
6 种酒曲样品经测序后共获得476726 条高质量真菌序列。在97%相似度情况下,真菌ACE 指数在119.40~190.60 之间,Shannon 指数在0.64~3.02之间,Chao 1 指数在143.00~162.40 之间,覆盖率范围99.95%~99.97%。JQ1、JQ3 的真菌Chao1 指数和ACE 指数均处于较高的数值,这表明JQ1、JQ3的真菌群落丰富多较高,其群落结构较为复杂;如图2b 所示,随着测序量的增加物种的数量也在增加,但是Shannon 曲线却进入平缓期,趋于稳定,这表明物种数量达到饱和,即使有新的真菌物种产生,但是真菌的多样性也不会随着测序量的增加而发生变化。
实验样品中细菌的Chao 1 指数和ACE 指数均远大于真菌的指数,这表明6 种黄酒酒曲中细菌物种丰富度均远高于真菌。实验样品中细菌和真菌的文库覆盖率都比较高,这表明本次测序结果基本能够代表样品的实际情况。
2.4 不同酒曲微生物的群落结构分析
2.4.1 细菌群落结构分析 在门水平上6 种酒曲共检测出15 个细菌门,由图3a 可知,其中丰度最高10 种分别为厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、盐厌氧菌门(Halanaerobiaeota)、软壁菌门(Tenericutes)、芽单胞菌门(Gemmatimonadetes)、酸杆菌门(Acidobacteria)。如图3a 所示,不仅相对丰度较高并且6 种酒曲中均有分布的为厚壁菌门、变形杆菌门、放线菌门。不同酒曲之间其微生物菌群也有显著的不同,其中JQ2,JQ3,JQ4,JQ6 的第一优势细菌门为厚壁菌门,丰度分别为32.65%,40.46%,68.46%,48.22%;变形杆菌门是JQ2,JQ3,JQ4,JQ6 的第二优势细菌门,占样品序列的28.52%,16.75%,14.01%,18.33%。而JQ1,JQ5的第一优势细菌门为变形杆菌门,丰度分别为46.89%,51.88%;厚壁菌门是他们的第二优势细菌门。放线菌门主要存在于JQ1,JQ2,JQ4 中,丰度分别为22.54%,22.64%,13.43%,在JQ6 中最少仅为2.22%。蓝细菌门主要存在于JQ3,JQ5 中,占样品序列的20.46%,14.90%。不同酒曲之间其微生物群落组成不同,其中JQ1,JQ2,JQ4 细菌微生物群落组成较为相似,JQ3,JQ5,JQ6 细菌微生物群落组成较为相似,但是他们的相对丰度存在着明显的差异。
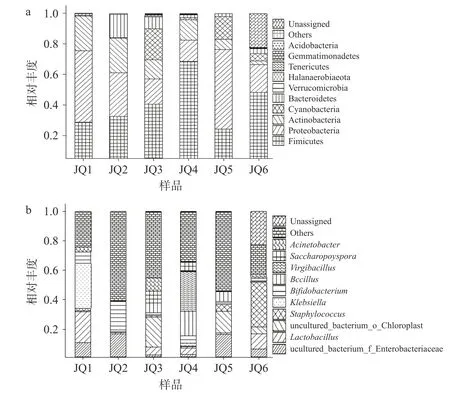
图3 不同酒曲中主要细菌门和主要细菌属的分布Fig.3 Changes in relative abundance of major bacterial phylum and major bacterial genus in different Koji
在属水平上6 种酒曲中的细菌属共检测到247 种,如图3b 所示,其中丰度最高10 种分别为肠杆菌科未培养细菌属(uncultured_bacterium_f_Enterobacteriaceae)、乳酸杆菌属(Lactobacillus)、未培养叶绿体细菌属(uncultured_bacterium_o_Chloroplast)、葡萄球菌属(Staphylococcus)、克雷伯氏菌属(Klebsiella)、双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Bacillus)、枝芽孢菌属(Virgibacillus)、糖多孢菌属(Saccharopolyspora)、不动细菌属(Acinetobacter)。每种酒曲的细菌属组成都存在着较大的差异,肠杆菌科未培养细菌属(uncultured_bacterium_f_Enterobacteriaceae)、乳酸杆菌属(Lactobacillus)是6 种酒曲共有的细菌属,但其丰度有着很大的差异。JQ1 中主要细菌属的组成为肠杆菌科未培养细菌属(uncultured_bacterium_f_Enterobacteriaceae,10.87%)、乳酸杆菌属(Lactobacillus,20.86%)和克雷伯氏菌属(Klebsiella,30.46%)。乳酸杆菌属(Lactobacillus)是JQ1样品中的优势菌属。在JQ2 中,双歧杆菌属(Bifidobacterium)和肠杆菌科未培养细菌属(uncultured_bacterium_f_Enterobacteriaceae)为优势细菌属,含量分别为19.31%和16.77%。未培养叶绿体细菌属(uncultured_bacterium_o_Chloroplast)是JQ3、JQ5 中的主要细菌属,其丰度分别为20.44%、14.90%。枝芽孢菌属(Virgibacillus)仅在JQ4 中作为优势细菌属,占样品序列的27.04%。葡萄球菌属(Staphylococcus)只在JQ6 中丰度最大,为30.45%,在其他酒曲中占比很少甚至可以忽略不计。
据报道,酒曲中的细菌属有芽孢杆菌属、乳酸杆菌属、乳球菌属、链球菌属、芽孢梭菌属、葡萄球菌属、微细菌属、醋杆菌属等菌属[27]。芽孢杆菌属可以产生淀粉酶以及蛋白酶,在酿酒过程中有着及其重要作用,能够降解淀粉、蛋白质等大分子物质[28]。李艳等[29]发现在羊羔大曲中乳酸杆菌属是其优势菌属,其含量的高低影响着甜酒中酸味的轻重。刘芸雅[30]等发现麦曲中优势菌属为芽孢杆菌属。郑亚伦等[31]研究发现两种高温大曲细菌群落的优势菌属为克罗彭斯特菌属、糖多孢菌属、高温放线菌属、芽孢杆菌属、乳酸杆菌属和魏斯氏菌属。有相关文献报道大曲的主要优势微生物菌属为芽孢杆菌属、乳酸杆菌属、乳酸球菌属[32-34]。上述优势细菌属与本研究的细菌属有部分重合。
2.4.2 细菌微生物群落相似性分析 由主坐标分析图4a 可知,JQ1,JQ2 的距离较近,群落差异较小;JQ4,JQ6 的距离较近,群落差异较小;JQ5 距离其他5 种酒曲的距离都较远,差异较大为单独的一个组群。通过对样品细菌Beta 多样性距离矩阵进行层级聚类分析,构建样品层级聚类树研究不同样品的相似性和差异性[35]。如图4b,6 种酒曲可分为3 类,JQ1,JQ2 的细菌属聚为一类,JQ3,JQ4,JQ6 的细菌属聚为一类,JQ5 的细菌属单独为一类,Beta 分析结果与PCoA 分析较为相似。
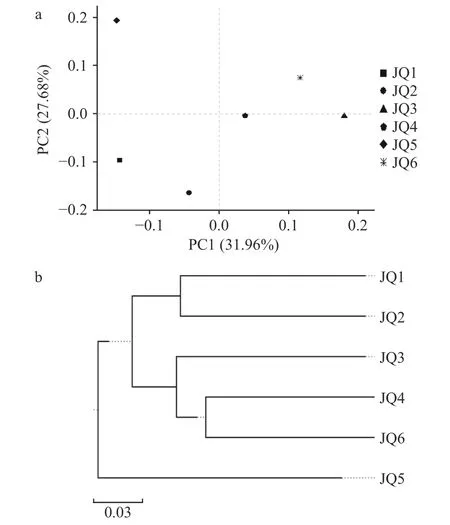
图4 细菌相似性分析Fig.4 Bacterial similarity analysis
2.4.3 真菌群落结构分析 在门水平上,6 种酒曲共检测出6 个真菌门,由图5a 可知分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、隐菌门(Rozellomycota)。在门水平上相对丰度高并且6 种酒曲中都存在的真菌门为子囊菌门。不同酒曲样品之间其微生物群落组成也存在着差别。JQ1、JQ2、JQ3、JQ4 中97.5%以上都为子囊菌门,其中JQ1 中的丰度更是高达99.9%。担子菌门是JQ5 中的第二优势真菌门,其丰度为36.47%。毛霉门为JQ6 中的第二优势真菌门,占样品序列的41.50%。
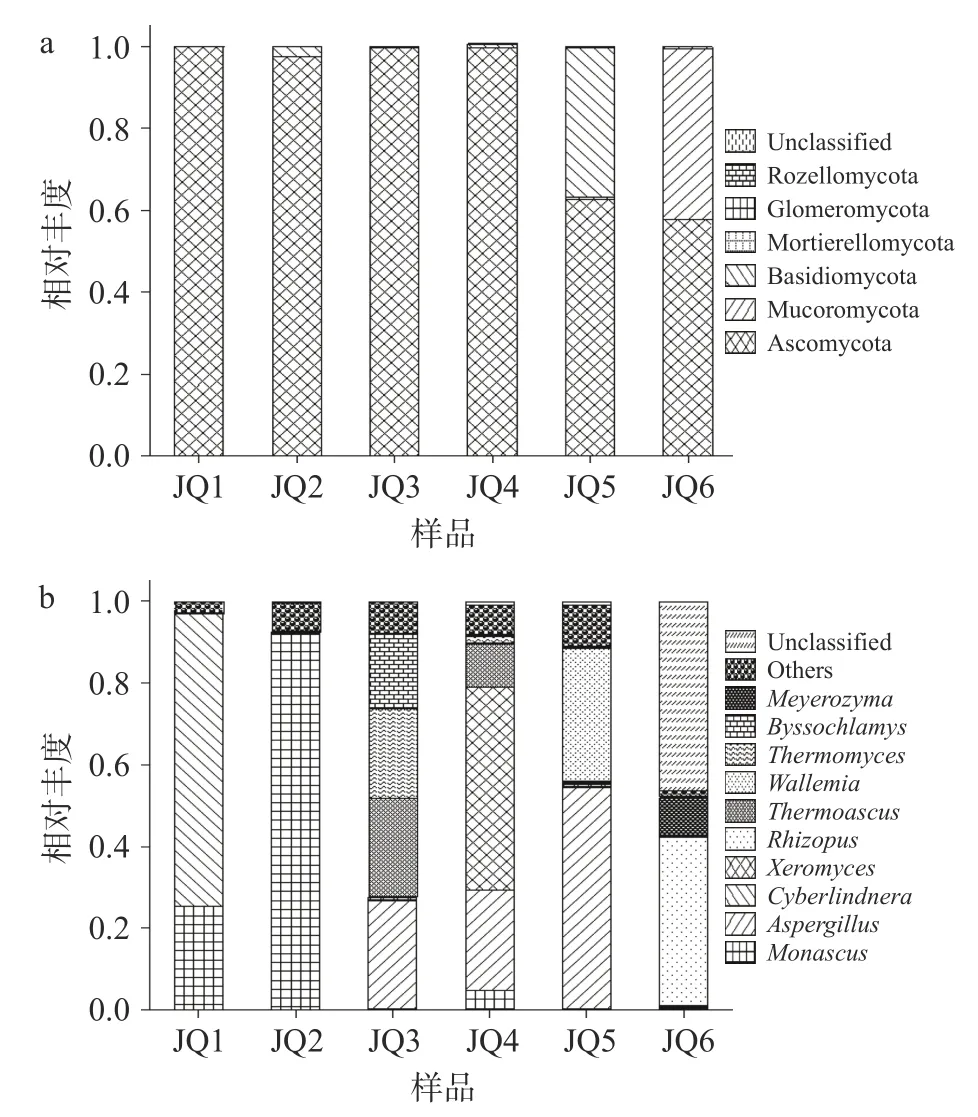
图5 不同酒曲中主要真菌门和主要真菌属的分布Fig.5 Changes in relative abundance of major fungi phylum and major fungi genus in different Koji
在属水平上6 种酒曲中的真菌属共检测到93种,如图5b 所示,其中丰度最高10 种分别红曲霉属(monascus)、曲霉菌属(Aspergillus)、塞伯林德纳氏酵母属(Cyberlindnera)、耐干霉菌属(Xeromyces)、米根霉属(Rhizopus)、热子囊菌属(Thermoascus)、节担菌属(Wallemia)、嗜热菌属(Thermomyces)、丝衣霉菌属(Byssochlamys)、季也蒙迈耶氏酵母属(Meyerozyma);由图5b 可看出,每种酒曲的真菌属组成都存在着较大的差异。JQ1 中第一、第二优势真菌属分别为塞伯林德纳氏酵母属和红曲霉属,其丰度分别为71.45%及25.38%。JQ2 的优势菌属为红曲霉属,占样品序列的92.03%。JQ3 的优势菌属是曲霉菌属、热子囊菌属、嗜热菌属、丝衣霉菌属,丰度分别为26.55%、24.09%、21.88%、18.45%。JQ4的优势菌属是耐干霉菌属(19.67%),JQ5 的优势菌属是曲霉菌属(54.11%),米根霉属(41.50%)是JQ6的优势菌属。
子囊菌门为绝对优势菌门,担子菌门与毛霉门是仅次于子囊菌门的优势菌门,这与凌梦萤的研究结果一致[36]。王丹丹等[37]发现孝感凤窝酒曲在门水平上子囊菌门为其主要真菌门,这与本研究中子囊菌门是六种酒曲优势真菌门结果一致。孝感米酒的相关研究发现其优势真菌属是根霉属、曲霉属、酵母属[18]。曲霉属等丝状真菌可在黄酒发酵过程中分泌α-淀粉酶、β-淀粉酶、糖化酶和蛋白酶等有利于淀粉糖化、蛋白质分解的酶类[38]。据研究发现,红曲霉属可以代谢多种酶类并能促进底物分解[39]。郑亚伦等研究发现两种高温大曲优势真菌属为热子囊菌属、嗜热真菌属和曲霉菌属等[31]。
2.4.4 真菌微生物群落相似性分析 如图6a 所示,真菌NMDS 结果与细菌存在着差异,JQ1、JQ2 距离较近,同在第四象限,二者群落差异较小。JQ3、JQ4、JQ5 三者距离较近,同在中下部,它们之间的群落差异较小。JQ6 在第一象限右上方,距离其他五个点都比较远,存在着较大的差异,其单独为一个组群;由图6b 可知,6 种酒曲可分为3 类,JQ1,JQ2 的真菌属聚为一类,JQ3,JQ4,JQ5 的细菌属聚为一类,JQ6的细菌属单独为一类,Beta 分析结果与NMDS 分析结果一致。

图6 真菌相似性分析Fig.6 Fungi similarity analysis
3 结论
利用高通量测序技术对6 种不同酒曲的微生物群落以及物种多样性之间的差异进行分析,从6 种酒曲中共检测出15 个细菌门和6 个真菌门;247 个细菌属和93 个真菌属。酒曲中含有丰富的微生物群落,不同酒曲尽管其有着相似的微生物群落结构,但是他们的丰度仍然有着明显差异。6 种酒曲中,JQ1、JQ2 的细菌种群和真菌种群都相似,JQ3、JQ4、JQ6 的细菌种群较为相似,JQ3、JQ4、JQ5 的真菌种群比较相似,这体现了酒曲中微生物组成种类的复杂程度。微生物的多种代谢产物对酒的品质、口感都有着非常重要的作用,本研究通过对6 种不同酒曲的微生物群落结构进行研究,为后续黄酒发酵最优酒曲的选择提供了理论参考。
