异麦芽酮糖减少小鼠肝脏脂肪堆积的关键基因筛选与验证
2022-08-16何秋玲张彩平刘泳杏季久秀
何秋玲,张彩平,桂 静,刘泳杏,季久秀,周 波,张 震,
(1.桂林医学院药学院,广西桂林 541199;2.桂林医学院智能医学与生物技术学院,广西桂林 541199;3.临沂大学农林科学学院,山东临沂 276005;4.桂林医学院科学实验中心,广西桂林 541199)
蔗糖的过量摄取与高血糖、高血脂、非酒精性脂肪肝(Non-alcohol Fatty Liver Disease,NAFLD)等慢性疾病的发生发展密切相关[1]。持续的高蔗糖饮食会促进脂肪生成,引发脂肪沉积于肝脏,导致肝脏白细胞浸润和促炎细胞因子溢出,显著增加了非酒精性脂肪肝病的发病风险[2]。非酒精性脂肪肝病又使得机体对葡萄糖的代谢能力下降、肝糖原合成减少,从而引发高血糖和高胰岛素血症,胰岛素敏感性降低,加速以胰岛素抵抗为特征的II 型糖尿病的发展,促使脂肪酸的从头合成和甘油三酯合成,导致血脂水平升高[3-4]。随着现代社会糖尿病和高血脂患者的不断增加,人们不断探索新型的甜味剂,以期在满足日常需要的同时还可降低因过量摄入引发的健康风险。
异麦芽酮糖(Isomaltulose)又称帕拉金糖,是由D-果糖和D-葡萄糖通过α-1,6 糖苷键连接的天然二糖,其味道和外观均与蔗糖类似,在工业上于1954年首次以蔗糖为原料实现转化。目前,我国列入食品安全国家标准食品添加剂使用标准(GB 2760-2014)的食糖替代品有异麦芽酮糖、麦芽糖醇、山梨醇、木糖醇等。其中只有异麦芽酮糖的最大使用量不受限制,其它糖醇超过一定摄入量会出现不同程度的助泻现象[5]。Keyhani-Nejad 等[6]报道,与蔗糖相比,异麦芽酮糖能够维持葡萄糖稳态,降低餐后葡萄糖依赖性促胰岛素释放肽(glucose-dependent insulinotropic peptide,GIP)和胰岛素的释放,有助于预防非酒精性脂肪肝。Hwang 等[7]研究发现异麦芽酮糖具有比蔗糖更慢的消化速率,可以减少肝脏中脂肪堆积和提高葡萄糖耐量,摄入异麦芽酮糖的的小鼠肝脏切片与正常小鼠无异。Jang 等[8]在14 名志愿者的临床研究中发现,异麦芽酮糖组餐后1 h 的血糖水平明显低于蔗糖组,这一研究表明异麦芽酮糖缓慢水解的特性可使血糖保持平稳,不会引起胰岛素水平显著升高,能有效地改善胰岛素敏感性。Lee 等[9]使用蔗糖-异麦芽酮糖混合物(palatinose-sucrose mixtures)饲喂小鼠,结果显示相比于饲喂含有30%异麦芽酮糖的混合物组的小鼠,饲喂含有50%异麦芽酮糖的混合物组小鼠血糖水平较低,HMGCR、CYP7A1和PPARγ基因表达量更低。
目前关于异麦芽酮糖的研究主要集中在其对血糖的影响上,而对它如何参与脂质代谢的分子机制研究尚不深入。本研究比较异麦芽酮糖和蔗糖影响肝脏组织基因转录的差异,筛选和验证其减少肝脏脂肪堆积的关键基因,为进一步研究异麦芽酮糖影响肝脏脂质代谢的分子机制提供理论支撑。此外,中国广西是蔗糖的主产区,目前已具备将蔗糖转化为异麦芽酮糖的成熟工艺,本研究积极探索异麦芽酮糖的作用机制,对异麦芽酮糖的推广和生产实践也具有一定的积极意义。
1 材料与方法
1.1 材料与仪器
SPF 级10 周龄雄性昆明小鼠(25~30 g)21 只,北京维通利华实验动物技术有限公司(合格证号:SCXK(京)2021-0006);小鼠日粮(含40.5%碳水化合物,41.5%脂肪和18%蛋白质)北京科澳协力饲料有限公司;异麦芽酮糖(Cas 号:13718-94-0,BR 级)、蔗糖(Cas 号:57-50-1,BR 级)上海麦克林生化科技有限公司;乙醇、二甲苯 西陇化工股份有限公司;GeneJET RNA Purification Kit RNA 提取试剂盒、SYBR Green qPCR Master Mix Thermo Fisher;逆转录试剂PrimeScript RT Master Mix Takara 公司;引物合成 生工生物工程(上海)股份有限公司。
RM2235 轮转切片机 德国徕卡生物系统公司;ABI7900 实时荧光定量PCR 仪 美国应用生物系统公司。
1.2 实验方法
1.2.1 异麦芽酮糖与蔗糖饲喂实验 21 只雄性昆明小鼠随机分为三个组:空白组、蔗糖组、异麦芽酮糖组,每组7 只,每笼3 只。为比较小鼠在相对自然的状态下摄入异麦芽酮糖和蔗糖对其肝脏脂质代谢的影响,避免短期大剂量饲喂对小鼠应激和免疫方面的影响[10]。本实验采用长期间隔的饲喂方式,具体方法如下:500 mg 蔗糖/异麦芽酮糖溶解于小鼠饮用水,配制成1%水剂,给与小鼠自由饮用,防止频繁的抓取进行灌胃可能划伤小鼠食道或气管,影响小鼠的正常生长。每隔4 d 饲喂一次,饲喂前一晚禁食不禁水。除此外日粮为普通标准日粮,动物正常摄食和饮水,连续饲喂22 周,模拟人类长期少量的饮食摄入方式。实验期间每天观察小鼠的一般状况,通过计量每次饲喂前后水瓶中的水量记录小鼠的饮用量、称量实验前后小鼠的体重计算小鼠的平均日增重,饲喂结束后采用颈椎脱臼法处死小鼠。饲养环境温度18~25 ℃,相对湿度30%~60%。
1.2.2 肝脏组织切片和脂质代谢相关基因的实验验证 取处死后小鼠的肝脏组织经福尔马林固定,酒精脱水,二甲苯透明后,进行石蜡包埋切片(30 μm),经脱蜡后进行苏木精—伊红(hematoxylin-eosin,HE)染色,使用Motic Med 6.0 数码医学图像分析系统对细胞形态和数目进行观察和计算。取小块小鼠肝脏提取RNA,取1 μg 总RNA 逆转录后利用Premier Bank设计引物(https://pga.mgh.harvard.edu/primerbank/)。经预实验验证了引物(表1)的有效性和特异性后,以β-actin 为内参,反应体系为cDNA 1 μL、前引物0.5 μL、后引物0.5 μL、2× Green qPCR mix 5 μL、DEPC ddH2O 3 μL;反应程序为94 ℃预变性2 min、94 ℃变性30 s、61 ℃退火30 s、72 ℃延伸30 s,40 个循环,使用标准曲线法进行实时荧光定量PCR(Quantitative Real-time PCR,qPCR),以β-actin 表达量对各基因进行标准校正。
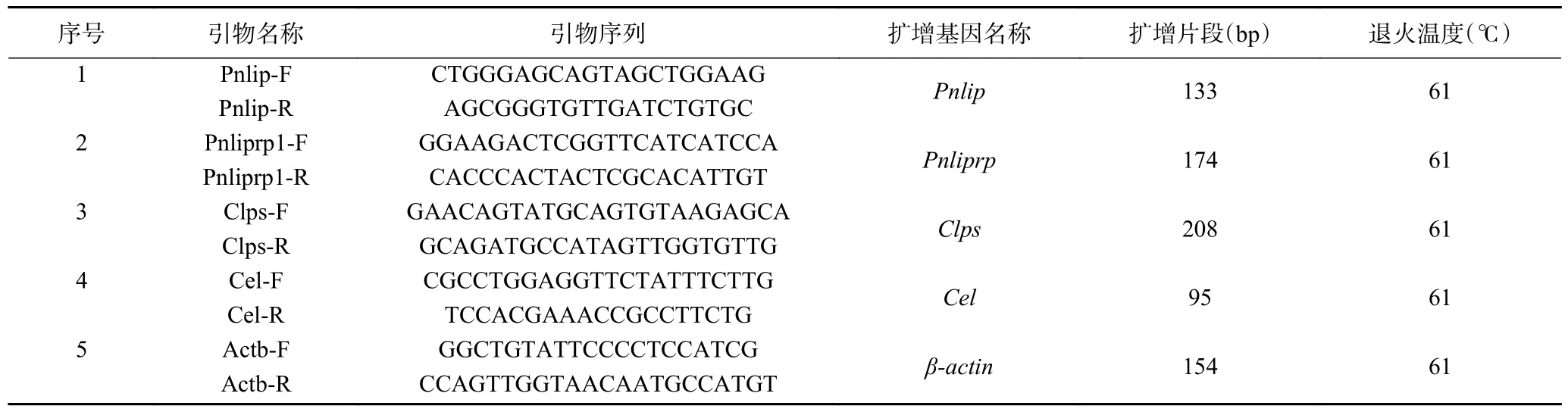
表1 本研究中所用的引物列表Table 1 List of primers used in this study
1.3 数据处理
1.3.1 肝脏转录组数据的获取 从GEO(Gene Expression Omnibus,http://www.ncbi.nlm.nih.gov/geo/)数据库[11]中筛选出饲喂异麦芽酮糖和蔗糖的小鼠肝脏组织转录组数据GSE54723(n=14,其中异麦芽酮糖饲喂7 例,蔗糖饲喂7 例)。人类非酒精性脂肪肝转录组数据来自GEO 数据库GSE163211(n=318,其中正常人肝脏组织9 例,NAFLD 病人309 例),使用Graphpad 软件中的ROUT 函数(Q=1%)去除离群值后用于后续正常肝脏组织与NAFLD 之间的差异表达基因筛选[12]。
1.3.2 差异表达基因的筛选和基因通路分析 采用Limma 软件包筛选基因芯片中饲喂异麦芽酮糖和蔗糖的小鼠肝脏组织以及正常人肝脏组织与NAFLD病人之间的差异表达基因(Differentially Expressed Genes,DEGs),筛选条件为P<0.05,差异倍数|log2FC|≥1[13]。将筛选出的log2FC≥1 的基因定为上调基因,log2FC≤-1 的基因定为下调基因。利用GeneCards(https://www.genecards.org)和Rat Genome Database(https://rgd.mcw.edu/rgdweb/homepage/)进行基因功能查询,Metascape(http://metascape.org/)进行差异表达基因通路富集分析[14],利用imageGP 网站绘制差异基因火山图和基因通路图(http://www.ehbio.com/ImageGP/index.php/Home/Index/)。
1.3.3 基因网络构建和关键节点基因的筛选 使用String 网站(https://string-db.org/)分析DEGs 之间蛋白质的相互作用关系[15],设定筛选条件为combined score>0.4 构建蛋白互作网络(protein protein interaction network,PPI)。将String 所得的PPI 导入到Cytoscape3.6.1(http://www.cytoscape.org/)中,Centiscape 是Cytoscape 中一个可以一次计算多个中心值的插件,它基于拓扑和生物学属性可搜寻最为显著差异的基因。其中参数“度”(Degree)可评估网络节点基因的调控性,用于衡量某蛋白与其它蛋白的相关性。Degree 值最大的基因即为核心基因,位于PPI 网络图的中心位置[16]。本研究利用Centiscape插件计算网络图各节点的Degree 值,得到关键节点基因,并从Cytoscape 软件中导出节点基因互作图。使用R 软件包“WGCNA”将基因表达量作为矩阵进行加权基因共表达网络分析(Weighted correlation network analysis,WGCNA),计算关键模块。该方法是一种多样本基因表达模式的分析方法,可进行具有生物学意义的聚类分析,筛选tom 值排名前20 的模块[17],处于调控网络中心的基因为核心基因,通常是具有关键作用的调控因子,并通过R 语言软件(www.r-project.org/)导出核心基因。本研究采用两种计算方法,取重叠的基因作为高可信度的节点基因,避免了单一算法出现偏好的情况。
1.3.4 显著性检验 采用Student'st-test 对数据进行显著性检验,P>0.05 为不显著;P<0.05 为显著,用*表示;P<0.01 为极显著,用**表示。
2 结果与分析
2.1 异麦芽酮糖组与蔗糖组小鼠肝脏组织差异基因表达分析
从GEO(Gene Expression Omnibus)数据库中下载饲喂异麦芽酮糖(n=7)和蔗糖(n=7)的小鼠肝脏组织转录组数据GSE54723,使用Limma 软件包以P<0.05 且差异倍数|log2FC|≥1 为筛选条件,共筛选出49 个DEGs,其中包含上调基因35 个,下调基因14 个(图1A 和图1C),差异基因的详细功能和P值见表2。

表2 异麦芽酮糖和蔗糖饲喂组间小鼠肝脏组织差异表达的基因及其功能Table 2 Differentially expressed genes and their functions in liver tissue of mice fed with isomaltulose and sucrose

续表2

图1 异麦芽酮糖与蔗糖处理组的差异基因表达火山图(A)、通路富集图(B)和柱状图(C)Fig.1 Volcano plot (A),pathway enrichment plot (B) and histogram (C) of differentially expressed genes between isomaltulose and sucrose treatment groups
将49 个差异表达基因导入Metascape 进行基因通路富集分析[14],结果显示,这些DEGs 主要富集于4 条信号通路,包括胰腺分泌、蛋白质消化吸收、脂肪消化吸收、甘油酯的新陈代谢信号通路(图1B,表3)。说明同属二糖的两者在脂质代谢方面确存在差异。

表3 差异基因富集的信号通路Table 3 Biological pathways of differential gene enrichment
2.2 差异基因网络分析和关键节点基因的筛选
为筛选异麦芽酮糖影响肝脏基因表达的关键节点基因,本研究采用Cytoscape 构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络[16](图2A)并利用WGCNA 进行加权基因共表达网络分析[17](图2B)共筛选到20 个节点基因。进一步取两种算法中的重叠基因,最终得到10 个关键节点基因:Pnliprp1,Pnlip,Prss2,Clps,Tff2,Ctrl,Cpa1,Cel,Dmbt1,Vil1。基因功能如表4 所示,Pnliprp1、Pnlip、Cel、Clps这4 个基因与脂肪消化吸收相关。

表4 关键节点基因的功能分析Table 4 Functional analysis of key node genes

图2 异麦芽酮糖与蔗糖组的差异基因互作网络图Fig.2 Differential gene interaction network of isomaltulose and sucrose groups
2.3 异麦芽酮糖减少小鼠肝脏脂肪堆积的关键基因的验证
构建关键节点基因的网络互作图,发现Pnliprp1、Pnlip、Cel、Clps这4 个与脂质代谢相关基因之间存在相互作用,并且富集于脂肪消化这一通路,最终确定Pnliprp1、Pnlip、Cel、Clps为影响小鼠肝脏脂质代谢的关键基因(图3A)。为验证这一结果,本研究提取空白组、异麦芽酮糖组和蔗糖组的小鼠肝脏组织RNA,逆转录后进行qPCR,结果证实了在异麦芽酮糖组中这4 个与脂肪消化相关基因的表达量均高于蔗糖组(图3B),空白组与异麦芽酮糖组之间则没有显著差异。这提示异麦芽酮糖可能通过Pnliprp1、Pnlip、Cel、Clps这4 个基因的上调促进了脂肪的分解,从而减少脂肪堆积于肝脏。通过肝脏组织切片HE 染色显示空白组(图3C)和异麦芽酮糖组(图3D)肝细胞核形态正常,细胞质均匀。蔗糖组(图3E)肝脏细胞内出现脂肪变性,可见大小不一的脂肪空泡。应用Motic Med6.0 图像软件计数每200 个肝细胞(5 个视野下)内脂肪变性细胞数目,结果显示空白组/异麦芽酮糖组/蔗糖组中脂肪变性细胞数目占比分别为4%、11%和35%。每只小鼠每日平均饲喂量为蔗糖组4.72±3.37 mL,异麦芽酮糖组4.62±2.98 mL,空白对照组4.46±2.53 mL;三组没有显著性差异(P>0.05)。三组小鼠实验期内平均日增重分别为0.282±0.036,0.234±0.058 和0.213±0.022 g,蔗糖组小鼠平均日增重显著高于异麦芽酮糖组和空白组(P<0.05),异麦芽酮糖组和空白组间平均日增重无显著差异(P>0.05),与上述肝脏切片结果相一致,表明异麦芽酮糖相比蔗糖减少了的脂肪合成。

图3 异麦芽酮糖减少小鼠肝脏脂肪堆积的关键基因的验证Fig.3 Validation of key genes of isomaltulose reducing liver fat accumulation in mice
为进一步证实上述4 个关键基因与肝脏脂肪堆积的关联,我们对从GEO 数据库下载的318 个非酒精性脂肪肝病例肝脏转录组数据进行分析,发现正常人肝脏中Pnlip、Pnliprp1、Cel、Clps基因的表达量均显著高于病例组,与预期高度相符(图4)。本研究表明,与摄入等量的蔗糖相比,食用异麦芽酮糖后肝脏中脂肪酶的表达量更高,有利于促进脂肪分解,减少了脂滴堆积于肝细胞。

图4 PNLIP、PNLIPRP1、CEL、CLPS 基因在正常人和NAFLD 患者肝脏组织中的基因表达量图Fig.4 PNLIP,PNLIPRP1,CEL,CLPS gene expression in liver tissues of normal people and NAFLD patients
3 讨论与结论
NAFLD 是指除外酒精和其他明确的损肝因素,引起的脂肪过度堆积于肝脏的一类慢性疾病[18]。在全球的患病率达到25%,已成为世界上常见的肝病[19]。研究发现,甜味剂的过量摄入显著提高了NAFLD 的发病风险[20-21],近年来,随着II 型糖尿病、肥胖症等慢性病在全球范围内的流行,NAFLD 的患病率也呈现出逐年上升的趋势[22]。
Pnlip(胰脂肪酶)是由胰腺腺泡分泌的消化膳食甘油三酯的主要酶[23],能降解膳食中50%~70%的甘油三酯[24],当Pnlip 的表达上调后,机体对膳食脂肪的消化能力显著增加[25-26],从而减少肝脏脂肪堆积。先天性胰脂肪酶缺陷是一种罕见的外分泌胰腺衰竭疾病,其主要表现为脂肪泻和消化不良[27]。Pnliprp1(胰脂肪酶相关蛋白1)是胰脂肪酶家族成员,有研究发现Pnliprp1 与卵母细胞成熟和卵黄形成相关的脂质代谢中发挥作用[28]。当敲除小鼠体内Pnliprp1基因后,小鼠表现出成熟型肥胖,肝脏内脂肪质量增加,还会产生胰岛素抵抗,提示Pnliprp1基因可能参与脂肪代谢[29]。Cel(羧基酯脂肪酶)也称为胆汁盐依赖或刺激脂肪酶,存在于所有脊椎动物体内[30],主要在胰腺腺泡细胞和哺乳期乳腺中表达,它是一种能在十二指肠中水解胆固醇酯、脂溶性维生素的分解酶[31]。当Cel基因活性受到抑制时,小鼠表现出脂肪吸收不良[32],提示Cel在脂质代谢中发挥着重要的作用。Clps(辅脂肪酶)由胰脏产生,成熟的Clps 是一种具有最小二级结构的高稳定性10 kDa 蛋白[33]。Clps是脂肪酶催化水解膳食脂质类的关键成分,虽然自身缺乏酶活性,但是它对胰腺脂肪酶的活性起促进作用[34]。
本研究通过分析GSE54723 中7 个饲喂异麦芽酮糖的小鼠肝脏组织转录组数据样本和7 个饲喂蔗糖的小鼠肝脏组织转录组数据样本,筛选出49 个DEGs,通过计算得到Pnlip、Pnliprp1、Cel、Clps为潜在的减少小鼠肝脏脂肪堆积的关键基因,随后通过qPCR 实验和非酒精脂肪肝病人肝脏组织基因表达数据中验证得到Pnlip、Pnliprp1、Cel、Clps这4 个脂肪酶确实与肝脏脂肪堆积有关。这些结果表明:与蔗糖相比,食用异麦芽酮糖后,脂肪酶的表达量更高,促进脂肪分解,减少了脂滴堆积于肝细胞。
综上所述,本研究运用生物信息学的方法筛选和验证了Pnlip、Pnliprp1、Cel和Clps为异麦芽酮糖减少小鼠肝脏脂肪堆积的关键基因,为异麦芽酮糖影响肝脏脂质代谢的分子机制研究提供了理论支撑。
