微波辅助萃取-反相液相色谱-电感耦合等离子体质谱法测定玉米中4种砷形态的含量
2022-08-16周明慧张洁琼伍燕湘王松雪
陈 曦,周明慧,张洁琼,伍燕湘,田 巍,王松雪
(国家粮食和物资储备局科学研究院,北京 100037)
准确提取样品中的所有砷形态是进行形态分析的首要条件,目前常用的提取剂为硝酸、甲醇、三氟乙酸或蛋白质提取液等[8-11]。提取方法主要包括烘箱热浸提法、微波辅助萃取法和超声提取法等[12-14]。本课题组前期研究结果显示,采用稀硝酸溶液进行提取时,稻米中不同砷形态的提取率接近100%,相对于烘箱热浸提法和超声提取法,微波辅助萃取法具有提取效率高、有利于保护砷形态间不发生转化及损失等优点[15]。在此研究基础上,本工作对前处理条件进行优化,包括提取剂浓度、提取温度和提取时间等,利用反相液相色谱-电感耦合等离子体质谱法(RPLC-ICP-MS)对玉米中4种砷形态{一甲基砷(MMA)、二甲基砷(DMA)、三价砷[As(Ⅲ)]和五价砷[As(Ⅴ)]}进行分离测定,通过优化流动相,4种砷形态可在4 min内完成测定,可为相关从业人员提供技术参考。
1 试验部分
1.1 仪器与试剂
1260型液相色谱仪;8900型电感耦合等离子体质谱仪;Topex型微波消解仪;Milli-Q 型超纯水处理系统;3-30K 型高速离心机;FE28-Standard 型pH 计;Pulverisette 14型粉碎机。
As(Ⅲ)标准溶液:75.7μg·g-1(以砷计,下同),编号为GBW 08666;As(Ⅴ)标准溶液:17.5μg·g-1,编号为GBW 08667;MMA 标准溶液:25.1μg·g-1,编号为GBW 08668;DMA 标准溶液:52.9μg·g-1,编号为GBW 08669。
混合标准储备溶液:以水为稀释剂,将各砷形态标准溶液稀释成100 mg·L-1混合标准储备溶液。
混合标准溶液系列:用流动相作稀释剂,将混合标准储备溶液逐级稀释,配制成质量浓度分别为2,5,10,20,25,50μg·L-1的混合标准溶液系列。
硝酸纯度为BV-Ш 级(金属杂质总质量分数不超过10-5%~10-3%);磷酸氢二铵、磷酸氢二钠、磷酸二氢钾、己烷磺酸钠、柠檬酸、氢氧化钠均为色谱纯;试验用水为超纯水。
侵袭性肺真菌感染(IPFI)是指真菌直接侵犯(非寄生、过敏或毒素中毒)肺或支气管引起的急、慢性组织病理损害所导致的疾病。IPFI发病率正逐年增加[1]。因其临床表现不典型,影像表现多样,常常被误诊误治。目前肺活检病理仍是诊断侵袭性肺真菌病的金标准。通过活检取得病理学资料早期、正确的指导抗真菌治疗将大大节约医疗卫生成本,改善IPFI患者的预后。近年来,CT引导下肺穿刺活检术不断成熟,该技术的发展和应用弥补了电子支气管镜活检的不足。本研究回顾性分析了我院2016年1月~2018年4月接受低剂量CT引导下经皮同轴穿刺肺活检技术的30例肺真菌病诊断病例,现总结报道如下。
1.2 仪器工作条件
1.2.1 RPLC条件
Agilent ZORBAX SB-Aq 反相色谱柱(250 mm×4.6 mm,5μm);流动相为5 mmol·L-1己烷磺酸钠-20 mmol·L-1柠檬酸的混合溶液(pH 4.3);等度洗脱;流量1.0 mL·min-1;进样量5μL。
1.2.2 ICP-MS条件
射频功率1 550 W;载气流量0.85 L·min-1;补偿气流量0.30 L·min-1;蠕动泵转速0.5 r·min-1;采样深度8 mm;氦气碰撞反应池分析模式,氦气流量4.5 mL·min-1。
1.3 试验方法
玉米样品经高速粉碎机研磨后,过孔径为0.45 mm 筛网,保存于干燥器中。取0.5 g样品,置于聚四氟乙烯消解罐中,加入0.15 mol·L-1硝酸溶液7 mL,按表1程序进行微波辅助萃取。待提取液冷却至室温,以8 000 r·min-1转速离心10 min,上清液过0.22μm 有机滤膜,滤液供RPLC-ICP-MS分析。

表1 微波辅助萃取程序Tab.1 Microwave assisted extraction procedure
2 结果与讨论
2.1 前处理条件的选择
2.1.1 提取剂浓度
综合考虑不同砷形态尤其是i As在提取液中的稳定性、与色谱分离柱的适用性、对环境和人员友好性以及提取效率等因素,本试验拟采用GB 5009.11-2014 中的稀硝酸溶液作稀释剂。以GBW(E)100380 玉米粉标准物质为待测对象,以0.15 mol·L-1硝酸溶液作提取剂,以烘箱热浸提法作为提取方法,比较了不同提取温度和提取时间下玉米中4种砷形态的提取量,结果见图1。
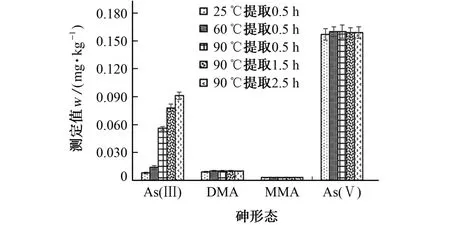
图1 0.15 mol·L-1硝酸溶液作提取剂时玉米中4种砷形态在不同条件下的提取量Fig.1 Extraction amount of the 4 arsenic species in corn under different conditions with 0.15 mol·L-1 nitric acid solution as extractant
由图1可知,在不同砷形态中,As(Ⅲ)最不易提取,需要更高的提取温度和更长的提取时间,而DMA、MMA 和As(Ⅴ)均可用0.15 mol·L-1硝酸溶液在25~90 ℃下加热0.5~2.5 h提取完全。鉴于此,参考GB 5009.11-2014,将提取温度设置为90 ℃,硝酸溶液的浓度提升至0.30 mol·L-1,并与0.15 mol·L-1时i As的提取结果进行比对,如图2所示。
由图2可知:以0.30 mol·L-1硝酸溶液提取As(Ⅲ)时,其完全提取时间(1.5 h)较0.15 mol·L-1时的(2.5 h)短,提取效率更高;以不同浓度硝酸溶液提取As(Ⅴ)时,其提取量随提取时间的延长均没有显著变化。综合图1结果可知,As(Ⅴ)易被提取,且对提取剂浓度、提取时间及温度没有依赖性。高浓度硝酸溶液对色谱柱的柱效影响较为显著,因此试验选择以0.15 mol·L-1硝酸溶液作为玉米样品中不同砷形态的提取剂。
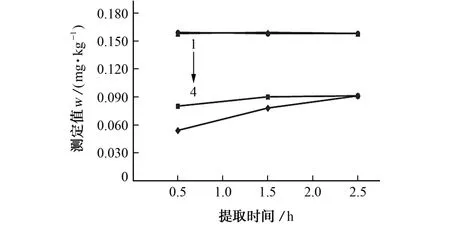
图2 不同浓度硝酸溶液下玉米中iAs的提取量Fig.2 Extraction amount of iAs in corn under different concentrations of nitric acid solution
2.1.2 微波辅助萃取条件
鉴于微波辅助萃取法提取时间更短,同时也是国际上广泛采用的检测iAs的前处理方法,因此试验也以此方法处理玉米。以0.15 mol·L-1硝酸溶液作提取剂,试验先参考文献[15],以稻米的微波辅助萃取程序(表2)处理GBW(E)100380玉米粉标准物质。
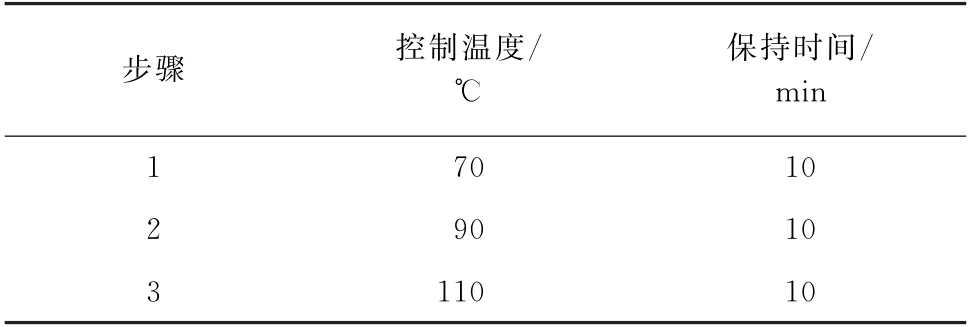
表2 微波辅助萃取程序[15]Tab.2 Microwave assisted extraction procedure[15]
结果显示,MMA、DMA、As(Ⅲ)和As(Ⅴ)的提取量为0.003,0.009,0.062,0.151 mg·kg-1,总砷值为0.225 mg·kg-1,显著低于标准物质的认定值[(0.277±0.023)mg·kg-1],说明以稻米的萃取程序提取时,玉米样品中各砷形态提取不完全,这可能与As(Ⅲ)未被完全提取有关。结合文献研究可知,As(Ⅲ)易与蛋白质和淀粉结合[16],而玉米中的蛋白质含量普遍高于大米[17-18]。鉴于高温可破坏蛋白质的空间结构,使As(Ⅲ)完全释放,试验尝试适当提高提取温度和延长提取时间,优化得到的微波辅助萃取程序见表1。以此条件处理GBW(E)100380玉米粉标准物质,MMA、DMA、As(Ⅲ)和As(Ⅴ)的提取量为0.004,0.011,0.096,0.150 mg·kg-1,总砷值为0.261 mg·kg-1,在标准物质认定值的不确定度范围内。因此,试验选择以表1的微波辅助萃取程序提取玉米样品中的4种砷形态。
2.2 色谱条件的选择
目前,粮食行业主要采用Hamilton 阴离子交换柱作固定相,采用15 mmol·L-1磷酸二氢铵溶液或磷酸氢二铵溶液等单一磷酸盐溶液作流动相进行色谱分离,而以此条件分析10μg·L-1混合标准溶液时,所需分离时间近10 min,如图3(a)所示。为节省分析时间,试验曾参考仪器生产商建议的12 mmol·L-1磷酸氢二钠-44 mmol·L-1磷酸二氢钾混合溶液作流动相,所得10μg·L-1混合标准溶液的色谱图如图3(b)所示,此时4种砷形态的分离时间可缩短至约8 min,但该流动相对As(Ⅲ)的洗脱能力明显弱于单一磷酸盐溶液的,且其盐含量较大,对色谱柱的柱效以及仪器管路的清洁均有不利影响,故不予考虑。
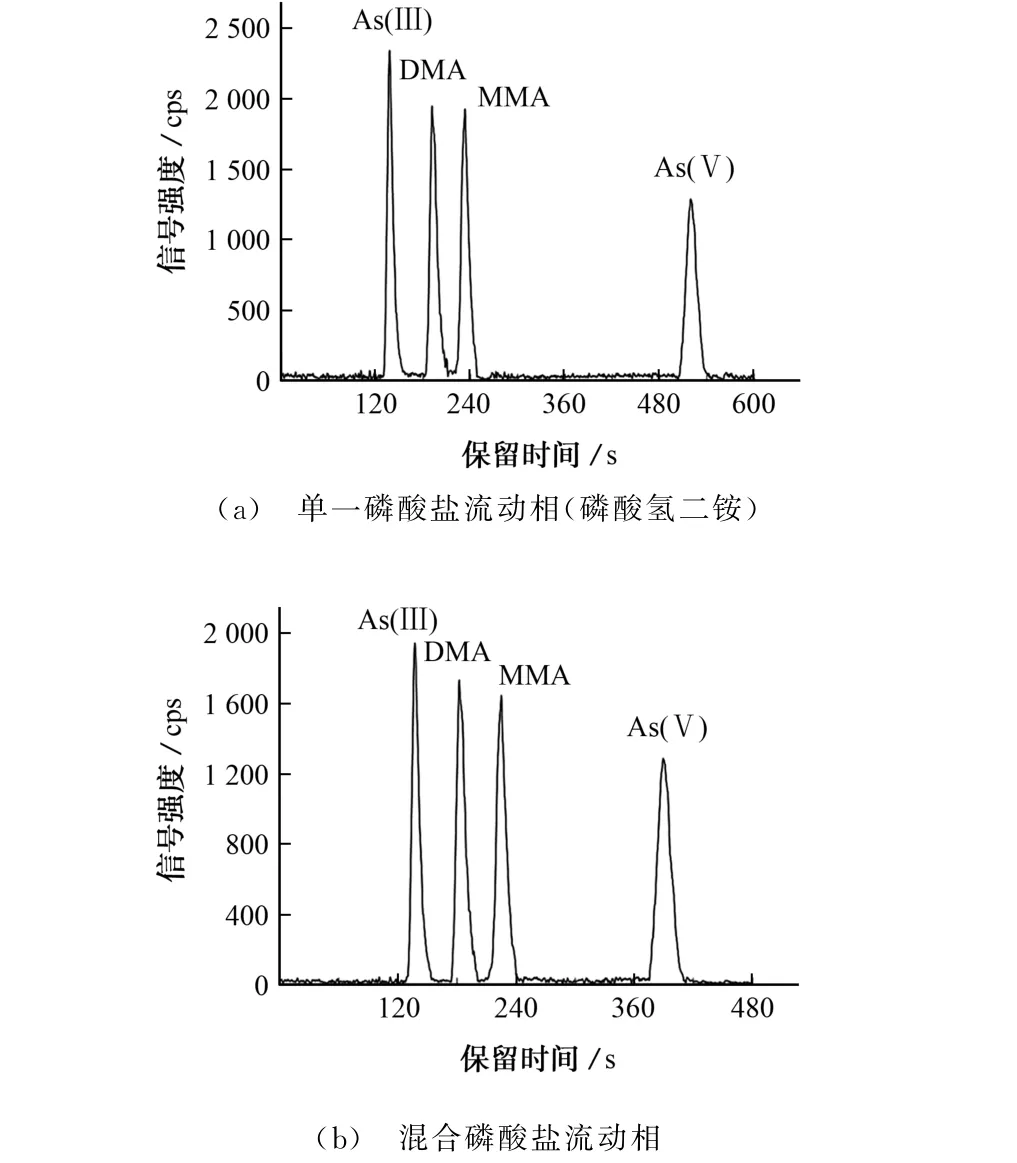
图3 分别采用单一和混合磷酸盐溶液作流动相时混合标准溶液的色谱图Fig.3 Chromatograms of the mixed standard solution with single and mixed phosphate solutions as mobile phase
GB 5009.11-2014中第二篇第二法给出的流动相为10 mmol·L-1无水乙酸钠、3 mmol·L-1硝酸钾、10 mmol·L-1磷酸二氢钠和0.2 mmol·L-1乙二胺四乙酸二钠的混合溶液(pH 10),试验以此流动相分离玉米中的砷形态,并通过以下质控方法对该流动相的长期使用效果进行考察。即开始时每测5个样品分析1次混合标准溶液,在分析10个样品后,每测10个样品分析1次混合标准溶液,分析60个样品后,所得各砷形态信号强度占第1次分析时信号强度的比值(信号响应率)见图4。

图4 玉米中4种砷形态信号响应率随样品数量的变化曲线Fig.4 Variation curves of signal response rate of the 4 arsenic species in corn with sample number
由图4可知,信号响应率随样品数量的增加不断下降,在分析60个样品后,混合标准溶液中各砷形态的信号响应率仅约60%,这是由于流动相中钠盐和钾盐会沉积在电感耦合等离子体质谱仪的关键配件,如样品截取锥和采样锥上,导致仪器的检测灵敏度下降,方法的精确度变低。
为解决以上问题,本课题组经过充分的文献调研,以 Agilent ZORBAX SB-Aq 反相色谱柱(250 mm×4.6mm,5μm)作固定相,以5 mmol·L-1己烷磺酸钠-20 mmol·L-1柠檬酸的混合溶液(pH 4.3)为流动相,以1.0 mL·min-1流量进行等度洗脱。在此条件下,10μg·L-1混合标准溶液的色谱图见图5。

图5 优化的色谱条件下混合标准溶液的色谱图Fig.5 Chromatogram of the mixed standard solution under optimized chromatographic conditions
结果表明:4种砷形态可在4 min内实现完全分离,出峰时间仅为国家标准方法[19]的1/2,极大地提高了检测效率;As(Ⅴ)、MMA 和DMA 的信号强度明显高于以单一和混合磷酸盐溶液为流动相时的,且流动相仅会引入少量钠盐,可保持样品进样系统的洁净度,维持测定结果的稳定;Agilent ZORBAX SB-Aq反相色谱柱价格低廉,对酸溶液具有较好的适用性。综上,可采用上述流动相分析实际样品中的4种砷形态。
2.3 标准曲线和检出限
按照仪器工作条件测定混合标准溶液系列,以4种砷形态的质量浓度为横坐标,其对应的信号强度为纵坐标绘制标准曲线。结果显示,4种砷形态标准曲线的线性范围均为2~50μg·L-1,线性回归方程和相关系数见表3。
以3倍信噪比(S/N)计算检出限(3S/N),结果见表3。
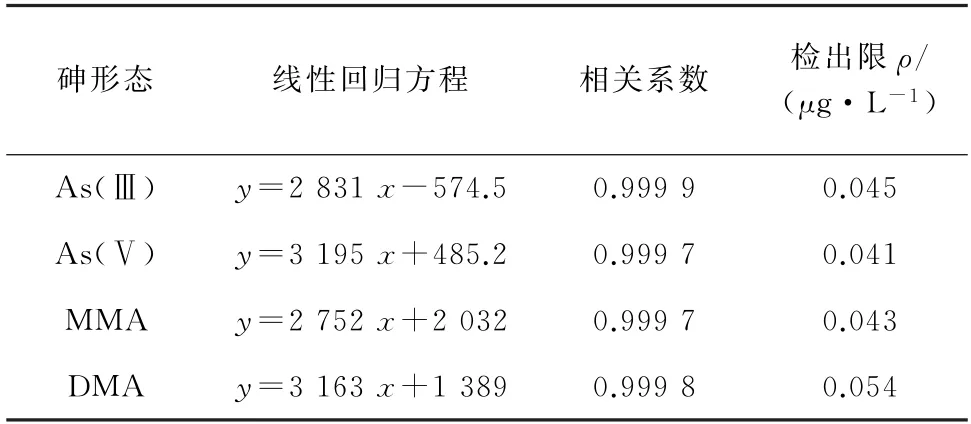
表3 线性回归方程、相关系数和检出限Tab.3 Linear regression equations,correlation coefficients and detection limits
由表3可知,4种砷形态标准曲线的线性关系较好,检出限为0.041~0.054μg·L-1。
2.4 精密度和回收试验
按照试验方法对空白玉米样品进行3个浓度水平的加标回收试验,每个浓度水平进行6次平行测定,计算回收率和测定值的相对标准偏差(RSD),结果见表4。
由表4可知,4种砷形态的回收率为94.2%~102%,测定值的RSD 小于3.0%,方法准确度和精密度均符合检测要求。

表4 精密度和回收试验结果(n=6)Tab.4 Results of tests for precision and recovery(n=6)
2.5 样品分析
按照试验方法分析天然污染玉米样品,并将总砷值与标准方法GB 5009.11-2014的进行比对,结果见表5。

表5 样品分析结果Tab.5 Analytical results of the samples mg·kg-1
结果显示:天然污染玉米样品中不同砷形态的含量差异较大,iAs含量占总砷值的比例较高,有机砷的含量极低;所测样品中总砷值与标准方法中所得的总砷值基本一致,进一步证实了本方法的准确度。
本工作通过优化提取剂浓度、微波辅助萃取温度和时间、色谱条件等,以RPLC-ICP-MS测定玉米中4种砷形态的含量,提高了玉米中不同砷形态的检测效率和精确度。方法的检出限、回收率和精密度均满足行业检测需求,通过对实际污染样品的测定,进一步验证了方法的准确度和适用性,可为玉米中不同砷形态的高通量快速测定提供有价值的参考依据。
