混合型离子交换反相吸附固相萃取柱串联萃取-超高效液相色谱-串联质谱法测定地表水中32种抗生素的含量
2022-08-16张蓓蓓孙慧婧
张蓓蓓,孙慧婧,吉 鑫
(江苏省环境监测中心 国家环境保护地表水环境有机污染物监测分析重点实验室,南京 210036)
抗生素可用于人和动物相关疾病的治疗,在人类社会及畜禽养殖业中应用广泛,已成为一种新型环境污染物,被国内外社会关注。目前,抗生素在水体中的污染已经相当普遍,国内外各地区养殖业废水[1-4]、生活污水[5-8]、地表水[9-13]、地下水[14-15]及饮用水[16-17]中均有一定检出,检出抗生素种类主要包括四环素、磺胺、大环内酯、喹诺酮、β-内酰胺、林可酰胺等6类,其在除废水外的水体中的检出浓度水平为ng·L-1级,属于痕量污染水平,而在废水中的检出浓度水平在μg·L-1级到mg·L-1级内,属于微量污染水平。
当前,我国环境行业尚未制定针对抗生素的环境质量标准和污染排放标准,仅在GB 8978-1996《污水综合排放标准》和GB 21903-2008《发酵类制药工业水污染物排放标准》中规定了部分抗生素的单位产品基准排水量限值。测定方法的相关标准为SZDB/Z 323-2018《水产品养殖水中21种磺胺类、氯霉素类、四环素类、硝基呋喃类、喹诺酮类和孔雀石绿的测定 高效液相色谱-串联质谱法》和DB 37/T 3738-2019《水质 磺胺类、喹诺酮类和大环内酯类抗生素的测定 固相萃取/液相色谱-三重四极杆质谱法》,且以上地方标准不涉及林可酰胺类和β-内酰胺类抗生素的测定。
液相色谱-三重四极杆串联质谱法是测定抗生素含量较为成熟的方法,但由于抗生素种类繁多、化学性质差异较大,难以在测定前用统一的前处理方法完成所有类别抗生素的萃取。如在酸度上,磺胺类、喹诺酮类和四环素类抗生素为两性化合物,大环内酯类和林可酰胺类抗生素为弱碱性化合物,β-内酰胺类抗生素为弱酸性化合物;在稳定性上,四环素类、大环内酯类和β-内酰胺类抗生素在强酸或强碱性环境中均不稳定;在极性上,喹诺酮类、磺胺类和四环素类抗生素极性较大,当前尚未发现较为全面萃取水体中抗生素的前处理方法。
鉴于此,本工作以混合型阳离子交换反相吸附固相萃取柱(MCX 小柱,主要用于富集水样中磺胺类、喹诺酮类、林可酰胺类、β-内酰胺类抗生素)和混合型阴离子交换反相吸附固相萃取柱(MAX 小柱,主要用于富集水样中大环内酯类和四环素类抗生素)串联的固相萃取柱萃取水样,以超高效液相色谱-串联质谱法测定水样中6类32种抗生素[16种磺胺类抗生素(磺胺乙酰、磺胺二甲异嘧啶、磺胺嘧啶、磺胺噻唑、磺胺吡啶、磺胺甲基嘧啶、磺胺对甲氧嘧啶、磺胺甲噻二唑、磺胺二甲嘧啶、磺胺氯哒嗪、磺胺甲恶唑、磺胺间甲氧嘧啶、磺胺异噁唑、磺胺氯吡嗪、磺胺间二甲氧嘧啶、磺胺喹噁啉)、3种喹诺酮类抗生素(氧氟沙星、诺氟沙星、洛美沙星)、2种大环内酯类抗生素(罗红霉素、克拉霉素)、4种四环素类抗生素(土霉素、金霉素、多西环素、四环素)、2种林可酰胺类抗生素(林可霉素、克林霉素)、5种β-内酰胺类抗生素(头孢唑啉、头孢噻肟、头孢克洛、头孢西丁、头孢匹林)]的含量,方法所需水样少、快速、准确、灵敏,可为水体中抗生素污染水平的全面评估提供技术参考。
1 试验部分
1.1 仪器与试剂
API 6500型超高效液相色谱/串联质谱仪,配Analyst Software 1.7.1工作站;SPE 900型全自动固相萃取仪,HLB 固相萃取柱(500 mg/6 mL),MCX 小 柱(500 mg/6 mL),MAX 小 柱(500 mg/6 mL);Turbo Vap II型全自动定量浓缩仪;MILLIPORE RIOS 30型纯水机;AG104型电子天平。
32种抗生素及内标物磺胺甲基嘧啶-d4、磺胺甲恶唑-d4、氧氟沙星-d3、诺氟沙星-d5、罗红霉素-d7、四环素-d6、头孢氨苄-d5的单标准储备溶液:100 mg·L-1。
混合标准使用液:1.0 mg·L-1,取32 种抗生素的单标准储备溶液适量,用乙腈稀释,混匀备用。其他混合标准溶液均由此溶液用50%(体积分数,下同)乙腈溶液逐级稀释制备。
混合内标使用液:4.0 mg·L-1,取7种内标物的单标准储备溶液适量,用乙腈稀释,混匀备用。其他混合内标溶液均由此溶液用50%乙腈溶液逐级稀释制备。
乙二胺四乙酸二钠、氨水为分析纯;甲醇、乙腈、甲酸均为色谱纯;试验用水为自制纯化水。
1.2 仪器工作条件
1.2.1 色谱条件
BEH C18色谱柱(100 mm×2.1 mm,1.7μm);柱温40℃;进样量2μL;流动相A 为0.1%(体积分数,下同)甲酸溶液,B 为乙腈;流量0.4 mL·min-1。梯度洗脱程序:0 min,A 为95%,保持2 min;2~10 min,A 由95% 降 至30%;10~13 min,A 由30%降至10%,保持1 min;14~15 min,A 由10%升至95%。
1.2.2 质谱条件
电喷雾离子源正离子(ESI+)模式;离子化电压5 500 V;离子源温度250 ℃;喷雾气压力3.45×105Pa,辅助加热气压力3.45×105Pa,气帘气压力1.38×105Pa,碰撞气压力0.62×105Pa;监测驻留时间0.03 s;多反应监测(MRM)模式;其他质谱参数见表1,其中“*”为定量离子。

表1 质谱参数Tab.1 MS parameters
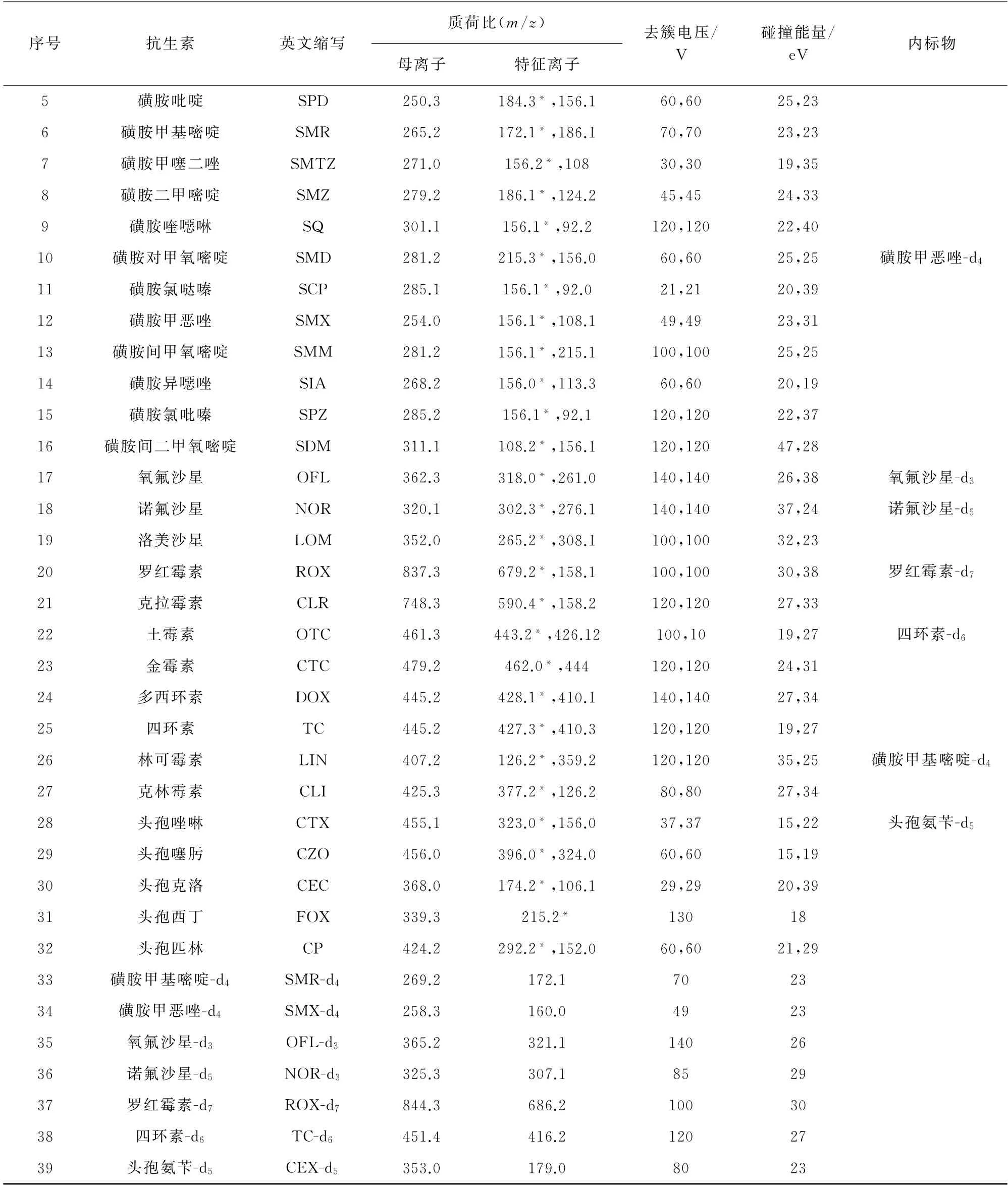
表1 (续)
1.3 试验方法
将MCX 小柱与 MAX 小柱串联,依次用10 mL甲醇、10 mL 水活化,期间保证2 根小柱柱头浸润。500 mL地表水样经0.45μm 滤膜过滤后,加入0.4 g乙二胺四乙酸二钠,以约2 mL·min-1上样速率过柱。上样完毕后,将2 根小柱分开。MCX 小柱先用2%(体积分数,下同)甲酸溶液10 mL淋洗,以去除柱中保留较弱的杂质,再用氮气吹扫30 min,以去除柱中残留的水分,然后依次用甲醇4 mL、含5%(体积分数,下同)氨水的甲醇溶液4 mL洗脱,收集并合并洗脱液。MAX 小柱先用5%氨水溶液10 mL淋洗,再用氮气吹扫30 min,然后依次用甲醇4 mL、含2%甲酸的甲醇溶液4 mL洗脱,收集并合并洗脱液。合并两个小柱的洗脱液,氮吹至尽干,用50% 乙腈溶液稀释至1.0 mL,加入混合内标使用液5.0μL,使溶液中内标物质量浓度达到20.0 μg·L-1,混匀后过0.22μm 滤膜,滤液置于进样瓶中,按照仪器工作条件测定。
2 结果与讨论
2.1 固相萃取柱的选择
常用HLB固相萃取柱萃取水体中不同种类的抗生素,而本工作涉及的待测抗生素酸性不同,在水中的电离程度不同。为获得较好的萃取效率,需要调节水样酸度,使目标抗生素处于分子状态。调节加标水样(加标量为20 ng·L-1)的酸度分别达到pH 4,7,10,考察了不同酸度水样对各抗生素回收率的影响,结果见图1。
由图1可知,不同种类抗生素在不同酸度水样中的回收率相差较大。其中,磺胺类抗生素在酸度为pH 4,7、喹诺酮类和林可酰胺类抗生素在酸度为pH 10、四环素类抗生素在酸度为pH 4、β-内酰胺类抗生素在酸度为pH 7时,分别具有较好的回收率,说明试验无法在同一酸度条件下完成32种抗生素的同时萃取,需要分3 次进行不同种类抗生素的萃取。

图1 采用HLB固相萃取柱萃取时不同酸度加标水样中32种抗生素的回收率Fig.1 Recoveries of the 32 antibiotics in spiked water samples with different acidity during extraction with HLB solid phase extraction column
同时,32种抗生素化学性质及极性差异较大,调节水样酸度可能导致大环内酯类、β-内酰胺类等化学性质不稳定的抗生素降解。考虑到混合型离子交换反相吸附固相萃取柱同时具有离子交换和反相吸附的作用,试验考察了分别采用MCX 小柱和MAX 小柱萃取时对加标水样中32 种抗生素回收率的影响,结果见图2。

图2 用MAX 小柱和MCX 小柱萃取时加标水样中32种抗生素的回收率Fig.2 Recoveries of the 32 antibiotics in spiked water samples during extraction with the MAX cartridge and the MCX cartridge
由图2可知:采用MCX 小柱萃取时,磺胺类、喹诺酮类、林可酰胺类和β-内酰胺类抗生素回收率较高;采用MAX 小柱萃取时,大环内酯类和四环素类抗生素回收率较高。因此,试验选择将MCX 小柱和MAX 小柱串联,用于水样中32种抗生素的同时萃取。
2.2 上样速率的选择
当采用混合型离子交换反相吸附固相萃取柱萃取水体中抗生素时,发现上样速率对回收率具有较大影响。因此,试验比较了上样速率分别为2,5,10 mL·min-1时各抗生素回收率的变化。结果显示,各抗生素的回收率随上样速率的增加而降低,推测上样速率过快,不利于吸附剂和待测物的充分交换和结合,从而导致待测物穿透,回收率降低。因此,试验选择的上样速率为2 mL·min-1。
2.3 质谱条件的选择
采用流动注射泵连续进样,对32种抗生素的质谱条件进行优化。由于抗生素具有一定极性,选择电喷雾离子源进行电离,并比较了正、负离子模式下的扫描结果。结果显示,32种抗生素在正离子模式下有更好的响应,基峰均为[M+H]+。选定[M+H]+为母离子,进行二级质谱扫描,寻找子离子碎片,确定特征离子,并进一步优化各抗生素的去簇电压、碰撞能量等质谱参数,详见表1。
在优化的试验条件下,含20.0μg·L-1内标的50.0μg·L-1混合标准溶液的MRM 色谱图见图3。

图3 含内标物的混合标准溶液的MRM 色谱图Fig.3 MRM chromatograms of the mixed standard solution containing internal standard substances
由图3 可知,32 种抗生素和7 种内标物在ESI+模式下均有很好的响应,能够满足试验定量分析要求。
2.4 标准曲线、检出限和测定下限
用50%乙腈溶液将混合标准使用液逐级稀释成1.0,2.0,5.0,10.0,20.0,50.0μg·L-1的混合标准溶液系列(7 种内标物质量浓度均为20.0μg·L-1),按照仪器工作条件测定,以各抗生素质量浓度为横坐标,其对应的峰面积与内标物峰面积的比值为纵坐标绘制标准曲线。结果显示,各抗生素标准曲线的线性范围为1.0~50.0μg·L-1,线性回归方程和相关系数见表2。
参考HJ/T 168-2020《环境监测分析方法标准制订技术导则》,分析7 个加标水样(加标量4.0 ng·L-1),以3 倍标准偏差(s)计算检出限(3s),以4倍检出限计算测定下限,结果见表2。

表2 线性参数、检出限和测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination

表2 (续)
由表2 可知,32 种抗生素的检出限为0.3~1.4 ng·L-1,灵敏度高,满足地表水中抗生素的分析要求。
2.5 精密度和回收试验
按照试验方法分析加标量为5.0,20.0,80.0 ng·L-1等3个浓度水平的加标地表水样品,每个浓度水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
由表3 可知:32 种抗生素测定值的RSD 为1.3%~17%;32种抗生素的回收率为48.5%~93.4%,6类抗生素回收率大多在70.0%以上,虽然部分喹诺酮类抗生素低浓度水平加标样品的回收率较低(约50.0%),但其测定值的RSD 较低,依然符合痕量分析的要求。

表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
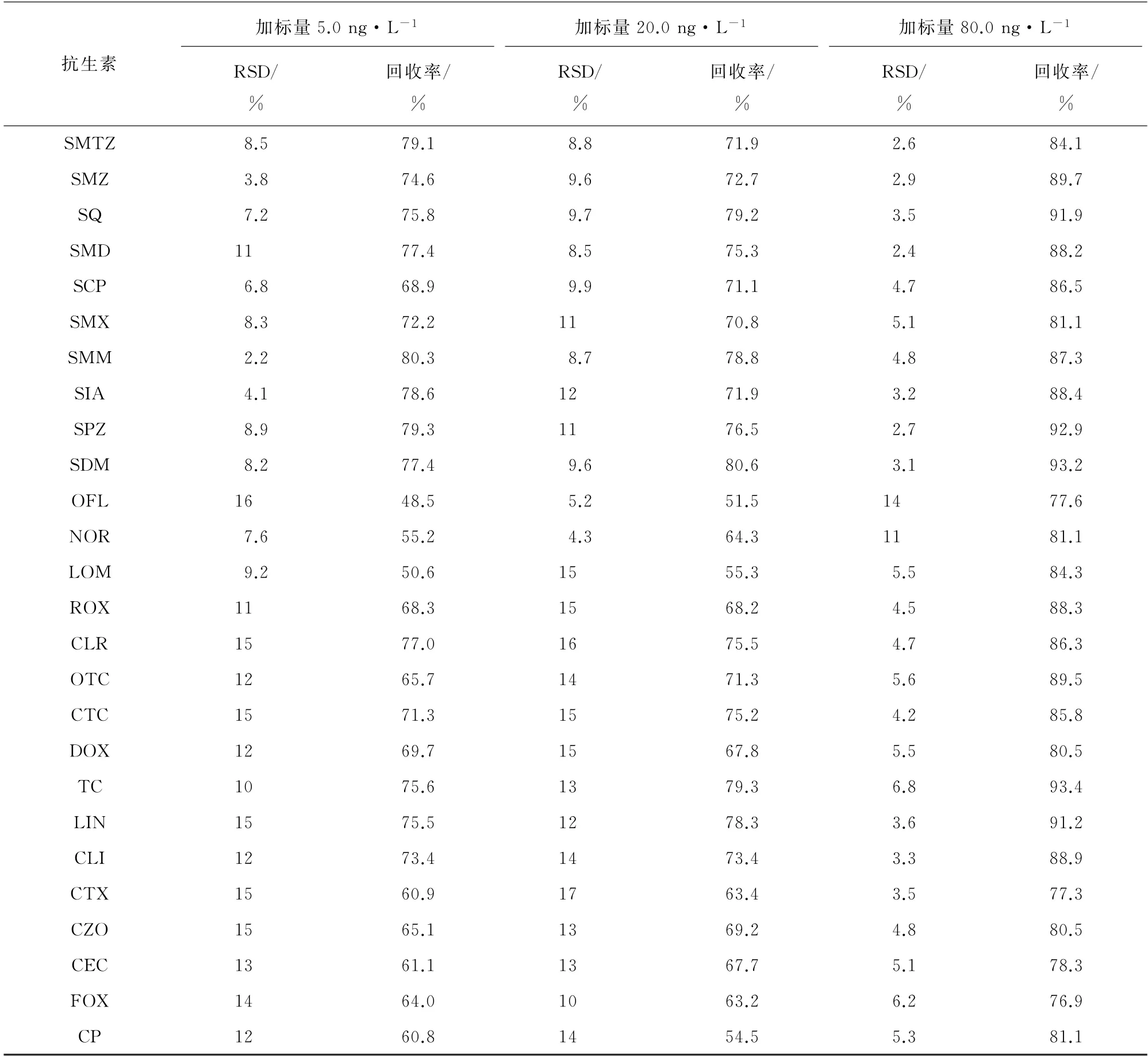
表3 (续)
2.6 样品分析
应用本方法测定太湖流域8 个饮用水源地监测点位水体中32 种抗生素的含量,检出结果见表4。

表4 样品分析结果Tab.4 Analytical results of the samples

表4 (续)
由表4可知,太湖流域饮用水源地水体中抗生素污染较为普遍,磺胺甲恶唑、磺胺间甲氧嘧啶、林可霉素、克林霉素、克拉霉素和诺氟沙星均有不同程度检出,其中林可霉素检出量最大,为33.9 ng·L-1,属于痕量污染水平。
本工作以混合型离子交换反相吸附固相萃取柱串联萃取-超高效液相色谱-串联质谱法同时测定地表水中32种抗生素的含量,方法具有操作简便、灵敏度高、准确度高和精密度好等特点,适合大批量地表水样的分析。
