云南牛血液标本中哺乳动物正呼肠孤病毒(YNSZ/V207/2017)的分离鉴定
2022-08-09李占鸿李卓然宋子昂谢佳芮杨振兴李华春廖德芳
李占鸿,肖 雷,李卓然,宋子昂,谢佳芮,杨振兴,朱 沛,李华春,廖德芳,杨 恒, 3
哺乳动物正呼肠孤病毒(Mammalian orthoreovirus, MRV)隶属呼肠病毒科(Reoviridae)棘突呼肠病毒亚科(Spinareovirinae),可感染包括人、猪、牛、羊、猫、犬、猴、水貂、小鼠与蝙蝠在内的多种哺乳动物[1-2]。过去认为MRV仅对啮齿类动物具有较强的致病性,近年大量的研究显示MRV在人与其它哺乳动物上均表现出了较强的致病性,可引起腹泻、肠炎、肺炎或脑炎等症状[3-7]。在蝙蝠上多次分离到基因重配MRV变异毒株,提示该病毒可通过蝙蝠在不同动物之间进行传播[8-10],进而对公共卫生安全构成严重的威胁,是一种值得重视的人兽共患病病原。
MRV病毒粒子直径约85 nm,呈二十面体对称,基因组大小约23 kb,包含10个节段的双链RNA(double strand RAN, dsRNA),分别为L1至L3基因节段(3.8~3.9 kb)、M1至M3基因节段(2.2~2.3 kb)、S1至S4基因节段(1.1~1.4 kb)[1-2]。MRV病毒粒子具有双层衣壳结构:外层衣壳由M2、S1与S4节段编码的μ1、σ1与σ3蛋白构成;内层衣壳由L1至L3基因节段编码的λ3至λ1蛋白,M1与S2基因节段编码的μ2蛋白与σ2蛋白等5种蛋白组成。μNS、σ1S与σNS等3种非结构蛋白由M3、S1(重叠基因)与S3节段编码[1-2]。MRV的S1基因节段高度变异,编码的α1蛋白可与细胞表面受体结合,具有凝集红细胞的特性,决定病毒的血清型。通过血清中和实验与血凝抑制试验可将MRV分为MRV-1、MRV-2、MRV-3、MRV-4 4种血清型,其代表毒株分别为Lang-T1L(MRV-1)、Jones-T2J(MRV-2)、Dearing-T3D(MRV-3)与Ndelle-T4N(MRV-4)[1,11]。
我国已发现3种血清型MRV(MRV-1、MRV-2、MRV-3)的流行[7,12-13],其中MRV-1型在我国南方与北方均有流行,可引起感染动物出现腹泻症状。2011年河北省饶阳县的水貂(Mustlavison)中暴发MRV-1型感染导致的病毒性腹泻,病死率高达100%[7];随后在黑龙江省出现腹泻症状的仔猪,云南省发生腹泻死亡的野生树鼩(Tupaiabelangeri)中均分离出MRV-1型毒株[14-15],表明我国流行的MRV-1型毒株可感染家养与野生动物,具有较强的致病性。在我国南方地区的短鼻果蝠(Cynopterussphinx)、鼠耳蝠(Myotisricketti)与普氏蹄蝠(Hipposiderospratti)中分离出基因重配MRV-1型毒株[16-17],进一步提示MRV-1可通过蝙蝠在野生动物和家畜之间进行扩散。因此,掌握我国MRV-1的遗传背景、致病性与流行病学特征在动物疫病防控与保障公共卫生安全上具有重要的意义。
2017年本实验室在云南省师宗县设立哨兵牛(Sentinel cattle),定期采血进行动物病毒的监测与分离,从采集的动物血液样本中,相继分离出蓝舌病病毒(Bluetongue virus, BTV)、帕利亚姆病毒(Palyam virus, PALV)、动物流行性出血病病毒(Epizootic haemorrhagic disease virus, EHDV)和MRV-1型病毒。本文对MRV-1型分离株的全基因组测序与序列分析,对当地牛、羊与猪中的MRV-1的流行情况进行了初步调查,为进行我国MRV毒株的遗传多样性分析、相应诊断方法的建立及其致病性研究等奠定了基础。
1 材料与方法
1.1 细胞与主要试剂 幼仓鼠肾细胞(Baby hamster syrian kidney, BHK-21)保存于本实验。胎牛血清与MEM培养基购自美国Gbico公司;核酸提取试剂、高纯度琼脂糖、反转录酶、核糖核酸酶S1、高保真Taq DNA聚合酶、一步法PCR试剂盒和DNA纯化试剂盒均购自大连宝生物公司;DNA文库构建试剂盒TruSeq DNA Sample Prep Kit V2.0购自美国Illumina公司。
1.2 哨兵动物与血液样本的采集 2017年5月,在云南省师宗县五龙乡(经纬度:E103°59′38″,N24°36′41″,海拔 1 000 m)设置10头1周岁且BTV与EHDV抗体及核酸检测均为阴性的云南黄牛(Bostaurusdomesticus),作为病毒监测的哨兵动物。哨兵动物不使用任何疫苗与驱虫药物,饲养方式为自由放牧。在监控期的5月至10月,由当地职业兽医每周从哨兵牛上分别采集全血、肝素钠抗凝血与EDTA抗凝血样品,保存于4 ℃ 冰盒,送至病毒检测及分离实验室:云南省热带亚热带动物病毒重点实验室。
1.3 血液样本中病毒的分离 取500 μL采集至哨兵牛的肝素钠抗凝血,离心收集红细胞(Red blood cells, RBCs),以磷酸盐缓冲液(Phosphate buffer saline, PBS)洗涤RBCs 1次。加入灭菌水裂解RBCs,离心取上清接种生长为单层的BHK-21细胞,盲传3~5代进行病毒分离。当感染细胞出现规律的细胞病变(Cytopathic effect, CPE)后,离心收集细胞上清-80 ℃冻存,留待进一步的鉴定。
1.4 分离物的RT-PCR鉴定 使用病毒核酸提取试剂盒进行待鉴定样品的核酸提取,于95 ℃变性3 min,立即冰浴。取4 μL变性核酸为模板,以针对BTV、EHDV、PALV和阿卡斑病毒(Akabane virus, AKAV)的特异性引物[18-20]按一步法RT-PCR试剂盒说明书配制反应液,进行RT-PCR鉴定,反应条件如下:50 ℃逆转录30 min;94 ℃预变性 2 min;94 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸1 min,共进行30个循环。反应完成后,对扩增产物进行电泳胶回收,并进行测序与序列分析。
1.5 病毒基因组dsRNA的提取与电泳检测 将待鉴定病毒接种75 cm2细胞瓶中生长为单层的BHK-21细胞,待感染细胞出现完全CPE时收集病变细胞,根据RNA提取试剂说明书提取细胞总RNA;使用S1核糖核酸酶按文献报道的方法[21]降解宿主细胞RNA。以2%的高纯度琼脂糖凝胶进行电泳检测,观察病毒基因组的电泳带型特征。
1.6 病毒的电镜观察 取培养的病毒液,8 000 r/min离心10 min,将离心后的上清转入超速离心管中,以SW40转头,以40 000 r/min的转速在Beckman超速离心机上离心3 h。将离心后的沉淀以适量TNE Buffer重悬,置于4 ℃过夜。次日将病毒液12 000 r/min离心5 min,取上清滴于铜网上,以2%磷钨酸溶液(pH6.8)进行负染,在透射电镜下观察病毒粒子的形态。
1.7 病毒基因组cDNA的合成与PCR扩增 取纯化后病毒基因组dsRNA为模板,采用全长cDNA扩增(Full-length amplification of cDNAs, FLAC)技术[21]进行病毒基因组cDNA的合成。以合成的cDNA为模板,使用高保真DNA Taq酶扩增病毒基因组,扩增程序如下:94 ℃预变性3 min;94 ℃变性30 s,60 ℃复性30 s,68 ℃延伸4 min,35个循环。反应结束后,取5 μL扩增产物进行电泳检测,分析病毒基因组扩增产物的完整性。
1.8 病毒基因组的高通量测序 使用DNA纯化试剂盒纯化病毒基因组PCR扩增产物,使用Illumina公司的TruSeq DNA Sample Prep Kit DNA文库构建试剂盒进行DNA文库构建,进一步在Illumina Novaseq 6000测序平台上进行高通量测序(High-throughput sequencing, HTS)。使用Trimmomatic软件对获取的数据进行质量控制与滤过处理,使用Edena(v3.131028)[22]与SOAPdenovo(v2.04)软件[23]对滤过后的reads进行组装以获取病毒基因组序列。
1.9 序列分析与系统发育树的构建 使用NCBI的ORF分析软件(https://www.ncbi.nlm.nih.gov/orffinder/)分析病毒各基因编码的蛋白。从GenBank数据库下载MRV毒株的序列,通过Mafft-win序列[24]比对软件与本研究中获取的病毒序列进行比对,使用BioEdit计算核酸与氨基序列相似度(nt/aa),采用MEGA X软件[25]以邻近法(Neighbor-joining, NJ)构建系统发育树,选择的模型为遗传距离法(P-distance),自举检验值(Bootstrap)取1 000。
1.10 血清中和试验 取2016至2017年在云南省师宗县牛、羊与猪等家畜上采集的血清各40份,56 ℃处理30 min,进行血清中和试验(Serum neutralization test, SNT)检测MRV-1抗体,方法简述如下:在BHK-21细胞上以Karber法[26]测定YNSZ/V207/2017毒株的TCID50,稀释至100 TCID50备用。将1∶16倍的待检血清稀释加入96孔细胞培养板(50 μL/孔),加入100 TICD50的病毒悬液(50 μL/孔),充分混匀后于37 ℃作用2 h。以100 μL/孔的量加入BHK-21细胞悬液,将细胞板置于37 ℃培养7 d,逐日观察CPE,并计算抗体效价,以抗体效价<1∶16判定为MRV感染阴性,抗体效价≥1∶16判定为MRV感染阳性。
2 结 果
2.1 病毒的分离与鉴定 2017年5月至10月,师宗县设立的哨兵牛上共采集200份肝素钠抗凝血,分别接种BHK-21细胞,共获得8份可在BHK-21细胞上导致CPE的病毒分离物;经RT-PCR与测序鉴定,其中PALV 3株、BTV与EHDV各2株(表1);其中4号哨兵牛8月21日采集的血液样本接种BHK-21细胞盲传4代后,可致细胞出现“皱缩、聚集与脱落”的细胞病变(图1)。提取病变细胞总RNA,进行BTV、EHDV、AKAV与PALV鉴定的结果均为阴性,将待鉴定的病毒命名为YNSZ/V207/2017。
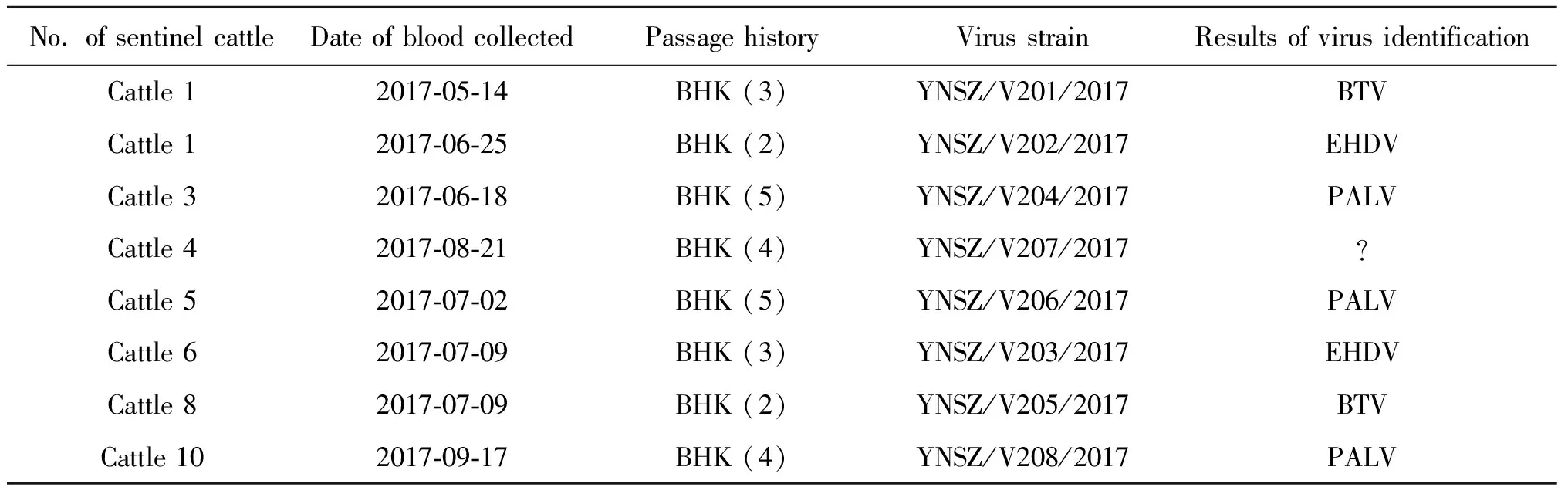
表1 2017年师宗县哨兵牛血液中分离的病毒

A为YNSZ/V207/2017在BHK-21细胞引起的细胞病变;B为正常BHK-21对照细胞
2.2 YNSZ/V207/2017毒株的基因组电泳与电镜观察结果 琼脂糖凝胶电泳结果显示,YNSZ/V207/2017病毒基因组为dsRNA,但在琼脂糖凝胶上的迁移特征与本研究中分离的BTV、PALV及EHDV等存在明显差异(图2A)。电镜下观察可见YNSZ/V207/2017的病毒粒子直径约70~80 nm,呈二十面体对称的球形结构,与文献[1-2]报道的呼肠孤病毒科病毒粒子的外形特征类似(图3)。
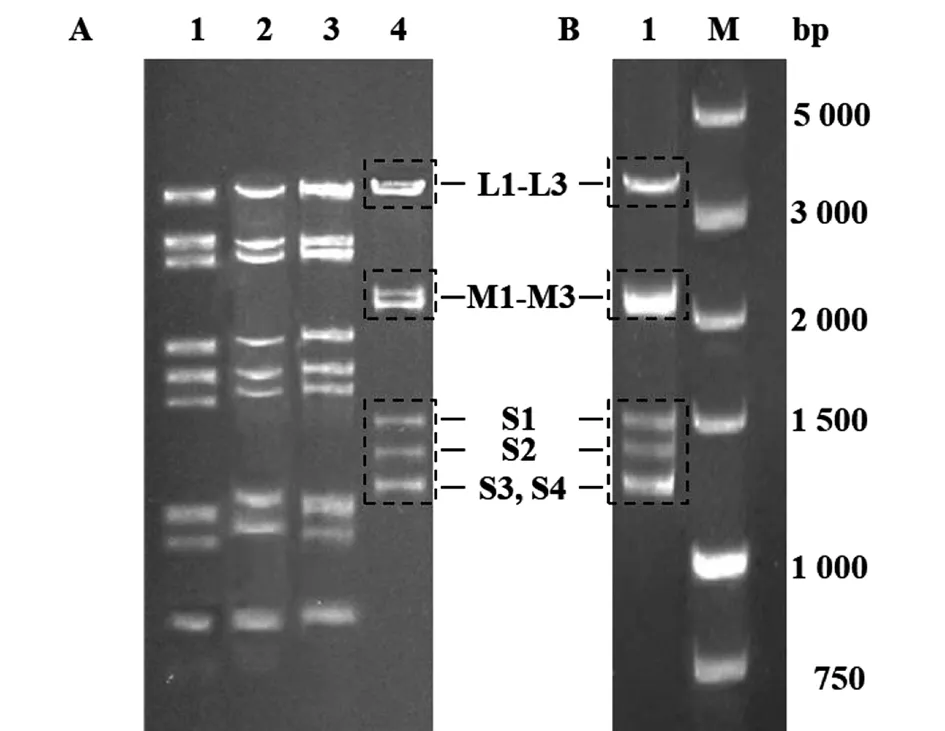
A:泳道1-4分别为BTV、EHDV、PALV与YNSZ/V207/2017毒株基因组dsRNA;B:泳道1为YNSZ/V207/2017毒株全基因组RT-PCR扩增产物,M为 DL 5 000 DNA Marker
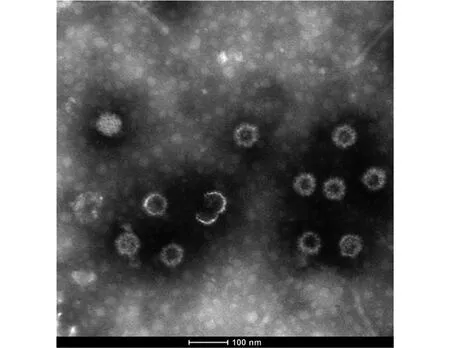
图3 YNSZ/V207/2017电镜观察结果
2.3 YNSZ/V207/2017毒株的基因组RT-PCR扩增与测序 采用FLAC技术[21]进行YNSZ/V207/2017毒株基因组的RT-PCR扩增,电泳结果显示该毒株的基因组DNA电泳带型与基因组dsRNA一致(图2B),表明成功完成了病毒的全基因组扩增。将纯化后的扩增产物进行高通量测序。结果显示,测序共计产生571 343 600条reads。数据过滤处理后得到361 940 200条高质量的reads(Q>30),进一步装配出10个序列重叠群(contigs),每个碱基位点的测序深度在8 000至20 000之间,表明对YNSZ/V207/2017毒株的基因组进行了深度测序。
2.4 YNSZ/V207/2017毒株为MRV成员 YNSZ/V207/2017的基因组序列分析显示,病毒基因组全长为23 605 bp,10个基因节段的长度在1 196 bp至3 915 bp之间,G+C含量(mol%)在44.12%至47.89%之间,病毒基因组可编码11种不同的蛋白,其氨基酸残基数在120 aa至1 290 aa之间;非编码区(Non-Coding Regions, NCR)占基因组的3.09%,各基因节段5′ 端NCR的长度在12 bp至32 bp之间,3′端NCR的长度在32 bp至80 bp之间,5′与3′端具有CUA……UCAUC的保守序列(表2)。BLAST 分析显示YNSZ/V207/2017各基因节段与不同血清型MRV对应基因节段的序列相似度最高,核苷酸(nt)序列相似度在93.6%至98.9%之间,编码蛋白氨基酸(aa)序列相似度在98.6%至99.4%之间,表明待鉴定病毒为MRV。

表2 YNSZ/V207/2017毒株基因组特征
2.5 YNSZ/V207/2017毒株为MRV-1型 S1基因节段编码的α1蛋白决定着MRV的血清型[11]。序列比对显示YNSZ/V207/2017毒株的S1基因节段与MRV-1型毒株的序列相似度最高,核苷酸序列相似度在73.9%至98.5%之间,编码α1蛋白的氨基酸序列相似度在77.7%至98.9%之间。在MRV S1基因节段构建的系统发生树上,已知的4种血清型MRV毒株形成4个不同的进化分支,YNSZ/V207/2017毒株与蝙蝠、树鼩、牛、水貂和人上分离的MRV-1型毒株[7,16-17]处于同一进化分支,在系统发育树上归集为一簇(图4),进一步证实YNSZ/V207/2017毒株为MRV-1型。

本研究分离的YNSZ/V207/2017毒株以“●”表示,其它MRV毒株以“GenBank号/血清型/分离国家/分离宿主”表示。
2.6 YNSZ/V207/2017毒株可能为基因重配毒株 序列分析显示,YNSZ/V207/2017毒株的L1至L3、M2、M3与S3基因节段与人粪便样品中分离的MRV-2型MRV2Tou0毒株序列相似度最高,核苷酸序列相似度在97.0%(L3)至98.9%(S3)之间,编码蛋白氨基酸序列相似度在98.6%(μNS)至99.4%(λ2)之间;而M1、S1、S2与S4基因节段分别与白尾鹿(Odocoileusvirginianus)、水貂(Mustlavison)、果子狸(Pagumalarvatataivana)和棕蝠(Eptesicusserotinus)上分离的不同血清型MRV毒株对应基因节段序列相似度最高(表3);在构建的系统发生树上,YNSZ/V207/2017毒株的L1、L3与M1形成相对独立的进化分支,而L2、M2、M3、M4、S3与S4等基因节段则与分离自人、蝙蝠、猪和果子狸等的不同血清型MRV毒株聚为一簇(图5),提示YNSZ/V207/2017可能为基因重配毒株。

本研究分离的YNSZ/V207/2017毒株以“●”表示,其它MRV毒株以“GenBank号/血清型/分离国家/分离宿主”表示。
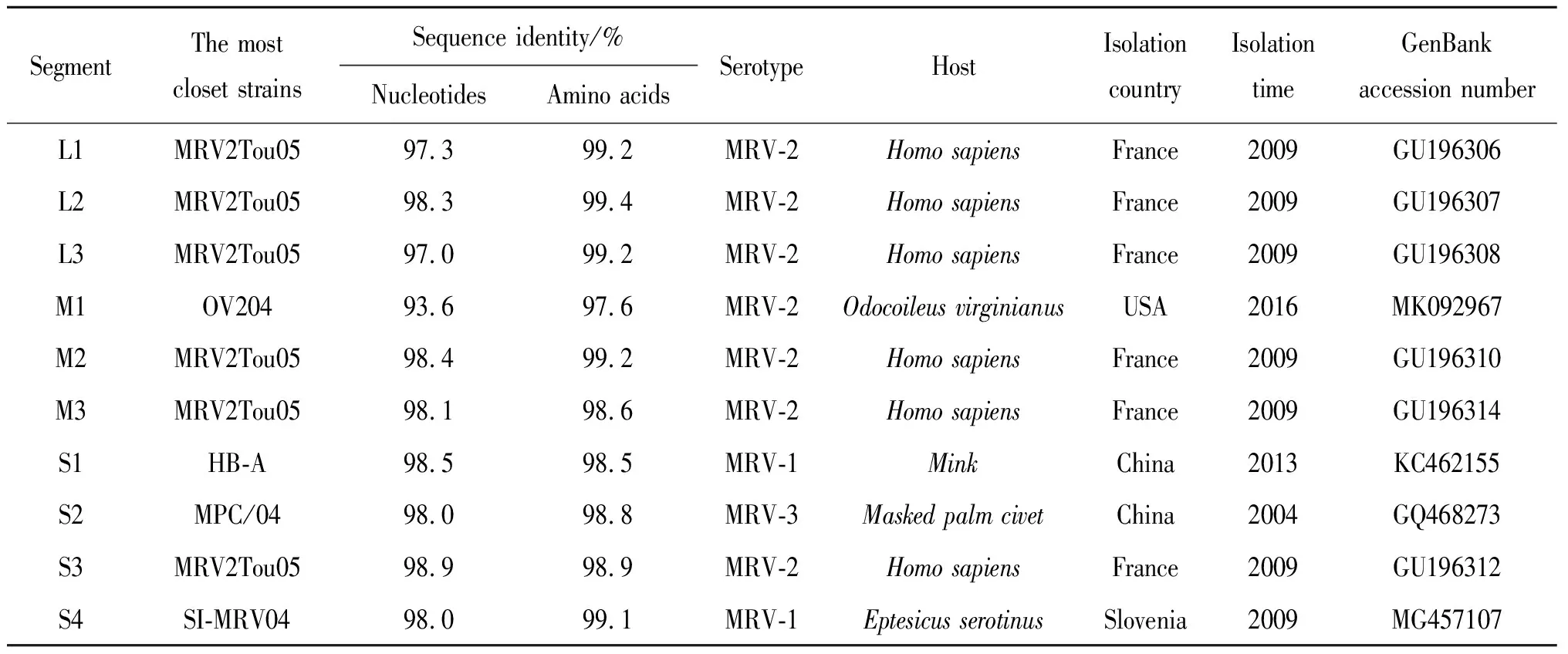
表3 YNSZ/V207/2017毒株各基因片段与GenBank中其它MRV毒株序列的最高相似度
2.7 MRV-1型病毒在当地家畜的流行病学初步调查 为分析MRV-1型病毒在当地家畜的感染情况,通过血清中和试验,对2016至2017年采集自师宗县牛、山羊和猪的血清各40份进行MRV-1中和抗体的检测。实验结果显示,牛血清中13份为阳性,阳性率32.5%;山羊血清中检测出8份阳性样本,阳性率为20.0%;而猪血清中检测到17份阳性,阳性率为42.5%,表明师宗县家畜中普遍存在MRV-1型的感染,猪的感染率高于牛和羊。
3 讨 论
近年来,严重急性呼吸综合征冠状病毒(SARS-CoV)[27]、中东呼吸综合征冠状病毒(MERS-CoV)[28]、埃博拉病毒(Ebola virus)[29]与严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)[30]等来源于蝙蝠与其它野生动物的病毒频繁出现跨物种传播,对人类公共卫生安全与社会发展造成了严峻挑战。MRV呈世界范围流行,多种哺乳动物均为易感宿主,可导致病毒发生跨物种传播;蝙蝠体内基因重配变异MRV毒株的不断发现[8-10],病毒引起人、家畜和野生动物发病的报道不断增多[3-7,14-15],表明MRV的跨物种传播频率与致病性正在发生改变。
MRV-1型在我国南方与北方地区均有分布,目前国内已有从水貂、猪、树鼩、蝙蝠和果子狸中分离出该血清型病毒的报道[7,14-17]。本研究从设立于师宗县的哨兵牛中陆续分离出BTV、EHDV和PALV等虫媒病毒,表明多种动物虫媒病毒流行于云南省。BTV可引起绵羊群中蓝舌病的暴发,发病动物病死率高达30%,是世界动物卫生组织规定的法定报告疫病,病毒如果向我国北方绵羊养殖集中的地区扩散,可能会给我国绵羊养殖业带来较大危害。由于国内未见从牛上分离MRV的报道,因此实验之初,通过虫媒病毒特异性的RT-PCR方法对YNSZ/V207/2017毒株的鉴定并不成功。进一步通过透射电镜观察病毒粒子,结果发现该分离株具有呼肠孤病毒科病毒粒子特征,同时琼脂糖凝胶电泳结果显示该毒株基因组为双链RNA,以上结果均提示分离毒株可能归属于呼肠孤病毒科,但准确鉴定分离病毒的种属关系并掌握其遗传背景,仍需获取病毒的全基因组序列。
通过高通量测序(HTS)获取病毒基因组序列推动了病毒的鉴定、分类学、进化与溯源、诊断试剂、变异与疫苗等领域的研究[31-33]。本实验室前期建立了通过全长cDNA扩增与HTS获取呼肠病毒科病毒全基因组序列的技术[21],我们通过该技术获取了YNSZ/V207/2017毒株的全基因组序列,进而确认了病毒的身份:该毒株与GenBank中收录的MRV核酸序列相似度在93.6%至98.9%之间,编码蛋白氨基酸序列相似度在98.6%至99.4%之间,该毒株的S1/σ1与MRV-1型毒株的序列相似度达98.5%/98.9%,在S1基因节段构建的系统发生树上与MRV-1型毒株聚为一支,表明YNSZ/V207/2017毒株为MRV-1型。
基因重配是基因组分节段RNA病毒进化主要动力之一,因此,对病毒的免疫原性、致病性、传播与感染特性等均有深刻影响,历史上几次大范围流感病毒的暴发与流行,均与基因重排产生变异毒株有关[34]。MRV基因组分节段,可感染几乎所有的哺乳动物,为病毒通过基因重配产生多种形式的变异毒株创造了条件;蝙蝠免疫系统的特殊性和生活习性,使其成为产生MRV基因重配变异毒株的“病毒库”,在MRV传播和变异中扮演重要角色[8-10,16-17]。本研究分离MRV-1型毒株的L1至L3、M2、M3与S3基因节段与人上分离的MRV-2型毒株亲缘关系最近;而M1、S1、S2和S4基因节段则分别与白尾鹿、水貂、果子狸和棕蝠分离的不同血清型MRV毒株序列相似度最高,这与我国腹泻病猪分离的MRV-1与MRV-2型毒株的基因重配特征类似[12,14],提示MRV可通过基因重配进而适应不同的宿主环境,推动病毒在不同宿主间传播与扩散。
初步的流行病学调查结果显示,在云南省师宗县采集的血清样本中,牛、羊和猪的MRV-1抗体阳性率分别达到32.5%、20.0%和42.5%,表明该血清型病毒在当地的家畜中广泛流行。目前有关我国家畜中MRV的流行病学调查研究报道较少,在四川10个猪场采集的78份腹泻猪粪样本中MRV-2的阳性率为14%[12],而师宗县猪血清中MRV-1中和抗体阳性率为42.5%,我们认为除去病毒的差异外,饲养环境的不同也是造成两地MRV感染率差异较大的原因。四川省生猪的规模化养殖程度较高,而师宗县生猪养殖以散养为主;MRV对外界环境的抵抗力强,高湿度有利于病毒的存活[35-36],我们推测病毒可通过感染动物的粪便污染水源,而后通过粪口途径感染造成病毒在当地动物中的流行。由于目前尚无MRV疫苗,因此,通过控制环境卫生仍是控制MRV在动物中扩散的有效措施。
目前,不同血清型MRV毒株在我国的遗传背景、流行情况、致病性等问题尚不完全清楚。在进一步的工作中,我们计划建立不同血清型MRV的核酸检测技术,在云南省开展家畜与野生动物MRV的流行病学调查研究,开展病毒分离及全基因组测序,分析流行株的致病性,为MRV的防控提供科学依据与技术保障。
利益冲突:无
引用本文格式:李占鸿,肖雷,李卓然,等.云南牛血液标本中哺乳动物正呼肠孤病毒(YNSZ/V207/2017)的分离鉴定[J].中国人兽共患病学报,2022,38(1):1-9.DOI:10.3969/j.issn.1002-2694.2021.00.167
