GRK5-Moesin通路在胶质母细胞瘤中的分布特点及作用
2022-08-04钱中润吴婧婧
杨 洋,钱中润,吴婧婧
胶质瘤是成人最常见的颅内原发恶性肿瘤,其中多形性胶质母细胞瘤(glioblastoma multiforme,GBM)恶性程度最高,预后极差。尽管当今医疗技术不断发展精进,胶质瘤的治疗还是以手术联合放化疗为主,GBM患者的中位生存期仍只有14个月左右[1-3]。GBM中存在大量低分化的胶质瘤干细胞(glioma stem cells,GSCs),被认为是引起肿瘤耐药性和肿瘤复发的“元凶”[1-5]。G蛋白偶联受体激酶5(G protein coupled receptor kinase-5, GRK5)属于丝氨酸/苏氨酸激酶家族,其功能涉及多种病理过程。前期研究[6]表明GRK5的表达分布与胶质瘤干细胞有关。Moesin属于ERM蛋白家族(The Ezrin-Radixin-Moesin proteins)[7],可通过调节肌动蛋白改变细胞迁移活性。Moesin与肿瘤的发生发展有关[7-8]。前列腺癌研究[9]中提示Moesin是GRK5的磷酸化底物。GRK5通过磷酸化位点T66结合Moesin,靶向调控Moesin亚细胞分布[9]。而GRK5-Moesin在胶质瘤中的定位关系和分布特点尚不清楚。
该研究通过免疫组化和免疫荧光分析GRK5和Moesin在GBMs中的亚细胞定位和分布特点,以及GRK5-Moesin与肿瘤血管及胶质瘤干细胞的位置关系,进而研究上调/下调GRK5活性对Moesin的影响,以及对U87细胞生物学活性的改变。
1 材料与方法
1.1 试剂与仪器U87胶质瘤细胞系购自中国科学院细胞库;细胞培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;GRK5上调质粒(GV358/GRK5)和GRK5敲减质粒(GV248/shRNA)慢病毒液购自上海GenePharma公司;RNeasy Mini Kit试剂盒购购自美国QIAGEN公司;AceQ SYBR Green Master Mix试剂盒购自南京诺唯赞生物技术股份有限公司;GAPDH抗体购自美国Sigma公司、GRK5抗体购自中国南京Bioworlde公司;Moesin抗体购自美国Affbiotech公司;CD44抗体购自美国CST公司;细胞培养板购自美国Corning公司;荧光二抗均购自武汉塞维尔生物技术有限公司;超敏ECL发光试剂盒购自美国Thermo Fish公司;相关引物设计自美国Invitrogen公司。细胞增殖检测试剂盒(cell counting kit-8,CCK-8)购自日本东仁化学科技有限公司;Annexin V-PE/7AAD凋亡检测试剂盒购自南京凯基公司;细胞迁移侵袭实验使用的BioCoatTMInvasion Chambers小室和Matrigel胶购自美国BD公司;实时定量PCR仪、生物安全柜和细胞培养箱等均购自美国Thermo Scientific公司;荧光显微镜购自日本Olympus公司;流式细胞仪来自美国Beckham公司;蛋白与核酸电泳设备购自北京六一生物科技有限公司。本研究中涉及的胶质瘤样本均取自中国科学技术大学附属第一医院神经外科确诊并手术的胶质瘤患者。所有患者术前均未接受化疗或放疗。所有患者术前均获得知情同意。所有研究方法和程序均经中国科学技术大学附属第一医院伦理委员会批准(批号:2019-X(H)-029)。
1.2 方法
1.2.1细胞培养和病毒包装细胞转染 U87胶质母细胞瘤细胞系来自脑功能与脑疾病安徽省重点实验室。该细胞系经中国科学技术大学附属第一医院伦理委员会批准使用[6,10-11]。细胞在DMEM培养基中添加10%胎牛血清,置于37 ℃、5% CO2的湿化培养箱中。用GRK5上调质粒(GV358/GRK5)和GRK5敲减质粒(GV248/shRNA)慢病毒液感染细胞。根据说明书加入1 μg/ml聚凝胺存和5 μg/ml嘌呤霉素(美国Sigma-Aldrich公司)到培养基中,将感染细胞传代至10%汇合。未处理的U87细胞定义为空白对照组;表达GV358/GRK5、GV248/shRNA、LV-3阴性对照的细胞分别定义为U87-UP、U87-KD、NC组。采用定量逆转录聚合酶链反应(qRT-PCR)和Western blot检测GRK5的表达。
1.2.2RNA分离和qRT-PCR 利用Qiagen RNeasy Mini Kit从胶质瘤细胞中提取总RNA。然后,用RevertAid First Strand cDNA Synthesis Kit将2 mg RNA逆转录为cDNA。所有的程序都是按照制造商的说明进行的。采用AceQ SYBR Green Master Mix进行qPCR检测。采用2-ΔΔCt法计算基因表达的倍数变化[6,11]。引物序列为:人GRK5,F:5′-AGGAGCT GAACGTGTTTGGA-3′, R:5′-TTGTTCTGATGCTGC CGCT-3′;人GAPDH,F:5′-TCGGAGTCAACGGAT TTGGT-3′, R:5′-TTCCCGTTCTCAGCCTTGAC-3′。
1.2.3Western blot实验 按照标准实验步骤进行实验[6,10],GRK5(1 ∶500)和Moesin (1 ∶500)在4 ℃下过夜。使用抗GAPDH的抗体(1 ∶1 000)在室温下1小时,使用ECL检测系统通过化学发光观察免疫反应蛋白。采用Image Pro Plus 6.0软件测定蛋白条带强度。
1.2.4细胞划痕试验 胶质瘤细胞在12孔板中培养。当细胞融合到80-90%时,用标准的200 μl枪头尖在12孔板的单层细胞上制造出划痕。在24和48 h,观察细胞向刮拭区迁移,在固定观察点使用显微镜拍摄图像。通过测量细胞进入划痕区域的运动来确定细胞迁移。使用Image J软件进行定量分析,结果以百分比表示:伤口闭合面积相对于最初伤口面积的平均值[6,10]。
1.2.5侵袭试验 采用BioCoatTMInvasion Chambers小室进行。用基质凝胶(Matrigel)包覆上室后将约 5 ×104个细胞用200 μl无血清DMEM重悬并加入上腔,在下室中加入600 μl含10%胎牛血清的DMEM。37 ℃培养18 h后,去除膜上侧细胞,用1%多聚甲醛固定膜下表面受侵细胞,用0.1%结晶紫染色。然后,在200倍光学显微镜下,每个小室选取8个随机视野计数细胞,取平均数作为该小室的细胞计数[6,10]。
1.2.6细胞增殖实验 采用CCK-8(日本DOJINDO)检测细胞增殖。将2×104的胶质瘤细胞植入96孔培养皿中。培养24、48、72、96 h后,用含1 ∶10稀释CCK-8的培养基替换培养基。在37 ℃下再孵育2 h后,用设置在450 nm处的分光光度计测量吸光度[6]。
1.2.7免疫荧光三重染色分析 针对胶质瘤组织切片,首先进行载玻片脱脂和抗原提取,将涂胶载玻片放入EDTA缓冲液(pH 8.0, 塞维尔生物技术有限公司,武汉),加热8 min。用含2.5%山羊血清和0.5% SDS的缓冲液在室温下阻断1 h。然后用兔抗人GRK5(1 ∶1 000)、小鼠抗人Moesin(1 ∶3 000)和小鼠抗人CD44(1 ∶2 000)抗体在0.01 M磷酸盐缓冲盐水(phosphate-buffered saline,PBS)、0.5%牛血清白蛋白和0.05% NaN2中过夜。冲洗玻片,用相应的二抗依次孵育:HRP标记山羊抗兔荧光二抗(1 ∶500),HRP标记山羊抗小鼠荧光二抗(1 ∶500),Cy5标记山羊抗小鼠荧光二抗(1 ∶400),50 min/次。DAPI染核,盖玻片覆盖后荧光显微镜下观察。针对U87胶质瘤细胞进行染色,首先将细胞重悬于含血清培养基,滴加到多聚赖氨酸包被盖玻片上培养过夜。用40 g/ml多聚甲醛4 ℃固定30 min,0.2% TritonX-100通透10 min。山羊血清封闭30 min。再同时加上述抗体过夜,后续步骤同上。
1.2.8免疫组化及HE染色 石蜡包埋切片、脱蜡、水化,GRK5(1 ∶500)或Moesin(1 ∶500)或CD44(1 ∶500)作为一抗,严格按照试剂盒步骤操作。光镜下观察,染色结果判定:胞质或胞膜染成棕黄色为阳性。石蜡包埋的组织切片用10%多聚甲醛固定后行HE染色。
1.2.9细胞凋亡检测 使用Annexin V-PE/7-AAD凋亡检测试剂盒分析胶质瘤细胞凋亡,同时用Annexin V-PE和活性染料7-氨基-放线菌素D(7-amino-actinomycin D,7AAD)对肿瘤细胞进行染色。染色细胞立即用流式细胞仪进行分析。
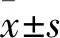
2 结果
2.1 GRK5和Moesin在胶质瘤中共表达情况及与胶质瘤干细胞关系通过免疫荧光染色检测U87胶质母细胞瘤细胞及高级别胶质瘤组织中GRK5与Moesin的表达相关性。结果显示GRK5主要以在细胞胞质表达为主,在胞膜表达较少;Moesin在胞质表达较弱,而在细胞膜中表达较多。GRK5与Moesin的共表达部位在图中显示为黄色区域(图1、2)。CD44作为另一种胶质瘤干细胞标志物,被发现在GBM细胞膜存在阳性表达(呈粉色,见图1、2);且在部分GBM细胞中可观察到GRK5、Moesin与CD44三者共同定位于细胞膜上同一位置的共表达,见图1、2。而作为对照,正常脑组织中GRK5、Moesin和CD44的免疫组化和免疫荧光染色均为阴性。
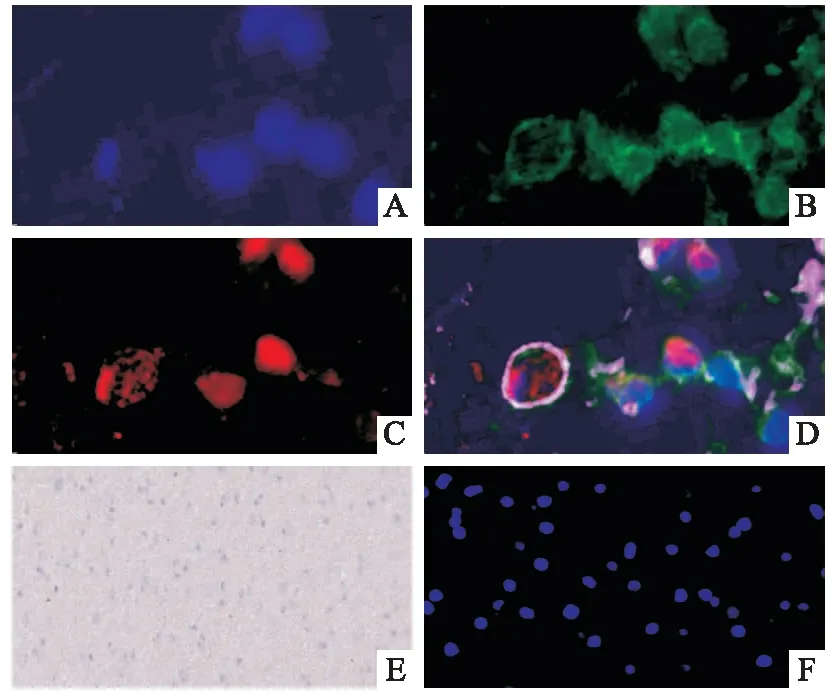
图1 GRK5、Moesin及CD44在GBMs中存在共定位
2.2 GRK5、Moesin与胶质瘤“壁龛”样结构关系光镜及荧光显微镜下观察,GBM组织样本中存在许多类似“壁龛”样的结构,CD44在此类结构中富集表达。荧光显微镜下观察,壁龛结构中的肿瘤细胞内大多同时表达GRK5和Moesin,且壁龛中部分细胞存在GRK5-Moesin-CD44三者的共定位,见图2。

图2 GRK5-Moesin-CD44在胶质瘤细胞壁龛中富集
2.3 GRK5和Moesin在胶质瘤血管的分布研究显示,GBM样本中的血管附近细胞存在大量GRK5和Moesin阳性表达(图3B、C)。另一方面,肿瘤中各个血管周围GRK5阳性和Moesin阳性细胞的分布却又存在明显差异(图3D~G):图3D中的血管结构以Moesin阳性表达为主,GRK5阳性表达较少。图3E中的GRK5阳性细胞均匀分布于整个血管,Moesin阳性细胞则局限于血管内膜。图3F中的血管结构以GRK5阳性细胞为主,Moesin阳性细胞较少。图3G中的血管则表现为GRK5和Moesin共同分布,部分细胞中存在亚细胞共定位。
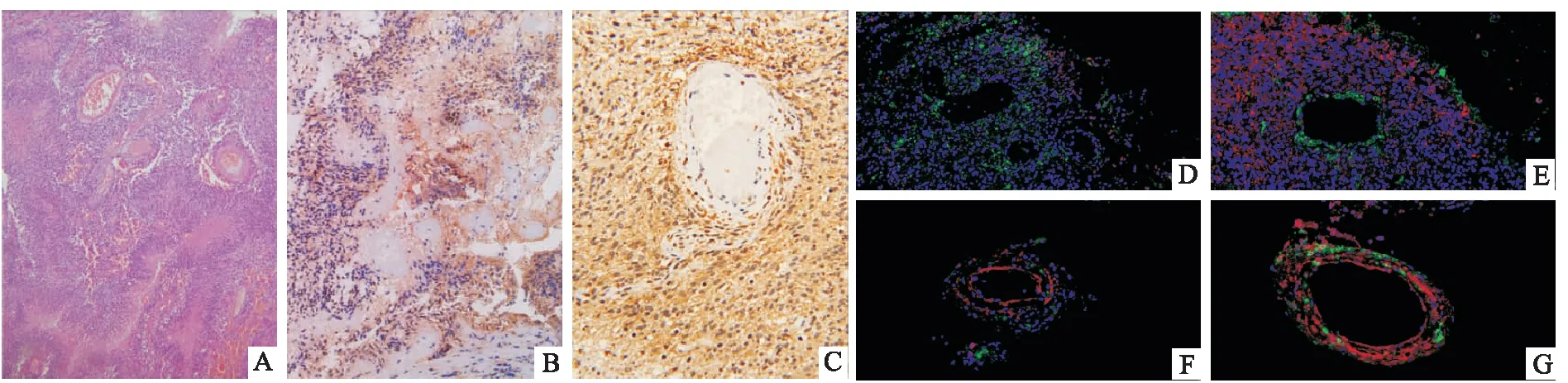
图3 GRK5与Moesin在胶质瘤血管的表达和分布
2.4 建立GRK5上调/下调的U87稳转细胞系利用GRK5上调/敲减质粒的慢病毒液对U87细胞进行转染,建立稳转细胞系(空白对照组:U87;阴性对照组:U87-NC;GRK5上调组:U87-UP;GRK5下调组:U87-KD)。鉴定结果显示,与对照组相比,U87-UP组的GRK5的mRNA(F=75.823,P<0.01)和蛋白水平均提高(F=99.707,P<0.01),而U87-KD组的GRK5的mRNA(F=27.780,P=0.002)和蛋白水平(F=9.900,P<0.05)均降低,差异有统计学意义,见图4。
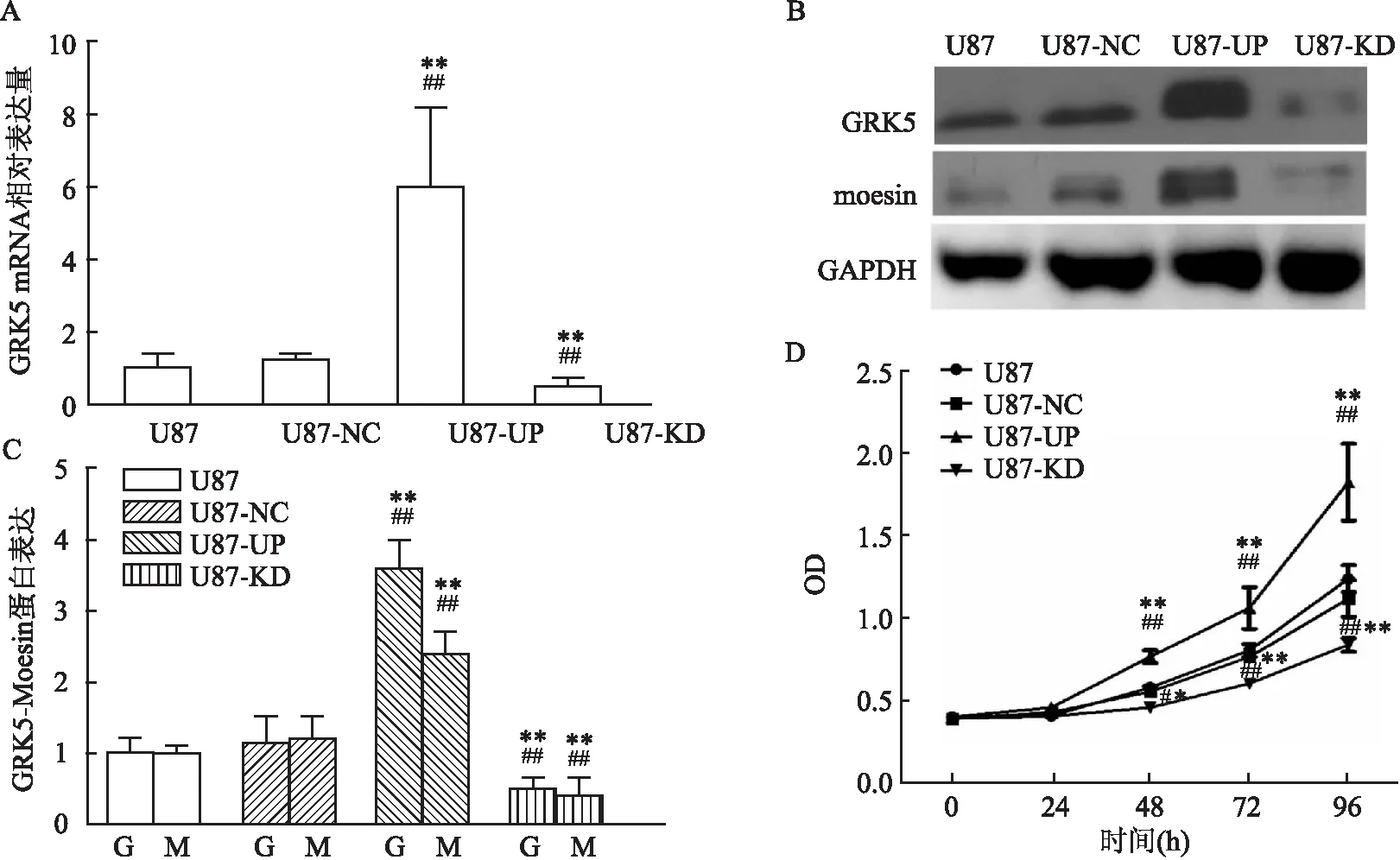
图4 GRK5上调/下调可靶向调控Moesin表达
2.5 GRK5-Moesin表达改变对U87生物学活性的影响利用GRK5上调/下调稳转细胞系,分析GRK5活性改变对胶质瘤细胞增殖、迁移、侵袭和凋亡的影响。CCK-8实验结果显示,第48、72、96 h,GRK5-UP组细胞增殖能力较对照组及GRK5-KD组增强,而GRK5-KD组细胞增殖能力较对照组及GRK5-KD组减弱,见图4D。如图5A、B所示,细胞划痕实验,GRK5上调可提高U87细胞迁移能力,促进“划痕”愈合(P<0.01,F=110.163),而GRK5下调的U87细胞“划痕”愈合明显减慢(P<0.01,F=109.606)。Transwell实验结果见图5C、D,U87-UP组细胞的侵袭能力较对照组提高(P<0.01,F=84.961),而U87-KD则降低(P<0.01,F=86.755)。流式细胞术检测细胞凋亡发现,U87-UP组的胶质瘤细胞的凋亡较U87-NC及U87组相对减少(P<0.05,F=11.244),而U87-KD组细胞凋亡比U87-NC及U87组增加(P<0.01,F=87.464),见图5E、F。
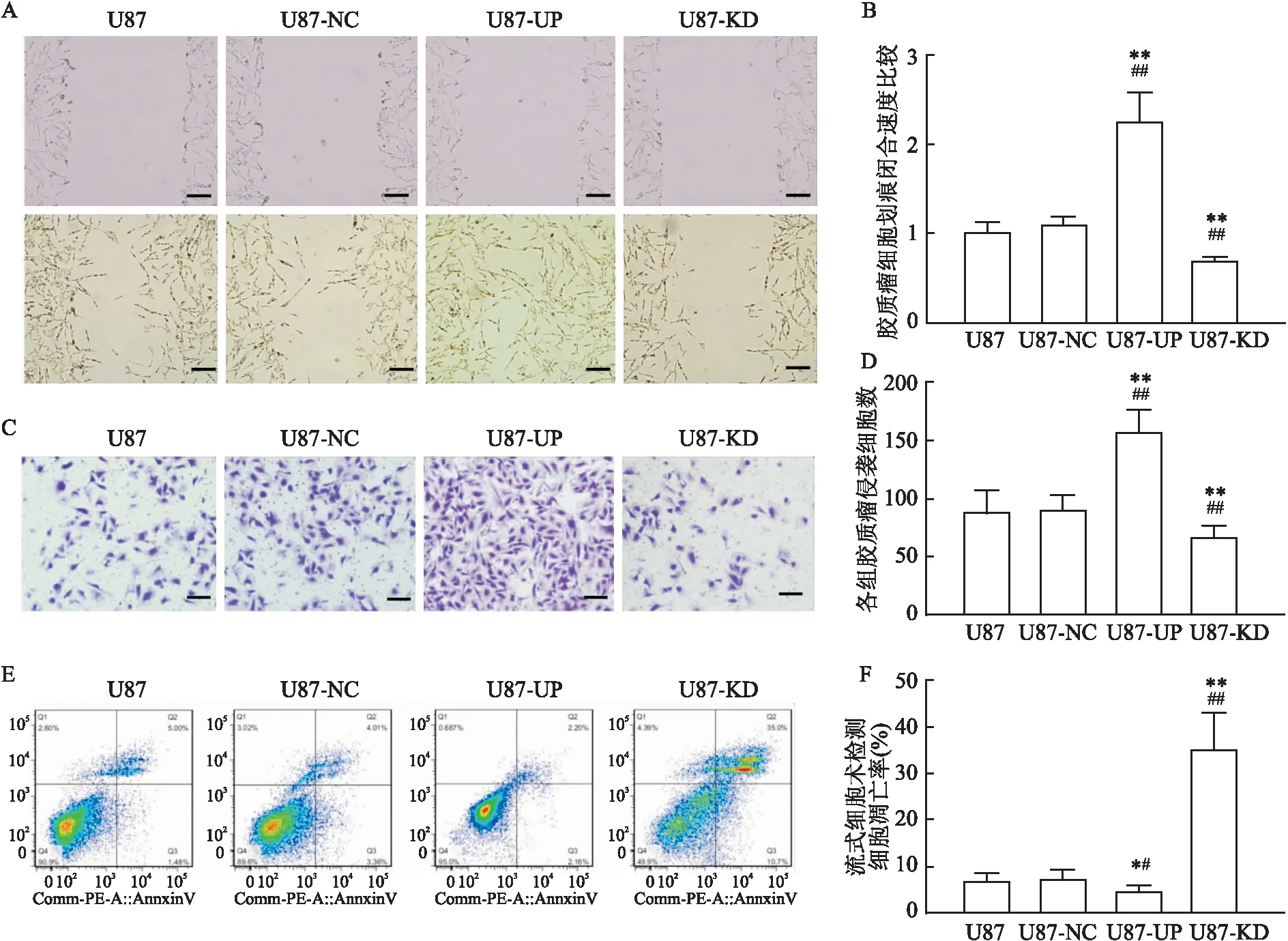
图5 GRK5对U87细胞生物学活性的影响
3 讨论
尽管GRK5在心血管疾病发病机制中的作用已经被广泛研究,但直到近年来,它在肿瘤发生发展中的作用才逐渐被揭示。GRK5被认为在调节肺癌、前列腺癌等肿瘤细胞的生长中发挥作用,而在胶质瘤中的研究还相对较少。近期的研究[9]表明GRK5通过结合T66位点使Moesin磷酸化,从而对前列腺癌细胞中肌动蛋白的重塑、侵袭和转移产生影响。而在GBM细胞中,Moesin是被磷酸化激活的主要ERM成员,在胶质瘤中的表达水平上调,并且与胶质瘤干细胞密切相关[12]。
本研究表明GRK5和Moesin均在GBM中高表达,课题组不仅观察到GRK5、Moesin和CD44三者在GBM细胞膜上存在共表达,而且在肿瘤血管和胶质瘤壁龛结构大量富集分布,提示GRK5和Moesin可能参与构成胶质瘤的壁龛结构。GRK5-Moesin可能是GBMs维系胶质瘤干细胞“干性”的重要调节子。而调控GRK5可显著改变Moesin表达,进一步提示GRK5-Moesin在胶质瘤中存在相互作用,GRK5作为上游基因,可靶向调控Moesin的表达活性。
GRK5+细胞和Moesin+细胞在胶质瘤各个血管周围富集,但呈现出差异化分布特点。近年来有报道[13]提出,GBM生长需要不同的微循环模式,尤其是GBM细胞来源的血管(GBM cell-derived vessels,GDVs)。分析胶质瘤患者术后病理样本发现,样本中GDVs较多的患者的中位生存期仅为9.56个月,而GDVs较少的患者的中位生存期为13.60个月。那么,GRK5-Moesin与胶质瘤血管类型存在怎样的关系,GRK5-Moesin差异化分布与胶质瘤内血管类型的关系有待进一步研究。
GRK5活性改变可影响胶质瘤细胞生物学活性。GRK5上调可促进胶质瘤细胞的增殖、迁移和侵袭;GRK5上调/下调导致胶质瘤细胞凋亡率随之减少/增加。目前已研制出针对GRK5的特异性靶向药物:舒尼替尼(Sunitinib)是已被FDA批准的针对GRK5最有效的小分子抑制剂[14],主要抑制血管内皮生长因子受体和血小板衍生生长因子受体,从而阻断肿瘤的血管生成[15]。舒尼替尼能否通过靶向抑制GRK5使胶质瘤患者获益还需继续深入研究。
