肾病综合征大鼠体内钠离子分布研究
2022-08-04倪良厚李曼曼王运来宣自华
倪良厚,杨 沫,李曼曼,王运来,宣自华,许 钒
钠水潴留是肾病综合征(nephrotic syndrome, NS)水肿发生的主要因素[1]。目前在NS中,对于水钠潴留的研究主要基于血液及尿液, 表现为尿液Na+排泄降低,血液Na+基本不变,体内潴留Na+分布不明[2-3]。进一步研究[4]表明,在皮肤中有大量的Na+储存,表明皮肤可以作为Na+的储存库。糖胺聚糖(Glycosaminoglycan , GAGs)在皮肤组织间质中大量存在,在生理pH值下,每个GAGs二糖单位具有1~3个阴离子位点,可与Na+等阳离子通过静电作用相互结合[5]。毛细淋巴管在肾脏中的重要生理功能是单向输送大分子物质、电解质等至静脉。LYVE-1是淋巴内皮细胞上的主要透明质酸受体,是区分血液和淋巴网络的标志物[6]。相关研究[7-8]表明,高渗环境可以诱导巨噬细胞分泌TonEBP,促使巨噬细胞分泌VEGFC,与毛细淋巴管上的VEGFR3结合,从而诱导毛细淋巴管网络扩张,以清除组织间质高渗物质。因此,推测NS潴留的Na+可能通过毛细淋巴管与静脉的交互作用,运输至皮肤,与皮肤中GAGs结合,达到存储目的。综上,本实验旨在对NS大鼠体内Na+分布及其机制进行初步探索。
1 材料与方法
1.1 实验动物雄性SPF级Sprague-Dawley(SD)大鼠16只,体质量(200±20)g,购于邳州市东方养殖公司,许可证号SCXK(苏)2017-0003,合格证编号:202107564。实验方案由安徽中医药大学实验动物伦理委员会审核通过。动物伦理编号:AHUCM-rats-2021068。实验动物在温度(23±1)℃、相对湿度50%~60%的环境下进行饲养,饲养期间给予标准颗粒饲料,12 h光照黑暗交替,所有大鼠进行两次尿蛋白定性实验(尿蛋白试纸法)均为阴性。
1.2 主要试剂注射用盐酸多柔比星(阿霉素,Adriamycin,ADR)(批号:21014711),杭州瀚晖制药有限公司;BCA蛋白定量试剂盒(批号:0508A21),肌酐(Creatinine,Cr)检测试剂盒(批号:0508A21),北京雷根生物技术有限公司;Na试剂盒(批号:20210420),南京建成生物工程研究所;总蛋白(total protein,TP)测定试剂盒(批号:AUZ8665),白蛋白(albumin,ALB)测定试剂盒(批号:AUZ8692),胆固醇(total cholesterol,TC)测定试剂盒(批号:AUZ8183),三酰甘油 (triGlyceride,TG)测定试剂盒(批号:AUZ8611),尿素氮(urea nitrogen,BuN)测定试剂盒(批号:AUZ8995),肌酐测定试剂盒(批号:AUZ2490),美国贝克曼库尔特公司;大鼠糖胺聚糖ELISA试剂盒(批号:10/2021),上海将来实业股份有限公司;兔抗GAPDH抗体(批号:GR3316865-1),英国Abcam公司;兔抗TonEBP抗体(批号:KK1108),成都正能生物科技有限公司;兔抗LYVE-1抗体(批号:1901R01-2),兔抗VEGFC抗体(批号: 2020091002),美国Novus公司;兔抗VEGFR3(批号:VJ3101245),美国Thermo Fisher公司;山羊抗兔IgG(HRP)(批号:GR335516-1),英国Abcam公司;ECL发光液(批号:P10100),苏州新赛美生物科技有限公司;甲醛(批号:10010018),上海国药集团化学试剂有限公司;Alexa Fluor 488标记山羊抗小鼠IgG(H+L)(批号:A0428),DAPI染色液(批号:C1002),防淬灭封片剂(批号:P0126),上海碧云天生物技术有限公司。
1.3 主要仪器SOLAAR AA原子吸收光谱仪,美国Thermo Corporation公司;BeckmanAU-5800全自动生化分析仪,美国贝克曼库尔特公司;MultiskanMK2酶标仪,美国Thermo Lab systems公司;BHWY-100BC型恒温振荡培养箱,常州杰博仪器有限公司;Eppendorf Centrifuge 5810R型离心机,德国Eppendorf公司;FA2004型电子天平,上海精科仪器有限公司;ECLIPSE Ni荧光显微镜,日本NIKON公司;DHG-9023A恒温烘箱,上海恒一科学仪器有限公司;CM1850冷冻切片机,PPTHK-21B,摊片机,德国Leica公司;AMERSHAM IMAGER 600超灵敏多功能成像仪,美国通用电气公司。
1.4 模型建立及分组雄性SD大鼠16只,分为正常组和模型组,每组8只,模型组通过两次(第1周4 mg/kg,第2周2 mg/kg)尾静脉注射ADR建立NS大鼠模型,正常组给予等量0.9%氯化钠溶液。BCA蛋白测定试剂盒检测12 h尿蛋白含量。自大鼠造模起每周称量体重1次。
1.5 尿生化指标检测自大鼠造模第0天起,每天将大鼠置于代谢笼12 h,收集大鼠12 h尿液,连续收集造模第0~14天及第21天大鼠尿液。收集的尿液,在离心机上进行离心,调整转速为3 500 r/min,时间为10 min,温度为4 ℃,移液枪取3 ml上清液置于5 ml EP管中。利用试剂盒检测大鼠尿蛋白、肌酐以及尿Na+水平。
1.6 血浆Na+水平及血清生化指标检测第0、7、14天,采用眼眶取血,收集大鼠血液0.5 ml,室温放置30 min,3 500 r/min,离心10 min,分离血浆。第21天收集12 h尿液后,腹腔注射戊巴比妥钠(50 mg/kg)麻醉大鼠,大鼠麻醉后,剃除大鼠全身毛发,以10 ml注射器从腹主动脉进行取血,分别加入非抗凝管5 ml、肝素抗凝管5 ml,室温放置30 min,3 500 r/min,离心10 min,分离血清及血浆。利用试剂盒及全自动生化分析仪检测血浆Na+及血清总蛋白、白蛋白、总胆固醇、三酰甘油 、尿素氮、肌酐。
1.7 大鼠皮肤GAGs含量检测腹主动脉取血处死大鼠后,自大鼠耳根部开始,剥离大鼠完整皮肤,剔除皮肤上多余的肌肉、脂肪以及结缔组织。精密称取100 mg背部皮肤组织,加入2 ml PBS,pH 7.4,充分研磨。2 500 r/min离心20 min,收集上清液,按照酶联免疫分析(ELISA)试剂盒操作步骤检测皮肤GAGs含量。剩余的皮肤组织用作大鼠皮肤含水量及钠含量检测。
1.8 大鼠皮肤含水量及钠含量检测将剥离的大鼠皮肤置于90 ℃烘箱中干燥72 h至恒重,称重,计算皮肤含水量;2次质量差值不大于 3 mg,即认为质量恒定。皮肤含水量=湿重-干重[9],皮肤含水量百分比=(湿重-干重)/湿重。将干燥后的皮肤再次在190 ℃、450 ℃下各干燥24 h,将分离的组织捣碎,在600 ℃下干燥48 h,之后溶解于10 %硝酸中,采用原子吸收光谱法检测Na+浓度[9]。
1.9 肾皮质TonEBP、VEGFC、VEGFR3、LYVE-1蛋白的表达检测采用蛋白免疫印迹法(Western blot)检测肾皮质蛋白表达。精密称取100 mg肾皮质,研磨并裂解。根据BCA蛋白定量试剂盒检测组织总蛋白浓度;制备分离胶、浓缩胶后上样,电泳、转膜。封闭后分别按比例加入相应的一抗TonEBP(1 ∶1 000)、VEGFC(1 ∶1 000)、VEGFR3(1 ∶1 000)、LYVE-1(1 ∶1 000)、内参GAPDH(1 ∶10 000)孵育,4 ℃过夜,加入IgG-HRP(1 ∶10 000)室温孵育1.5 h,加ECL发光液显影,使用ImageJ软件分析相关蛋白表达。
1.10 肾皮质淋巴管密度检测利用免疫荧光法检测肾皮质淋巴管密度。切片前将组织样本于-80 ℃冰箱取出,置于-20 ℃冰箱内复温30 min,使用OTC包埋组织,-20 ℃静置15 min,使组织固定在样品托上,切片,厚度为5~7 μm,将切片置于4%多聚甲醛溶液中固定;将固定好的组织加入含有LYVE-1(1 ∶100)的孵育盒中,4 ℃孵育过夜,0.02 mol/L PBS冲洗3 min×3次。加入荧光二抗(1 ∶200),湿盒孵育,室温下放置1 h。0.02 mol/L PBS冲洗3 min×3次。防淬灭封片剂与DAPI(1 ∶400)稀释封片,-20 ℃冰箱保存,荧光显微镜拍片。根据Weidner经典计数方法[10],即先在低倍镜(×100)下观察LYVE-1阳性染色的淋巴管,选择染色最多的区域,然后在高倍镜(×200)下进行观察,任何被LYVE-1抗体染成绿色的淋巴内皮细胞或淋巴内皮细胞簇,均作为一个淋巴管计数,15个视野取平均值即为此张切片淋巴管密度。
1.11 统计学处理实验数据使用统计学软件SPSS 23.0进行分析,结果以表示,两组均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体质量、造模后尿蛋白含量以及尿蛋白/肌酐与正常组相比,造模后模型组大鼠体质量下降,差异有统计学意义(t1=6.77,t2=9.61,t3=11.72,P<0.01);大鼠12 h尿蛋白含量第14天升高,差异有统计学意义(t=4.22,P<0.01),提示造模成功,第21天检测尿蛋白含量,未发现模型恢复现象;尿蛋白/肌酐于第10天升高,差异有统计学意义(t=4.18,P<0.01),并持续升高。见图1。

图1 ADR模型组和正常组大鼠的体质量、尿蛋白含量和尿蛋白含量/肌酐
2.2 血清生化指标与正常组相比,模型组大鼠血清TC、TG、BuN、Scr升高,差异有统计学意义(tTC=5.01,tTG=4.97,tBuN=4.81,tScr=3.87,P<0.01),TP和ALB下降,差异有统计学意义(tALB=9.08,tTP=11.34,P<0.01)。见表1。
2.3 尿钠排泄量及血浆钠浓度与正常组相比,模型组大鼠尿Na+排泄从首次造模后第2天开始下降(t2=7.44,P<0.01),并于第5~11天降至最低(t5=6.34,t6=4.63,t7=7.21,t8=3.81,t9=8.15,t10=7.18,t11=5.54,P<0.01),第21天模型组尿Na+排泄,但仍低于正常组,差异有统计学意义(t21=2.25,P<0.05)。与尿Na+排泄趋势不同的是第21天模型组大鼠血浆Na+水平较正常组略有上升,但差异无统计学意义(t=0.46)。见图2。

图2 ADR模型组和正常组大鼠的尿钠排泄量和血浆钠浓度A:各组大鼠尿钠排泄情况;B:各组大鼠血浆Na+浓度;与正常对照组比较;*P<0.05,**P<0.01
2.4 大鼠皮肤湿重、干重及含水量百分比与正常组相比,模型组的湿重和干重低于正常组,差异有统计学意义(t湿=9.33,t干=7.59,P<0.01);干燥法检测两组大鼠皮肤含水量百分百比,差异无统计学意义(t=0.84)。见图3。

表1 ADR模型组和正常组大鼠血清生化指标

图3 ADR模型组和正常组大鼠皮肤的湿重、干重、含水量百分比A:各组大鼠皮肤湿重;B:各组大鼠皮肤干重;C:各组大鼠皮肤含水量百分比;与正常对照组比较:**P<0.01
2.5 模型组大鼠尿液Na+与血浆Na+水平与第0天相比,模型组大鼠尿Na+排泄持续降低,差异有统计学意义(t7=7.21,P<0.01;t14=2.95,t21=2.25,P<0.05);而血浆Na+水平基本不变(t7=0.03,t14=0.07,t21=0.46)。见图4。
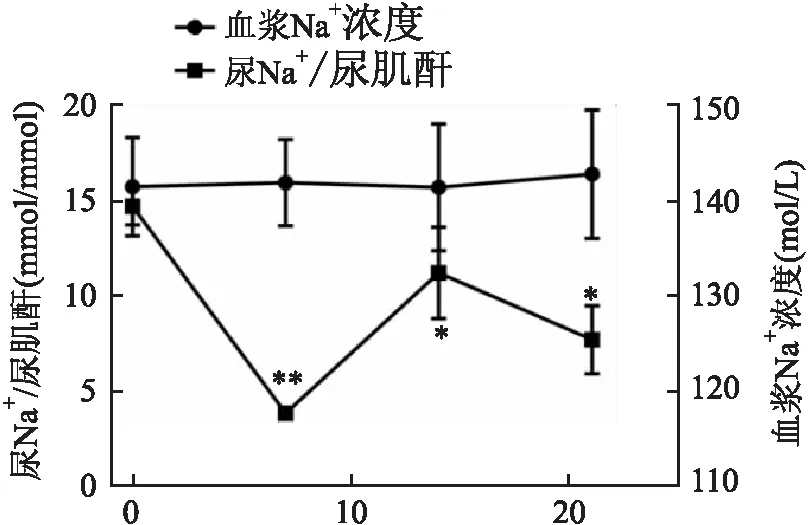
图4 ADR模型组大鼠尿钠排泄与血浆Na+水平分析与第0天比较:*P<0.05,** P<0.01
2.6 大鼠皮肤钠含量、皮肤钠含量/湿重和皮肤钠含量/干重与正常组相比,模型组大鼠皮肤钠含量、皮肤钠含量/湿重和皮肤钠含量/干重升高,差异有统计学意义(t含量=8.89,t含量/湿重=6.32,t含量/干重=9.70,P<0.01)。见图5。

图5 ADR模型组和正常组大鼠皮肤钠含量、皮肤钠含量/湿重和皮肤钠含量/干重A:各组大鼠皮肤钠含量;B:各组大鼠皮肤钠含量/湿重;C:各组大鼠皮肤钠含量/干重;与正常对照组比较:**P<0.01
2.7 皮肤GAGs含量与正常组相比,模型组大鼠皮肤GAGs含量升高,差异有统计学意义(t=8.314,P<0.01)。见图6。

图6 ADR模型组和正常组大鼠皮肤GAG含量与正常对照组比较:**P<0.01
2.8 肾皮质中TonEBP、VEGFC、VEGFR3、LYVE-1蛋白的表达情况与正常组相比,模型组大鼠肾皮质中TonEBP、VEGFC、VEGFR3、LYVE-1蛋白表达升高,差异有统计学意义(tTonEBP=4.12,tVEGFC=7.25,tVEGFR3=8.38,tLYVE-1=7.05,P<0.05或0.01)。见图7。
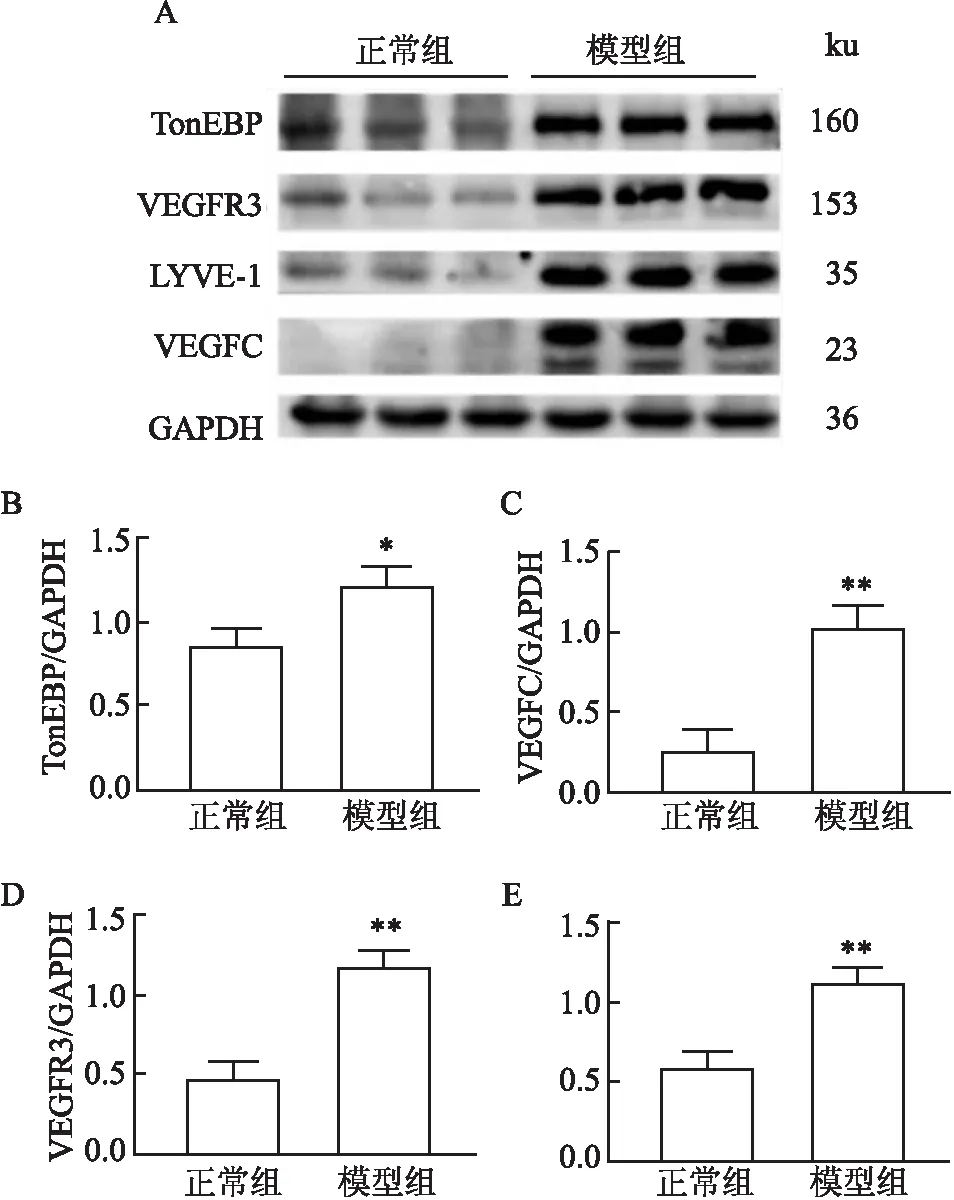
图7 ADR模型组和正常组大鼠肾皮质中TonEBP、VEGFC、VEGFR3、LYVE-1蛋白的表达情况
2.9 肾皮质淋巴管密度变化情况与正常组相比,模型组LYVE-1淋巴管密度升高,差异有统计学意义(t=10.61,P<0.01)。见图8。

图8 ADR模型组和正常组大鼠肾皮质淋巴管密度检测 ×200与正常对照组比较:**P<0.01
3 讨论
水肿作为NS临床主要表现之一,钠水潴留是其发生的主要因素[1]。本实验结果表明,NS模型大鼠尿蛋白升高,血清生化指标显示NS大鼠肾功能下降,尿钠排泄下降,血浆Na+含量无明显变化,提示从首次造模后的第2天开始,机体处于钠蓄积状态,并且这一状态在其成模之后依然保持。
Na+是人体中一种主要的电解质,在维持生理稳态(包括神经活动、肌肉功能和代谢调节)方面有着重要的作用。由于Na+及配对阴离子是细胞外主要的渗透压调节物质,能够对细胞内外的水分进行调节,所以Na+的最重要的功能之一是体液容量调节[11]。在一项长期研究[12]中,观察到的Na+的规律性释放和储存导致身体Na+含量的变化,大量Na+被储存在体内而没有相应的液体保留,说明体内有一个位置可以储存和释放Na+。另有研究[13]表明,高血压大鼠皮肤钠含量增加,一定程度上提示了皮肤作为钠存储的可能位置。
低盐饮食导致大鼠皮肤GAGs含量下降,组织间质的电荷密度及Na+结合位点下降,而高盐饮食可以刺激皮肤GAGs含量增加,以此增加与Na+结合的能力[14]。本实验结果显示模型组与对照组之间皮肤钠含量升高,皮肤含水量百分比差异无统计学意义,GAGs含量升高,提示Na+在皮肤中可能是与GAGs相结合,达到钠存储的目的,并且皮肤中增加的钠是以一种不引起渗透压改变的形式存在,不引起皮肤组织的含水量等相关变化。
相关研究[15]表明在鼠尾淋巴水肿模型中,VEGFC表达升高,VEGFC的过度表达导致淋巴水肿加重,增加可溶性VEGFR3可以阻断VEGFC表达,以此减轻水肿的发展。本实验结果表明,模型组大鼠肾皮质TonEBP、VEGFC、VEGFR3、LYVE-1蛋白表达升高,同时免疫荧光结果表明,模型组大鼠淋巴管密度升高。因此,推测NS过度重吸收Na+造成肾脏组织间质高渗微环境,激活TonEBP /VEGFC/ VEGFR3调节机制,将肾脏组织间质过多的Na+通过淋巴管回流至血液循环,通过血液循环,进而存储于皮肤组织间质GAGs网络中。此外,盐敏感性高血压小鼠给予VEGFC激动剂后,其肾脏和皮肤淋巴扩张,可以减轻盐敏感性高血压导致的肾脏损伤[8],即皮肤中的Na+储存可能是生物体在高盐饮食或面对高盐环境胁迫时的一种保护机制。
本研究结果指出NS大鼠Na+主要分布在血液、尿液和皮肤,初步证实了皮肤可能是Na+存储的位置。后期将对Na+在NS中如何进入并存储于皮肤中,皮肤中存储的Na+是否进入循环开展进一步的研究。
