猕猴肺成纤维细胞的不同分离培养方法及鉴定比较
2022-08-04蒋海峰刘潇一董婷玉檀学文严尚学
许 振,蒋海峰,张 磊,刘潇一,董婷玉,檀学文,严尚学,常 艳,魏 伟
肺部疾病是常见疾病,其中肺纤维化(pulmonary fibrosis,PF)和类风湿关节炎合并间质性肺病(rheumatoid arthritis with interstitial lung disease,RA-ILD)是难治疾病[1-2],其特征是成纤维细胞异常增殖,细胞外基质过度积累,炎症损伤和组织结构破坏,最终导致肺瘢痕形成、肺功能不全和呼吸衰竭,严重影响呼吸系统功能及呼吸能力。成纤维细胞是肺间质中最丰富的细胞类型,产生胶原蛋白、基质金属蛋白酶等细胞外基质。在维持肺结构和功能方面起着关键作用。成纤维细胞在损伤和炎症部位的增多对于组织修复至关重要,α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)是成纤维细胞的特征蛋白,肺成纤维细胞受促纤维化细胞因子TGF-β1的刺激后,α-SMA的表达水平会明显升高[3-5]。猕猴是最接近人的非人灵长类动物,其疾病发生的病理机制等相对于其他动物更接近于人,相比于小鼠、兔等实验动物能更直接地反映疾病发生和发展的病理过程,因此分离得到的原代猕猴肺成纤维细胞对于研究肺纤维化、类风湿关节炎合并间质性肺病等的病理机制至关重要[6-7]。该研究对两种用于分离猕猴肺成纤维细胞的方法进行了比较。第一种使用胶原酶联合消化+组织黏附法(后统称为胶原酶消化法),第二种是组织黏附法。此两种方法均可用于从肺组织中分离成纤维细胞。通过比较这两种方法,试图摸索出猕猴肺成纤维细胞的最佳分离方法及条件,为进一步在猕猴肺成纤维细胞的体外模型中开展实验提供更好的研究手段,为获得更接近人的原代肺成纤维细胞提供方法。
1 材料与方法
1.1 实验动物选取3~5岁普通级实验猕猴,饲养于安徽医科大学临床药理研究所实验动物中心。温度20~26 ℃;日温差≤4 ℃;相对湿度40%~70%。昼夜交替满足猕猴作息时间,饲料、水不受限制,通过瓜果蔬菜补充营养,定时为猕猴播放音乐及视频,严格遵守动物福利标准。实验动物购自旌德县皖南猕猴驯养繁殖基地,生产许可证号:SCXK(皖)2020-001;实验动物使用许可证号:SYXK(皖)2020-001。该实验过程得到安徽医科大学临床药理研究所动物伦理委员会批准(伦理批号:PT-2020-001)。
1.1 主要实验试剂及仪器青链霉素溶液(100×) 、0.125% 胰蛋白酶(含EDTA)、DAPI 染色液、抗荧光猝灭封片液购自上海 Beyotime 公司; DMEM培养基、RPMI-1640培养基和胎牛血清(fetal bovine serum,FBS) 购自以色列 Biological Industries公司; 凋亡试剂盒(AP105-60-kit,购自杭州联科生物公司);CCK-8(BS350A,购自合肥兰杰柯科技有限公司);α-SMA(兔抗单克隆抗体,ab32575,购自英国abcam公司)、GAPDH(兔抗单克隆抗体,美国Proteintech公司);BIO-RAD powerpack164-5070电泳仪(美国BIO-RAD公司);Image Quant化学发光成像系统(美国GE公司);倒置显微镜购自美国 GE Healthcare Life Sciences 公司; 实时荧光定量PCR仪购自美国Applied Biosystems公司; 十色流式细胞分析仪购自美国 Beckman Coulter公司。
1.2 猕猴肺成纤维细胞分离培养方法
1.2.1取材 获得猕猴肺组织后,取0.5 cm3体积的肺组织块放于预冷的无菌0.9%氯化钠溶液中,洗除血块、表面结缔组织和包膜后放于无菌EP管中,用无菌剪刀剪碎成小于1 mm3的组织块,将剪碎的组织块移至无菌的15 ml离心管中。
1.2.2组织黏附法 将剪碎的组织块放于15 ml离心管中,直接用(含20%FBS,1%青霉素G钠盐,10 mg/ml硫酸链霉素)高糖DMEM重悬组织块后用巴氏吸管将重悬的组织块均匀黏附在无菌细胞瓶中,注意黏附的组织块间隔大约1~2 mm。黏附组织块的细胞瓶中加入2 ml 20%DMEM后垂直放于37 ℃培养箱中。4 h后缓慢将细胞瓶放倒培养。
1.2.3胶原酶联合消化+组织黏附法 在装有剪碎组织块的15 ml离心管中加入2 ml的胶原酶(1 mg/ml Ⅰ型胶原酶+0.01 mg/ml Dnase1+RPMI-1640 培养基)和2 ml的0.125%胰酶消化液,并吹打3~4次后放于37 ℃恒温箱中震荡20 min,取出后静置5 min,尽量用无菌吸管吸出胶原酶后加入(含20%FBS,1%青霉素G钠盐,10 mg/ml硫酸链霉素)高糖DMEM培养基,用上述相同方法将组织均匀黏附在无菌细胞瓶中。放于培养箱中4 h后加入2 ml 20%血清的DMEM培养基培养。
1.2.3细胞培养及传代 两种方法在细胞瓶中将组织黏附后,待培养至第3天将培养基吸出,重新加入3 ml(含20%FBS,1%青霉素G钠盐,10 mg/ml硫酸链霉素)高糖DMEM。组织黏附法黏附的组织块在第9~10 天可得到单层细胞,在超净台中吸出培养基,用无菌PBS洗两遍尽量吹掉组织块,加入0.125%胰酶消化1 min后加入含有血清的DMEM培养基,反复吹打9~10次将细胞吹下,将收集的细胞悬液过滤后以1 500 r/min离心5 min,弃上清液加入20%血清的DMEM培养基重悬细胞转移至新细胞瓶中,在37 ℃培养箱中培养4~5 d可生长至70%~80%。胶原酶消化法在第6 天,用上述方法消化过滤得到细胞,过滤后的细胞在37 ℃培养箱中培养3~4 d即可生长至70%~80%。
1.3 肺成纤维细胞形态观察与鉴定
1.3.1形态学观察 倒置显微镜下观察细胞形态和生长状况。
1.3.2免疫荧光法检测α-SMA的表达 收集培养至第3代的细胞于24孔板中爬片24 h,室温固定封闭,100 μl PBS稀释α-SMA抗体4 ℃孵育一晚,第2天PBS洗三遍后加入荧光通道二抗孵育2 h,PBS洗三遍后加入DAPI室温孵育8 min,最后取出爬片滴加抗荧光淬灭剂固定在载玻片上,用激光共聚焦显微镜观察α-SMA蛋白的表达。
1.3.3流式检测细胞的纯度 消化收集第3代的肺成纤维细胞置1.5 ml EP管中,用PBS洗一遍后以50 μl PBS重悬细胞并加入α-SMA抗体孵育40 min,离心弃上清后50 μl PBS重悬加入通道二抗孵育30 min,离心去除上清后加入200 μl PBS在流式分析细胞仪中检测肺成纤维细胞的比例。
1.3.4CCK-8检测细胞活力 收集培养至第3代的细胞1×105个/孔接种于96孔板中。37 ℃培养24 h后加入刺激剂TGF-β1,6 h后96孔板中加入刺激剂的组和未加入刺激剂的组加入10 μl/孔CCK-8试剂,培养1 h后酶标仪检测波长为450 nm处的吸光度值。
1.3.5Western blot检测细胞α-SMA、IL-6和MMP-9的表达 收集细胞提取蛋白。配制10%的SDS-PAGE凝胶,上样电泳,转移至PVDF膜上,用含0.05%吐温20的PBS配制的5%脱脂牛奶37 ℃摇床封闭2 h,孵育一抗,4 ℃过夜,洗去一抗后,37 ℃孵育二抗后2 h后,洗去二抗,化学发光成像系统显影。采用Image J图像分析软件进行结果分析,测得条带的灰度值,计算各组的目的条带和内参GAPDH的比值以反映目的蛋白表达水平,比较各组间的差异。
1.3.6qPCR检测IL-6、MMP-9的表达 收集细胞,提取细胞RNA,逆转录得到cDNA后检测IL-6和MMP-9的表达。GAPDH(Rhesus monkey)F:5′-TGACAACAGCCTCAAGATCG-3′, R:5′-TGTGGTCA TGAGTCCTTCCA-3′; IL-6(Rhesus monkey)F:5′-CTC AGCCCTGAGAAAGGAGA-3′, R:5-ACCAGGCAAGT GTCCTCATT-3′;MMP-9(Rhesus monkey)F:5′-GAC AAGAAGTGGGGCTTCTG-3′,R:5′-CCGGCACTGAGG TATGATCT-3′。
1.4 流式检测细胞凋亡待细胞培养至第3代时,用胰酶将细胞消化至EP管中,将上清培养液与胰酶消化下来的细胞用凋亡试剂盒在流式分析仪上检测细胞凋亡。
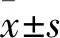
2 结果
2.1 不同方法提取原代猕猴肺成纤维细胞的形态学观察
2.1.1组织黏附法分离出的猕猴肺成纤维细胞的形态学观察 组织黏附法培养24 h后(图1A),组织块周围未见细胞爬出。72 h后,组织块周围逐渐爬出少量小圆形发亮的细胞。第4 天(图1B),组织块周围细胞逐渐变成梭形,但细胞呈零星分布。第7天,爬出的细胞逐渐范围扩大,细胞开始汇合生长,细胞开始全部变成长梭形,呈线性纺锤状。培养10 天左右,细胞基本上长满单层,占80%~90%,细胞大多数呈长梭形,少数呈多边形细胞。传代后的细胞接种于细胞瓶中48 h即可进入指数生长期,72 h后处于指数生长期,96 h生长可达到高峰。
2.1.2胶原酶消化法分离出的猕猴肺成纤维细胞的形态学观察 胶原酶消化法黏附的组织块培养24 h后,组织块周围逐渐爬出发亮的小圆形细胞(图1E)。培养48 h后,组织块周围小圆形细胞开始逐渐变为长梭形或三角形的细胞。72 h时组织块周围爬出的细胞几乎全部变成长梭形的细胞,爬出的细胞范围逐渐扩大。第4天时爬出的细胞基本上单层融合(图1F),多数细胞可见核分裂现象并聚集成团生长。第6 天时细胞快速生长汇合,约占细胞瓶的80%~90%,细胞连接紧密变得细长类似纺锤体,胰酶消化传代后的细胞接种于细胞瓶中30 min贴壁,24 h即可进入指数生长期,48 h后处于指数生长期,72 h生长可达到生长高峰。

图1 组织黏附法和胶原酶消化法24 h、第4天、第3代、第8代培养猕猴肺成纤维细胞的形态学观察 ×10
2.2 不同方法提取的原代猕猴肺成纤维细胞的鉴定
2.2.1流式检测α-SMA表达水平 细胞用分析流式标记α-SMA,结果显示两种方法提取的猕猴肺成纤维细胞表达α-SMA的比例均为11%左右,见图2A。
2.2.2免疫荧光检测α-SMA表达水平及分布情况 分离的原代猕猴肺成纤维细胞用免疫荧光标记α-SMA鉴定细胞,免疫荧光结果显示胶原酶消化提取的细胞表达α-SMA,主要分布在细胞质中;而组织黏附法提取的细胞α-SMA表达呈强阳性,同样也分布在细胞质中。给予TGF-β1刺激后,胶原酶联合消化的细胞α-SMA表达升高,而组织黏附法的细胞α-SMA表达变化不明显,见图2B。

图2 肺成纤维细胞α-SMA表达水平A:肺成纤维细胞间标流式标记α-SMA抗体;B:肺成纤维细胞免疫荧光α-SMA蛋白荧光观察
2.2.3凋亡试剂盒检测细胞凋亡率 收集不同传代周期点的细胞用凋亡试剂盒检测结果表明(图3),两种方法分离的细胞第2代和第3代的细胞凋亡率都在1%以下,第5代和第7代的凋亡率在2%左右。整体来看,两种方法提取的猕猴肺成纤维细胞第1代到第8代都没有明显早期凋亡(第四象限)和凋亡(第一象限),但是在第5代之后培养过程中死亡的细胞比较多(第二象限)。
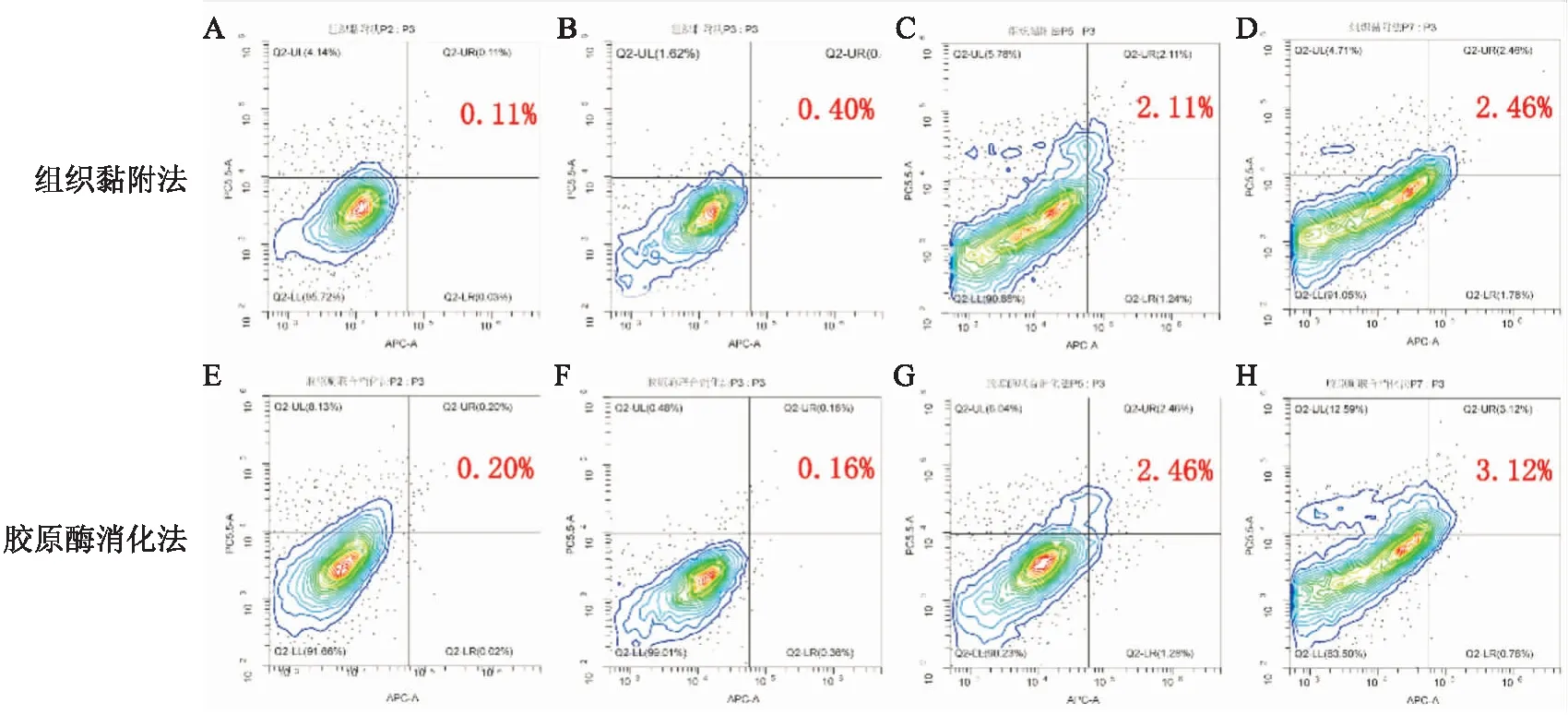
图3 肺成纤维细胞凋亡率检测
2.2.4CCK-8检测猕猴肺成纤维细胞的细胞活力 收集培养至第3代的细胞用CCK-8检测细胞活力。结果表明,胶原酶消化提取细胞的细胞活力高于组织黏附法提取的细胞。细胞同时加了TGF-β1刺激剂后,组织黏附法组的细胞加了刺激剂后细胞活力升高(F<13.556,P<0.05)。而胶原酶消化组的细胞活力与不加刺激剂组比较,细胞活力升高(F<15.007,P<0.01),见图4。
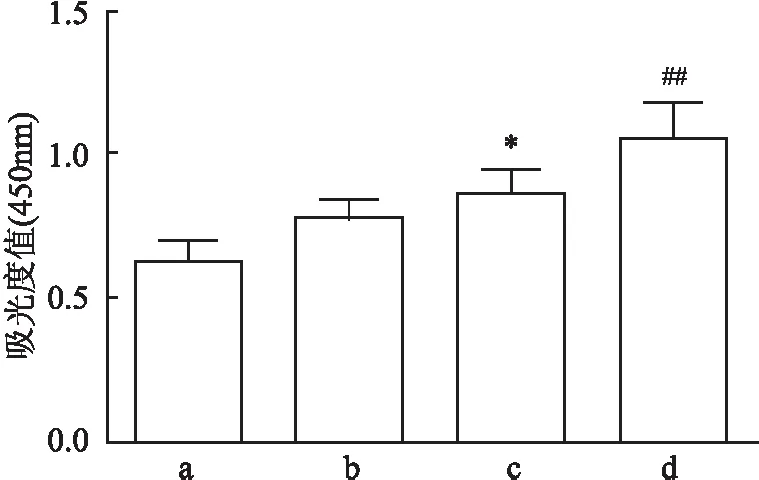
图4 肺成纤维细胞的细胞活力检测
2.5 Western blot检测猕猴肺成纤维细胞的α-SMA的表达提取出的细胞加入TGF-β1刺激,检测α-SMA蛋白的表达水平。结果显示,两种方法提取的细胞给予TGF-β1刺激后,与未加刺激的细胞相比α-SMA蛋白表达上升,胶原酶消化得到的细胞与加入刺激后相比具有统计学意义(P<0.05),见图5B。
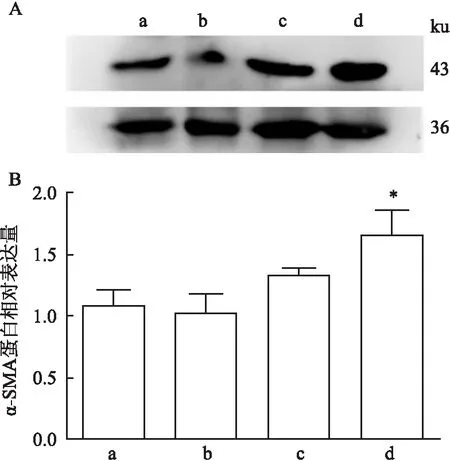
图5 猕猴肺成纤维细胞α-SMA蛋白表达
2.6 qPCR检测猕猴肺成纤维细胞MMP-9、IL-6基因表达提取两种细胞的总RNA,qPCR检测了MMP-9、IL-6 mRNA的表达,结果显示,两种方法提取的细胞都表达MMP-9和IL-6。胶原酶消化提取的细胞和组织黏附法提取的细胞MMP-9 mRNA表达水平基本无变化,IL-6 mRNA表达水平同样无明显差异。Western blot结果和PCR结果一致,两种蛋白在细胞上都有表达且无明显差异。
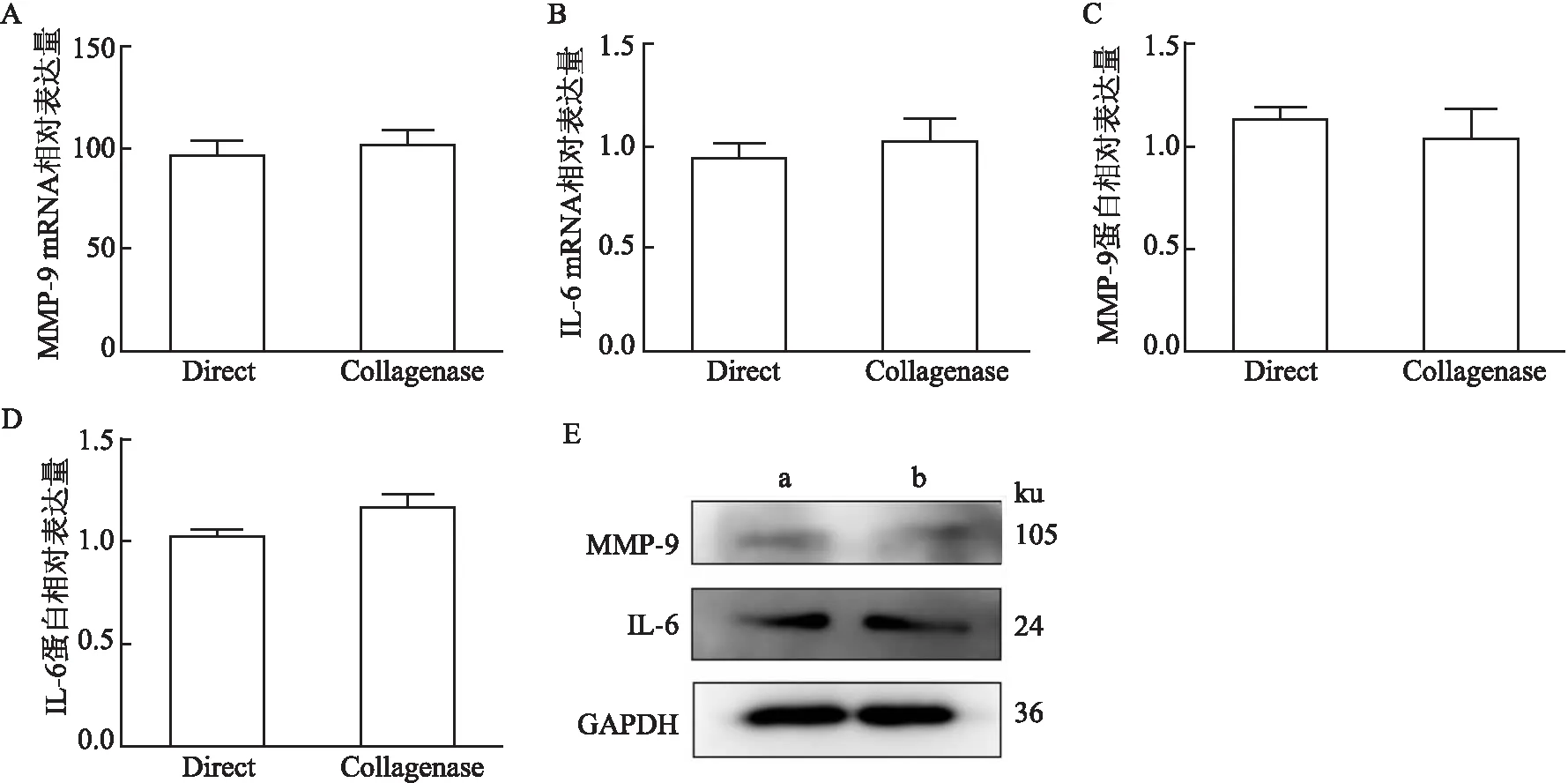
图6 猕猴肺成纤维细胞MMP-9、IL-6表达
3 讨论
人的肺组织结构复杂,分为五个肺叶,肺实质由许多不同的细胞组成,其中肺成纤维细胞是肺间质中最丰富的细胞类型[8]。成纤维细胞主要功能是产生Ⅰ型胶原蛋白和基质金属蛋白酶等细胞外基质。因此它们在维持肺结构和功能方面起着关键作用。肺部损伤和炎症部位的成纤维细胞对于组织修复至关重要。然而,成纤维细胞的增多会导致组织功能异常,并可能导致包括肺纤维化、慢性阻塞性肺病和哮喘在内的疾病。一直以来,动物疾病模型是我们研究间质性肺病诊断、机制及药物治疗必要手段,由于小鼠等实验动物与人的肺在大小、结构及分子水平的差异,迫切需要开发与人类相接近的肺模型。而猕猴是最接近人的非人灵长类动物,在许多疾病发生发展的病理机制中与人类具有很多相似之处,相较于大小鼠等动物具有更好的临床意义[9-10]。目前关于肺成纤维细胞功能的大部分知识都来自于从肺组织中分离出原代成纤维细胞的研究,如何在猕猴身上提取肺组织中的成纤维细胞对于今后在体外模型上开展相关实验具有重要意义。
前期查询了关于提取小鼠肺成纤维细胞的方法,但小鼠肺成纤维细胞在数量、功能和酶含量等与人存在异质性[11],猕猴肺成纤维细胞可以较好的在体外实验中代替人肺成纤维细胞。本实验总结了两种方法提取猕猴肺组织中的成纤维细胞并对此两种方法加以比较,试图为选择出更好的提取猕猴肺成纤维细胞的方法提供依据。组织黏附法是一种相对简单的方法,组织不加处理直接剪碎后黏附贴壁,但需要大约10 d才可得到单层细胞,由于细胞从组织中爬出时间较长,组织在长期培养中存在易污染、传代后细胞生长周期相对过长、生存代数少等缺点。胶原酶消化法是一种先胶原酶消化后再贴壁的方法,在6 d 左右即可得到单层细胞,消化传代后得到的细胞生长迅速,传代周期长(可传代8~9代)。但是需注意胶原酶消化过程中时间不宜太长,一般消化20~30 min即可,消化时间过长或浓度过高等因素都有可能损伤细胞,使组织块难以贴壁或细胞难以爬出。α-SMA是肺成纤维细胞的标志性蛋白,也是检测肺成纤维细胞功能性实验的主要手段。本文利用免疫荧光和Western blot实验结果表明组织黏附法得到的细胞α-SMA阳性表达更多,在TGF-β1刺激后α-SMA的表达同胶原酶消化得到的细胞刺激后相比上升趋势不明显。组织黏附法得到的细胞传代到第5代左右细胞体积变大、细胞状态差细胞活力低。肺组织中MMP-9升高能够参与肺内炎症修复和加速纤维化,另外IL-6水平下降后在小鼠模型中也可以加速肺部纤维化的发展[12],实验结果显示两种方法提取的细胞都有表达MMP-9 和IL-6,且表达无明显差异。胶原酶消化后得到的细胞表达α-SMA,TGF-β1刺激后α-SMA表达呈强阳性,是一种典型成纤维细胞形态特征,且提取出的猕猴肺成纤维细胞活性较好。
综上所述,本实验确立了两种可以分离出猕猴肺成纤维细胞的方法,分别是组织黏附法和胶原酶联合消化后组织块黏附法。通过多种研究方法比较相关的细胞特性,明确了胶原酶联合消化后组织黏附法分离出的猕猴肺成纤维细胞具有典型的形态特征和成纤维细胞的功能,并且用此法分离出的细胞活性更好,是一种较为可靠快速提取原代猕猴肺成纤维细胞的方法,为今后研究肺疾病获得更接近人的原代肺成纤维细胞提供方法,有助于为阐明人类肺部发育和疾病的潜在机制提供手段。
