血清HSP90α和癌组织基因HSP90AA1在肺癌中的高表达及预后价值
2022-08-04董晓玉叶元滋郑美娟沈继龙
董晓玉,钟 涛,叶元滋,郑美娟,沈继龙
肺癌严重威胁人类健康,是癌症相关死亡的主要原因,占全球因癌症死亡人数的五分之一[1]。2020年美国新增肺癌患者约12.9万人,其中肺癌病死率占全部因癌症致死率的45%,位居病死率首位[2]。肺癌患者中大约80%~85%确诊为非小细胞肺癌(non-small cell lung cancer,NSCLC),其中肺腺癌(lung adenocarcinoma,LUAD)和肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)是最常见的两种组织学亚型。早期发现NSCLC对于术后良好预后至关重要,因为肺癌Ib期的5年生存率可达68%[3],因此肿瘤标志物的监测对于肺癌的早期诊断和筛查具有优势。热休克蛋白(heat shock protein 90α,HSP90α)是近年来较热门的肿瘤筛查指标,它是调节细胞凋亡的关键因子,可在一系列癌症中高表达,有助于癌细胞的增殖、侵袭,例如乳腺癌、结直肠癌、肺癌、卵巢癌等,HSP90α可成为癌症的一个潜在标识物[4]。该文主要探索HSP90α及癌组织基因HSP90AA1的表达在肺癌早期诊断,以及疗效和预后中的临床应用价值。
1 材料与方法
1.1 一般资料选取2019年8月—2021年8月在安徽医科大学附属巢湖医院住院的109例肺癌患者为实验组,其中男81例,女28例,年龄41~87(69.62±9.99)岁。本研究肺癌纳入标准:所有患者均在初诊时行纤维支气管镜或肺穿刺等经病理确诊;未经化疗、放疗及手术的首诊患者。排除标准:合并其他恶性肿瘤患者。依据病理肺癌患者中鳞癌42例,腺癌41例,小细胞肺癌23例,神经内分泌癌2例,合并两种类型的肺癌(左肺鳞癌,右肺小细胞癌)1例。肺部炎症患者(包括肺部、支气管感染)36例为参照组,所有患者均符合临床诊断标准,其中男27例,女9例,年龄33~89(64.42±14.43)岁;对照组为安徽医科大学附属巢湖医院体检中心健康体检者30例,其中男14例,女16例,年龄48~92(58.73±8.73)岁。各组一般资料比较差异无统计学意义(P>0.05)。入选对象或家属均签署知情同意书。本研究经安徽医科大学附属巢湖医院伦理委员会批准(伦理编号:KYXM-202110-015)。
1.2 方法
1.2.1标本 所有入组人员均空腹静脉血2 ml,EDTA-K2抗凝,用于HSP90α和异常糖链蛋白(TAP)检测;另取静脉血4 ml,无添加剂,离心(4 000 r/min,8 min)后取血清进行肿瘤标志物检测。
1.2.2实验仪器和试剂 全自动化学发光仪MAGLUMI 2000 Plus及配套试剂盒检测鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCC),其参考区间临界值2.5 ng/ml为阳性判断标准;罗氏E601电化学发光仪及配套试剂盒检测胃泌素释放肽前体(prn-gastrinreleasing peptide,ProGRP)、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin 19 fragment,Cyfra21-1)、糖类抗原(carbohydrate antigen,CA72-4)、神经元特异性烯醇化酶(neuron-specific enolase,NSE),其参考区间临界值分别为85.7 pg/ml、5.0 ng/ml、3.3 ng/ml、8.2 U/ml、24.0 ng/ml为阳性判断标准;试剂为浙江瑞生医疗科技有限公司采用凝集法检测TAP,其参考区间临界值121.0 μm2为阳性判断标准;试剂为烟台普罗吉生物科技发展有限公司采用酶联免疫法检测HSP90α,其参考区间临界值82.06 ng/ml为阳性判断标准。
1.2.3HSP90AA1数据 通过癌症基因组图谱(the cancer genome atlas,TCGA)数据库下载数据,分析490例肺腺癌和485例肺鳞癌患者癌组织与癌旁正常组织的HSP90AA1表达。通过Survminer包中surv-cutpoint函数计算得出HSP90AA1最优分界点,将腺癌、鳞癌分为高低两组,比较两组HSP90AA1与患者临床参数的关系,同时行Cox比例风险回归分析,探究肺癌患者生存的独立危险因素。
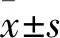
2 结果
2.1 实验组、参照组、对照组HSP90α的比较三组间血清HSP90α水平比较有意义(Z=77.69,P<0.01)实验组高于参照组和对照组(P<0.01),而参照组和对照组间无差异,见图1。以炎症组和体检组为阴性组,肺癌组为阳性组作ROC曲线,判断HSP90α在肺癌中的诊断效能,其曲线下面积为0.898(0.850,0.945)。以HSP90α>82.06 ng/ml为阳性判断标准,其诊断肺癌的灵敏度为79.80%,特异度为97.10%,见图2。
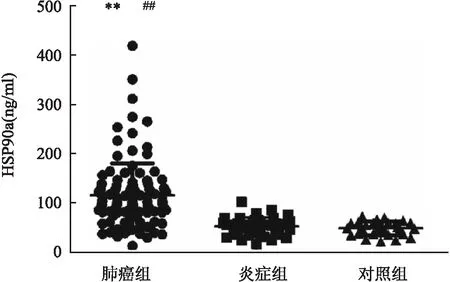
图1 实验组、参照组、对照组HSP90α的比较
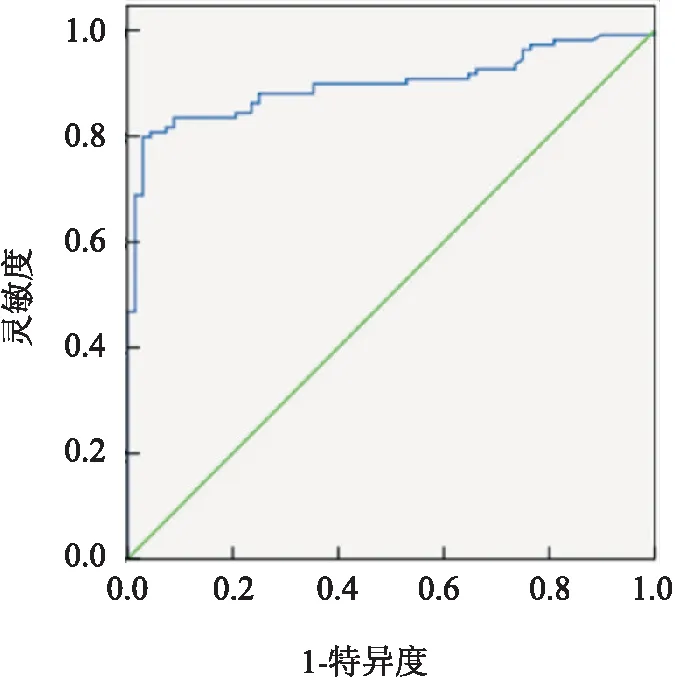
图2 HSP90α诊断肺癌的ROC曲线与对照组比较:**P<0.01;与炎症组比较:##P<0.01
2.2 实验组HSP90α水平与肺癌其他临床参数的关系血清HSP90α在NSE阳性患者中表达高于NSE阴性者(χ2=6.594,P<0.05);HSP90α与患者的其他临床参数无明显相关性,见表1。

表1 血清HSP90α水平与肺癌其他临床指标的关系(n=109)
2.3 实验组HSP90α水平与疗效的关系肺癌患者在治疗过程中,持续监测血清HSP90α水平,当影像学检查提示肿瘤组织缩小或临床病情缓解,HSP90α水平较初诊结果降低(t=4.428,P<0.01);影像学检查提示肿瘤组织进一步增大或有远处转移提示病情进展,HSP90α水平较初诊结果增高(t=3.173,P<0.01)。见图3。
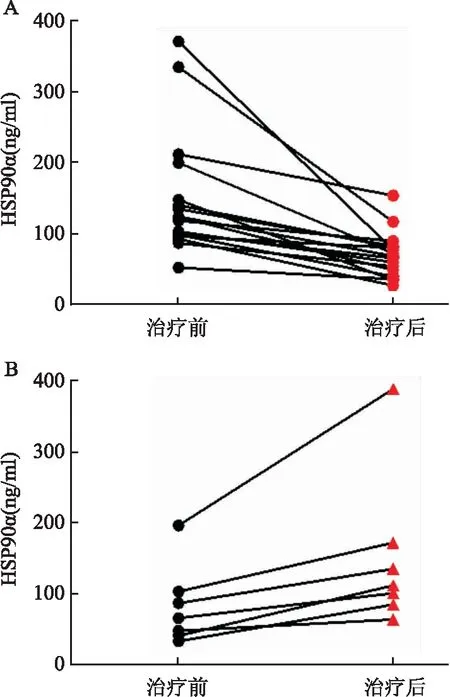
图3 各时期血清HSP90α水平
2.4 血清HSP90α水平在肺腺癌、肺鳞癌、小细胞肺癌中的表达血清HSP90α水平在三组间表达有意义(Z=6.058,P<0.05);腺癌组为92.88(62.13,122.61)ng/ml,其表达低于鳞癌组104.30(85.82,141.44)ng/ml和小细胞肺癌组123.73(89.64,135.08)ng/ml(P<0.05),而鳞癌组和小细胞肺癌组间血清HSP90α水平无差异(P>0.05),见图4。
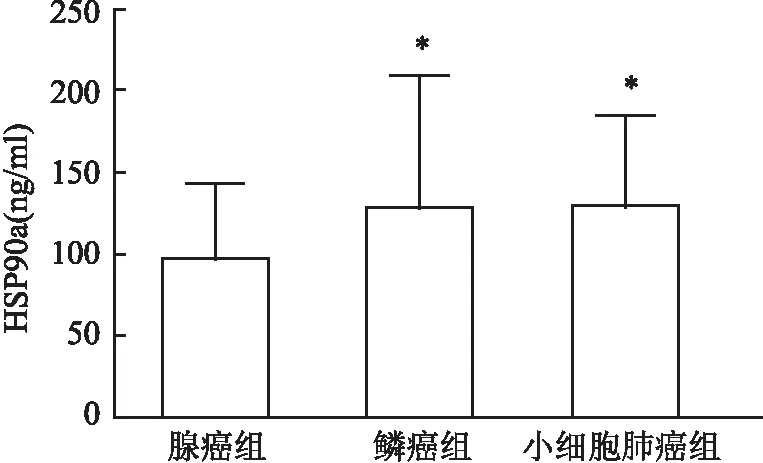
图4 血清HSP90α水平在肺腺癌、肺鳞癌、小细胞肺癌中的表达与腺癌组比较:*P<0.05
2.5 HSP90AA1在肺腺癌和肺鳞癌组织中的表达HSP90α由基因HSP90AA1表达,通过TCGA分析490例肺腺癌和485例肺鳞癌患者癌组织与癌旁正常组织的HSP90AA1表达。肺腺癌和鳞癌患者,癌组织中HSP90AA1表达均高于癌旁(F=11.61,P<0.01;F=51.28,P<0.01);腺癌组织中HSP90AA1水平表达低于鳞癌组(F=58.36,P<0.01),见图5。由于小细胞肺癌发病率较低,TCGA没有足够的数据,故HSP90AA1在小细胞肺癌组未进行分析。
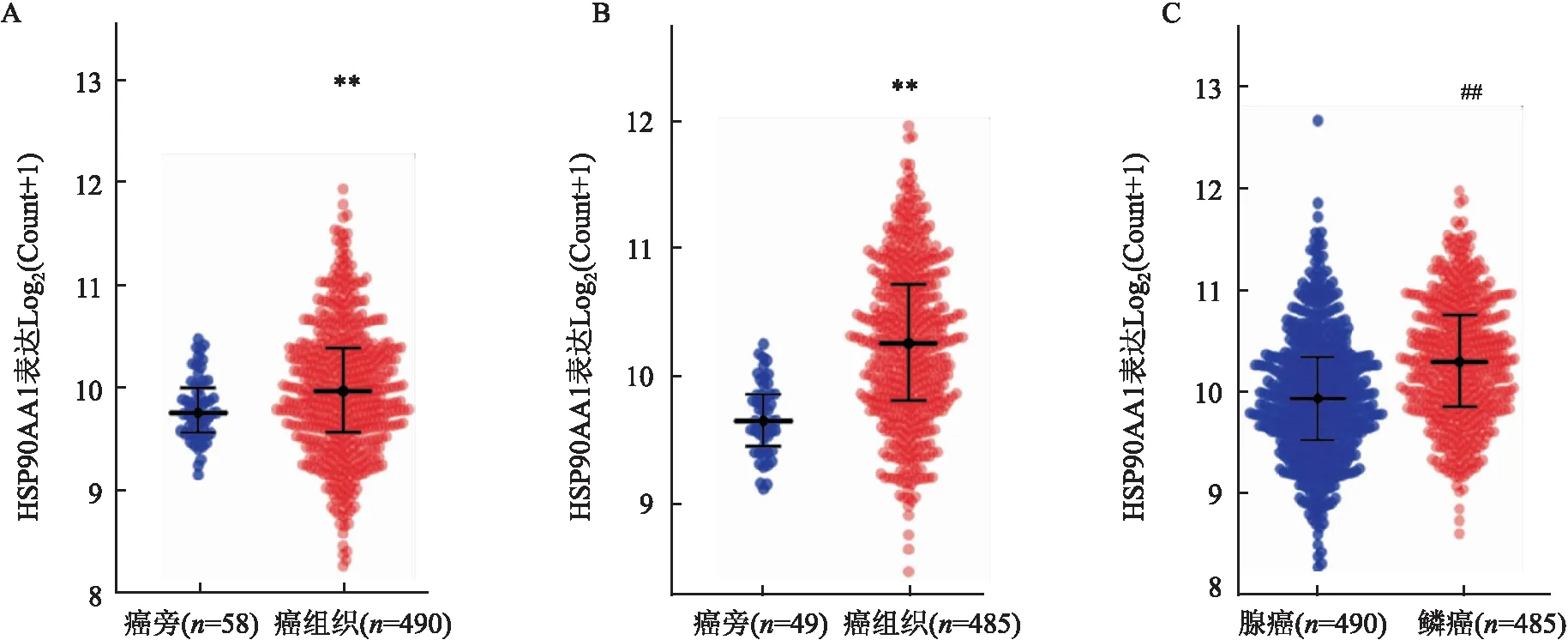
图5 HSP90ΑA1在肺腺癌和肺鳞癌组织中的表达
2.6 肺癌患者临床参数与HSP90AA1表达的分析通过Survminer包中surv-cutpoint函数计算得出HSP90AA1最优分界点,将腺癌、鳞癌分为高低组,比较HSP90AA1在癌组织中高表达组和低表达组与患者临床参数的关系。两组患者HSP90AA1表达水平与年龄、性别、肿瘤分期、肿瘤残余均无关。腺癌患者的生存状态、疾病进展与HSP90AA1表达相关(P<0.05),见表2;鳞癌患者的生存状态与癌组织中HSP90AA1表达无关,而疾病进展与之相关(P<0.01),见表3。提示癌组织HSP90AA1高表达者易复发。
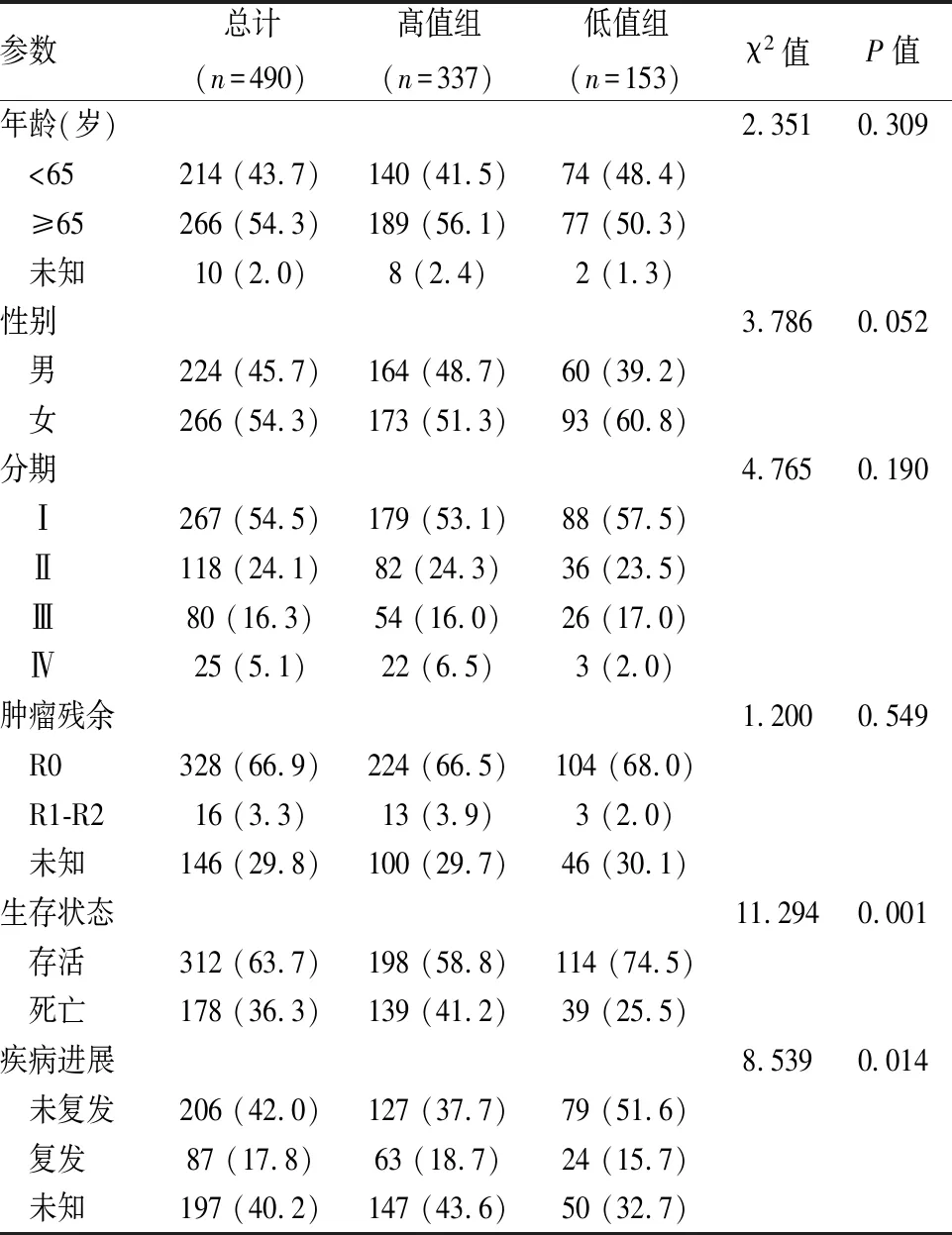
表2 腺癌HSP90AA1与临床参数的关系[n(%)]
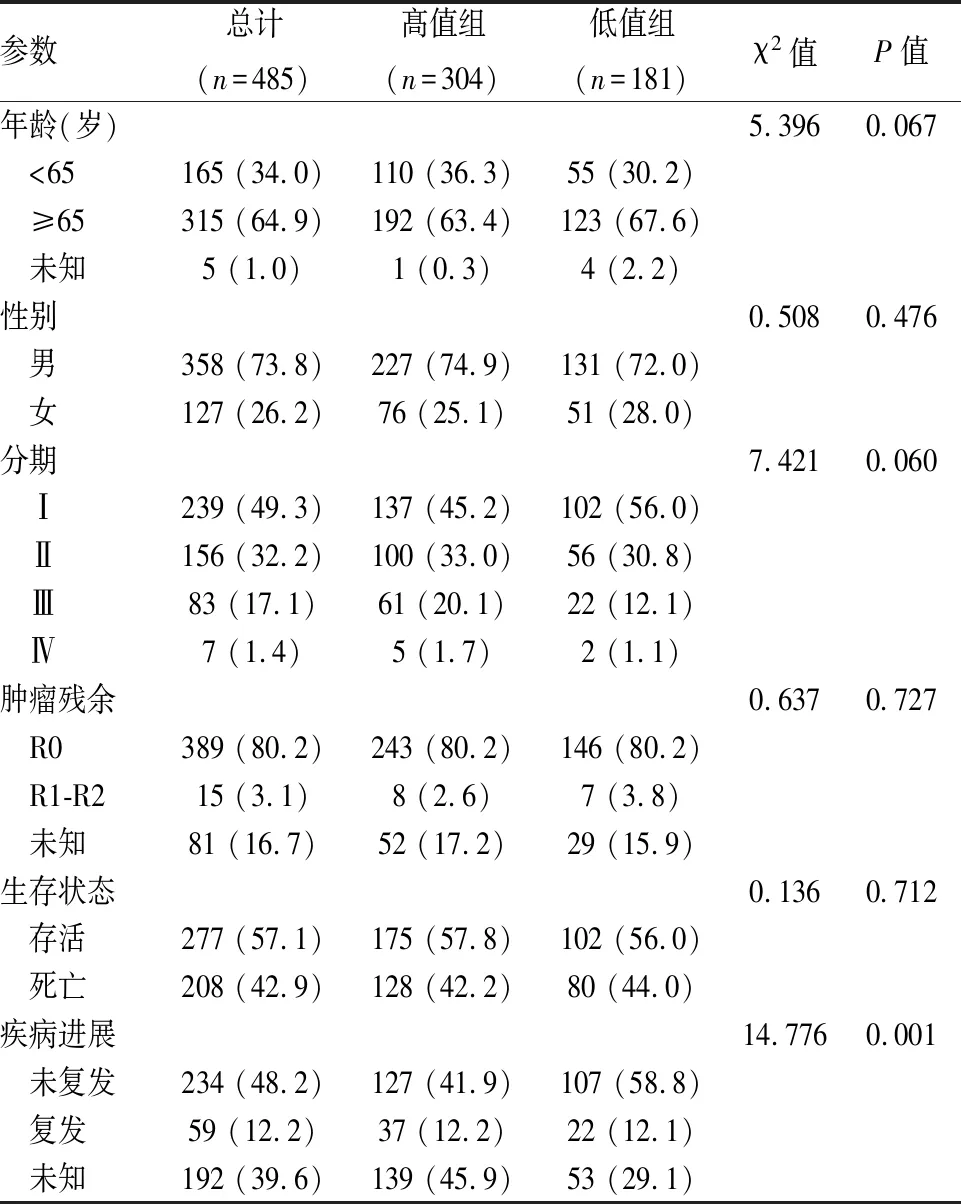
表3 鳞癌HSP90AA1与临床参数的关系[n(%)]
2.7 HSP90AA1在癌组织中的表达水平与患者预后评估通过K-M生存曲线,对患者的整体生存率(OS)、无病生存率(DFI)进行分析,腺癌患者HSP90AA1高表达者OS和DFI均低于低表达组(P<0.05),而鳞癌患者癌组织HSP90AA1表达与其预后没有统计学意义,但高表达者无病生存期有降低趋势,见图6。
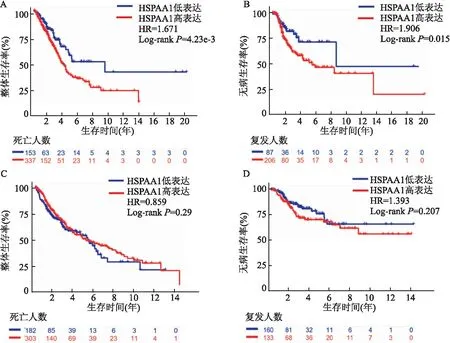
图6 HSP90AA1在癌组织中的表达水平对患者的预后分析A:肺腺癌患者的OS分析;B:肺腺癌患者的DFI分析;C:肺鳞癌患者的OS分析;D:肺鳞癌患者的DFI分析
2.8 HSP90AA1表达水平是肺癌患者的独立预后因素单因素分析显示肺腺癌的TNM分期、肿瘤残余、HSP90AA1表达水平是患者的独立预后因素(P<0.05),而患者年龄、性别与预后不相关(P>0.05);将上述因素纳入多因素Cox回归模型分析,TNM分期、肿瘤残余、HSP90AA1的高表达是肺腺癌患者的独立预后因素(P<0.05),见表4。肺鳞癌患者的TNM分期(Ⅲ期、Ⅳ期)、HSP90AA1表达水平是患者的独立预后因素(P<0.05),而患者年龄、性别、TNM分期(I期、Ⅱ期)、肿瘤残余与预后不相关(P>0.05);多因素Cox回归模型分析显示鳞癌患者的TNM分期(Ⅲ期、Ⅳ期)、HSP90AA1表达水平是肺磷癌患者的独立预后因素,见表5。
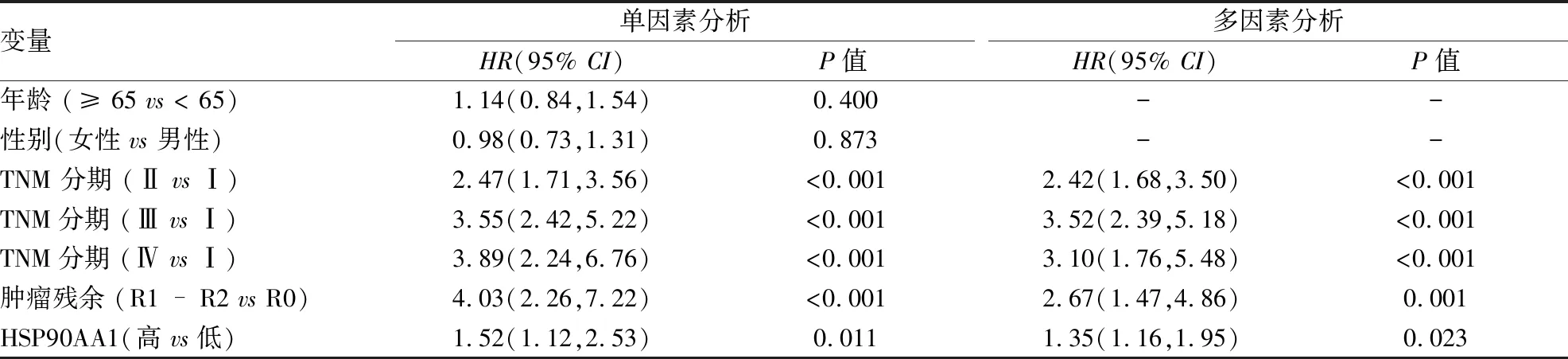
表4 影响肺腺癌患者OS的单因素和多因素Cox回归分析(n=490)
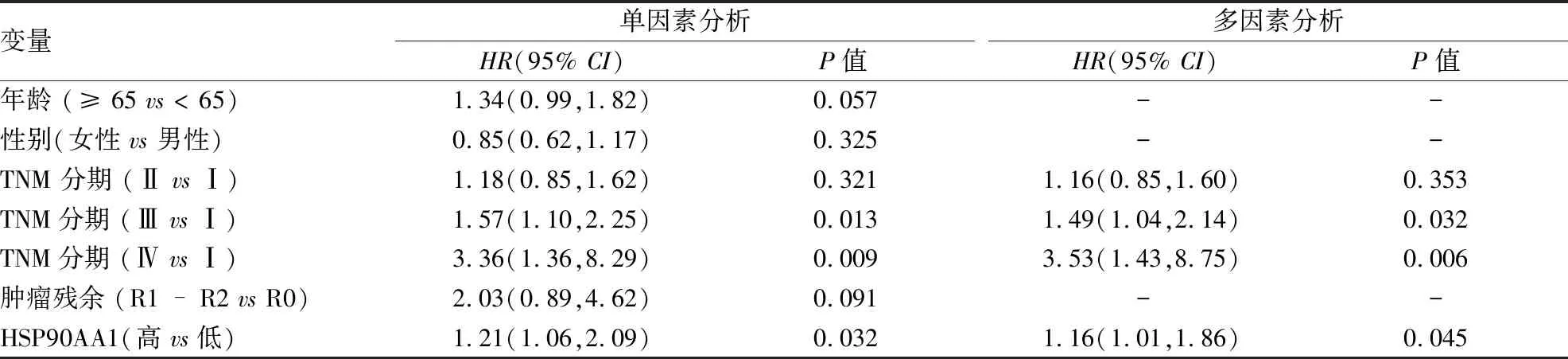
表5 影响肺鳞癌患者OS的单因素和多因素Cox回归分析(n=485)
3 讨论
HSP存在于所有生物体中,是一种高度保守的ATP依赖性分子伴侣,它参与蛋白质的重塑和激活,负责蛋白质翻译后的折叠和稳定性,促进细胞生长和增殖[5]。HSP90底物蛋白大多是过度表达或突变的基因,如p53基因、表皮生长因子受体、间质表皮转化因子等蛋白[6],因此HSP90促进恶性肿瘤且获得耐药性,亦被称作“致癌成瘾基因”[7]。HSP90有HSP90α和HSP90β两个亚型,它们在细胞内、外水平极低;当机体微环境处于缺氧、损伤、氧化等状态,细胞内HSP90α和HSP90β释放到细胞外,仅HSP90α可变异分泌,由肿瘤细胞持续分泌至细胞外[8]。故检测HSP90α及其特异性抗体水平在癌症诊断中发挥重要作用。
该研究比较了肺癌组、肺部炎症组、健康对照组的血清HSP90α水平,肺癌患者HSP90α水平显著高于其他两组(P<0.01);ROC曲线亦表明HSP90α在肺癌中有较高的诊断价值。近年多项研究[9-10]揭示HSP90α在肺癌患者的血清、癌组织中均上调,且其上调与肺癌的发生、发展和转归密切相关;相反,抑制Hsp90可通过复杂的信号通路抑制癌细胞的增殖、运动和转移。一份包含2 247名患者的队列研究[11]显示肺癌患者血浆HSP90α水平显著升高,且与患者分期相关。HSP90α与肺癌其他辅助诊断标志物进行比较,109例肺癌患者86例HSP90α阳性,占比78.89%,除Cyfra21-1阳性率(80.73%),其余指标阳性率比均低于HSP90α;有3例患者肺癌筛查指标均阴性,仅HSP90α阳性,可见HSP90α对肺癌的辅助诊断有临床价值。HSP90α联合传统肺癌辅助标志物可提高其检出率,从而早发现早治疗[12]。另有研究报道[13]检测患者的肺泡灌洗液,HSP90α的诊断效率优于Cyfra21-1和NSE。该研究发现腺癌组血清HSP90α水平相对于鳞癌、小细胞肺癌较低,这与其基因HSP90AA1在肿瘤组织中的表达相似。多项研究显示HSP90α在NSCLC患者中比在对照个体中更丰富[6]。许 露 等[14]报道HSP90α联合患者临床资料对NSCLC的EGFR突变有预测价值。
由于该研究临床资料有限,为获得更多HSP90α在肺癌中表达的相关资料,通过TCGA分析了基因HSP90AA1在近千例肺癌组织中的表达。癌组织中HSP90AA1表达均高于癌旁(P<0.01),且腺癌组织中HSP90AA1水平表达低于鳞癌组织(P<0.01), Wang et al[15]报道HSP90AA1是促进肺鳞癌进展的相关基因。数据分析显示HSP90AA1在肺腺癌和鳞癌组织中的表达与患者年龄、性别、肿瘤分期均无关;腺癌患者的生存状态与癌组织中HSP90AA1表达相关,且HSP90AA1高表达患者OS和DFI均降低;肺鳞癌患者的生存分析显示与HSP90AA1高表达虽无统计学意义,但整体有降低的趋势。单因素和多因素Cox回归分析亦发现HSP90AA1的表达水平是肺癌患者的独立预后因素。从HSP90AA1的基因表达可以推断出HSP90α与肺癌患者的生存和预后相关,但仍需大量的临床数据支持。
该研究持续监测肺癌患者治疗过程中血清HSP90α水平,当患者肿瘤组织缩小或病情缓解期HSP90α水平较初诊结果降低;反之则增高。可见血清HSP90α水平可以监测肿瘤患者的疗效。Zhong et al[6]研究结果显示HSP90α可被认为是晚期NSCLC化疗的有价值预测因子,其水平与化疗后肿瘤缓解呈正相关。Shi et al[11]亦报道HSP90α可以预测肺癌患者对化疗的反应。
综上所述,HSP90α及HSPAA1在肺癌患者中高表达,当患者病情缓解,血清HSP90α水平降低,反之则增高;癌组织HSPAA1高表达患者预后不良。HSP90α可作为肺癌的一种辅助诊断指标,以及对肺癌的进展、疗效和预后观察具有一定的临床价值。这些为肺癌治疗的新方法—HSP90α抑制剂作为靶向药物提供了理论依据,一系列HSP90α抑制剂的设计、合成,目前已取得突破性的进展,有望应用于临床。
