结扎诱导牙周炎大鼠脑内炎性及β淀粉样蛋白变化的实验研究
2022-08-04刘珂珂胡韶光吕代雨查贤芳孙晓瑜
刘珂珂, 胡韶光,吕代雨,查贤芳,孙晓瑜,徐 燕
牙周炎是一种由菌斑微生物引起的慢性感染性疾病,其临床病理表现为牙龈炎症、牙周袋形成、牙槽骨吸收、牙齿松动移位[1],研究[2]表明Toll样受体4(toll like receptors-4,TLR4) /NF-κB信号通路在其病情发展中起重要作用。近年来,越来越多的研究表明牙周炎与阿尔茨海默病(Alzheimer’s disease,AD)具有相关性[3-4]。
AD是最常见于老年人的中枢神经系统退行性疾病,其主要病理特征为脑组织中的β淀粉样蛋白(amyloid-beta protein,Aβ)异常聚集形成淀粉样斑块、过度磷酸化的tau蛋白形成神经纤维缠结伴随着神经元变性等[5]。研究[6]表明慢性炎症参与Aβ的产生和积累,导致tau蛋白过度磷酸化、神经原纤维缠结病变、神经元变性死亡。该研究通过探讨实验性牙周炎大鼠脑内炎症因子及Aβ水平的变化,以期为进一步探索两者之间关系奠定理论基础。
1 材料与方法
1.1 主要实验材料
1.1.1实验动物 普通清洁级健康SD雄性大鼠18只,体质量(350~400)g,18月龄,购自安徽医科大学动物实验中心并提供标准饲养,检查大鼠双侧上下颌第一磨牙牙周组织均正常,经由安徽医科大学实验动物伦理委员会批准(编号:20180159)。
1.1.2主要试剂与仪器 牙龈卟啉单胞菌(P.gingivalis,Pg) (标准菌株ATCC33277,广东省微生物菌种保藏中心);哥伦比亚血琼脂培养基(江门凯林贸易有限公司);厌氧培养箱(DonWhitleyDG250 Anaerobicworkstation,英国);维生素K1(上海麦克林生化科技有限公司);氯化血红素(青岛海博生物技术有限公司);TAK-242(美国MedChemExpress公司);二甲基亚砜(dimethyl sulphoxide,DMSO)(美国Sigma公司);TRIzol® Reagent (美国Invitrogen公司);PrimeScriptTMRT Master Mix逆转录试剂盒,TB Green® Premix Ex TaqTMqPCR试剂盒(日本Takara Bio公司);引物:GAPDH、白介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)均购自上海生工生物工程股份有限公司;实时荧光定量PCR仪(美国安捷伦,Mx3000P)等。
1.2 实验方法
1.2.1Pg的培养与鉴定 将Pg(ATCC33277)冻干粉用0.2 ml PBS充分溶解混匀,划线法接种于哥伦比亚血琼脂培养基中,置于厌氧培养箱中(37 ℃,混合气比例:80% N2、10% CO2、10% H2)培养5~7 d,待培养基表面长出黑色菌落,挑取单个直径约1 mm的菌落接种于5 ml BHI液体培养基(加入维生素K1及氯化血红素)进行扩增培养。
1.2.2大鼠实验性牙周炎模型的建立 18只SD大鼠随机分为3组(n=6),分组情况如下:① 空白对照(control)组:不做任何处理;② 慢性牙周炎(chronic periodontitis,CP)组:结扎双侧上颌第一磨牙辅以接种牙龈卟啉单胞菌;③ 慢性牙周炎+TAK-242(CP+TAK-242)组:结扎双侧上颌第一磨牙辅以接种牙龈卟啉单胞菌,腹腔注射TAK-242。
大鼠用2%戊巴比妥钠(2 ml/kg)腹腔注射麻醉后固定于操作板上,用4-0外科丝线结扎双侧上颌第一磨牙牙颈部,定期检查结扎丝线在位情况,松脱者及时重新结扎。结扎1周后将Pg以1×108CFU/ml的浓度接种到结扎部位,每只大鼠每次接种150 μl,每3 d接种1次,共接种5次,整个建模时间共6周。TAK-242溶于1% DMSO生理盐水溶液, 使其终浓度为0.5 mg/ml,腹腔注射TAK-242 (0.5 mg/kg),每周2次,持续到实验结束。实验时间轴如图1所示。
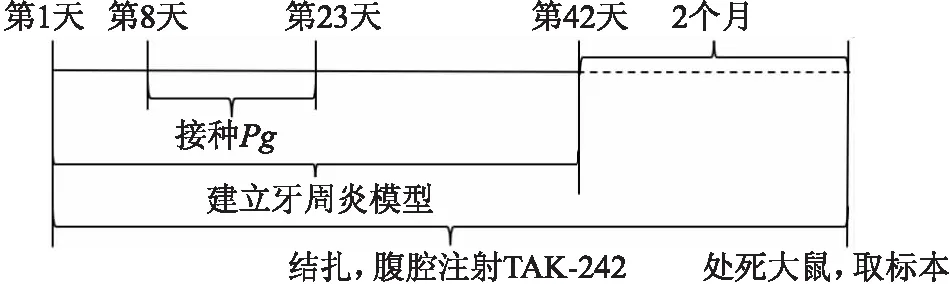
图1 时间轴线图
1.2.3大鼠海马组织和牙周组织取材 大鼠腹腔注射2%戊巴比妥钠麻醉后立即进行断头取脑,低温快速分离两侧海马于1.5 ml Eppendorf管中,-80 ℃冰箱保存备用。分离牙槽骨和牙龈组织,将牙龈组织放置在1.5 ml Eppendorf管中,-80 ℃冰箱保存备用;上颌骨于4%多聚甲醛溶液中固定,保存备用。
1.2.4Micro-CT分析大鼠牙槽骨组织破坏情况 大鼠颌骨样本经4%多聚甲醛溶液固定后,采用Micro-CT扫描,三维重建,用相应软件测量每只大鼠双侧上颌第一磨牙釉牙骨质界(cemento-enamel junction, CEJ)至牙槽嵴顶的距离即为牙槽骨丧失量(alveolar bone loss, ABL),每颗实验牙分别测量颊侧和腭侧近中、正中、远中六个位点,取六个位点的均值作为该牙的牙槽骨丧失值。
1.2.5实时荧光定量PCR(qPCR)检测大鼠牙龈组织和海马组织中炎症因子及海马组织中TLR4/NF-κB信号通路关键因子mRNA表达 取部分冻存的牙龈组织和海马组织,室温下溶解,于预冷的PBS中清洗去除血渍,加入适量TRIzol试剂裂解组织,收集并测定RNA浓度,使用PrimeScriptTMRT Master Mix 逆转录试剂盒将RNA逆转录成cDNA。以cDNA为模板,GAPDH为内参基因,上PCR仪检测,相对mRNA水平通过2-ΔΔCt方法定量计算。引物序列见表1。

表1 基因引物序列
1.2.6ELISA检测大鼠海马组织中炎症因子及Aβ40和Aβ42蛋白表达 取部分冻存的海马组织,室温下溶解,于预冷的PBS中清洗去除血渍,滤纸吸干,称取重量,加入预冷的PBS(pH 7.4),组织与PBS的质量体积比为1 ∶10,用玻璃研磨器将组织标本充分研磨(冰上操作),4 ℃离心20 min(2 000~3 000 r/min),仔细收集上清液,ELISA法检测大鼠海马组织中IL-6、IL-1β和TNF-α及Aβ40和Aβ42的蛋白表达水平。
2 结果
2.1Pg形态学观察肉眼观Pg呈黑色,圆形凸起, 表面光滑;革兰染色呈阴性杆菌,红色。确认Pg无污染后,在厌氧环境下于BHI液体培养基中继续培养48 h, 12 000 r/min离心5 min,将离心后底部沉淀用无菌PBS重悬2次,将菌液浓度调整为1×108CFU/ml备用,稀释后的菌液在15 min内完成接种。
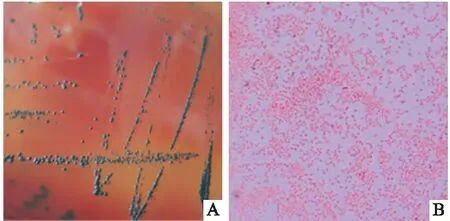
图2 Pg形态学观察 A:肉眼观;B:革兰染色 ×100
2.2 实验性牙周炎大鼠的牙槽骨吸收Micro-CT扫描图像显示,CP组与对照组相比,上颌第一磨牙牙槽骨高度明显降低;腹腔注射TAK-242组的大鼠牙槽骨吸收程度较CP组明显减少,见图3A~C。牙槽骨丧失测量结果显示,CP组的牙槽骨丧失量较对照组明显增加(F=602.776,P<0.000 1);腹腔注射TAK-242组大鼠牙槽骨丧失量较CP组明显减少(F=524.042,P<0.000 1)(图3D)。这些结果表明牙周炎模型的建立是成功的,腹腔注射TAK-242预处理可减少由结扎辅以涂菌所诱导的牙周炎导致的牙槽骨丧失。
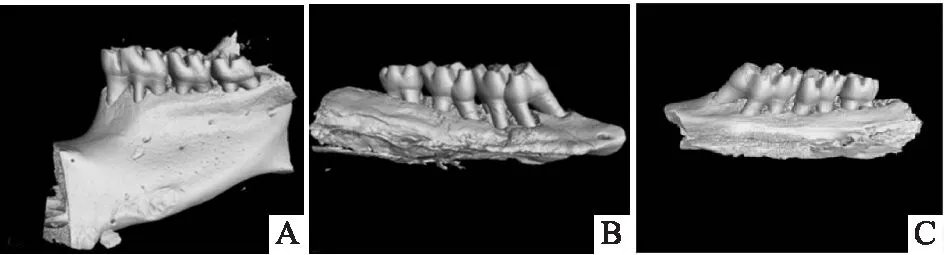
图3 Micro-CT所示大鼠左侧上颌骨三维重建模型A:control组; B:CP组; C:CP+TAK242组
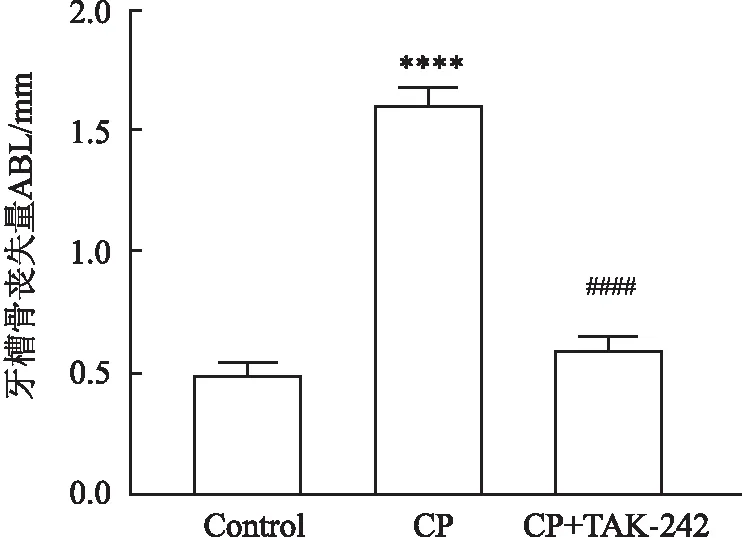
图3D 大鼠上颌第一磨牙牙槽骨丧失量
2.3 实验性牙周炎大鼠牙龈组织中促炎因子mRNA表达水平的变化如图4所示,与对照组相比,CP+TAK-242组大鼠牙龈组织中各炎症因子的mRNA表达水平均无统计学差异(FIL-6=0.076,P=0.792;FIL-1β=1.113,P=0.332;FTNF-α=0.601,P=0.468);但与对照组相比,结扎和涂菌诱导可明显上调实验大鼠牙龈组织中炎症因子的表达,差异有统计学意义(FIL-6=71.491,P<0.000 1;FIL-1β=218.941,P<0.000 1;FTNF-α=1 217.952,P<0.0001);而腹腔注射TAK-242组可降低炎症因子的表达,差异有统计学意义(FIL-6=54.902,P<0.000 1;FIL-1β=157.674,P<0.000 1;FTNF-α=72.380,P<0.000 1)。
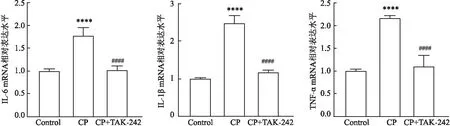
图4 实验性牙周炎大鼠牙龈组织中促炎因子IL-6、IL-1β和TNF-α mRNA表达水平变化与Control组比较:****P<0.000 1;与CP组比较:####P<0.000 1
2.4 实验性牙周炎大鼠海马组织中促炎因子mRNA表达水平的变化如图5所示,对照组与CP+TAK-242组大鼠海马组织中各炎症因子的mRNA表达水平均无统计学差异;与对照组相比,CP组大鼠海马组织中炎症因子的表达升高,且有统计学意义(FIL-6=335.140,P<0.000 1;FIL-1β=265.642,P<0.000 1;FTNF-α=74.089,P<0.001);CP+TAK-242组的大鼠与CP组相比,炎症因子的表达降低,差异有统计学意义(FIL-6=105.213,P<0.000 1;FIL-1β=154.694,P<0.000 1;FTNF-α=68.954,P<0.000 1)。

图5 实验性牙周炎大鼠海马组织中促炎因子IL-6、IL-1β和TNF-α mRNA表达水平变化 与Control组比较:***P<0.001,****P<0.000 1;与CP组比较:####P<0.000 1
2.5 实验性牙周炎大鼠海马组织中促炎因子蛋白表达水平的变化如图6所示,与对照组相比,CP+TAK-242组大鼠海马组织中各炎症因子的蛋白表达无明显变化;但CP组大鼠较对照组,海马组织中炎症因子的蛋白表达均升高,差异有统计学意义(FIL-6=622.007,P<0.000 1;FIL-1β=302.341,P<0.000 1;FTNF-α=120.823,P<0.001)。与CP组相比,CP+TAK-242组炎症因子的蛋白表达均降低,差异有统计学意义(FIL-6=499.412,P<0.000 1;FIL-1β=263.800,P<0.000 1;FTNF-α=113.363,P<0.000 1)。
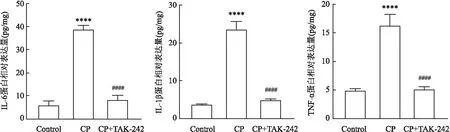
图6 实验性牙周炎大鼠海马组织中促炎因子IL-6、IL-1β和TNF-α蛋白表达水平变化与Control组比较:****P<0.000 1;与CP组比较:####P<0.000 1
2.6 实验性牙周炎大鼠海马组织中TLR4/NF-κB信号通路关键因子mRNA表达水平的变化如图7所示,与对照组相比,CP组大鼠海马组织中该通路关键因子的mRNA表达均升高,差异有统计学意义(FTLR4=86.983,P<0.0001;FCD14=174.724,P<0.0001;FNF-κB=25.822,P<0.001);与CP组相比,CP+TAK-242组这些因子的表达降低,且差异有统计学意义(FTLR4=103.068,P<0.0001;FCD14=67.325,P<0.0001;FNF-κB=23.631,P<0.001)。
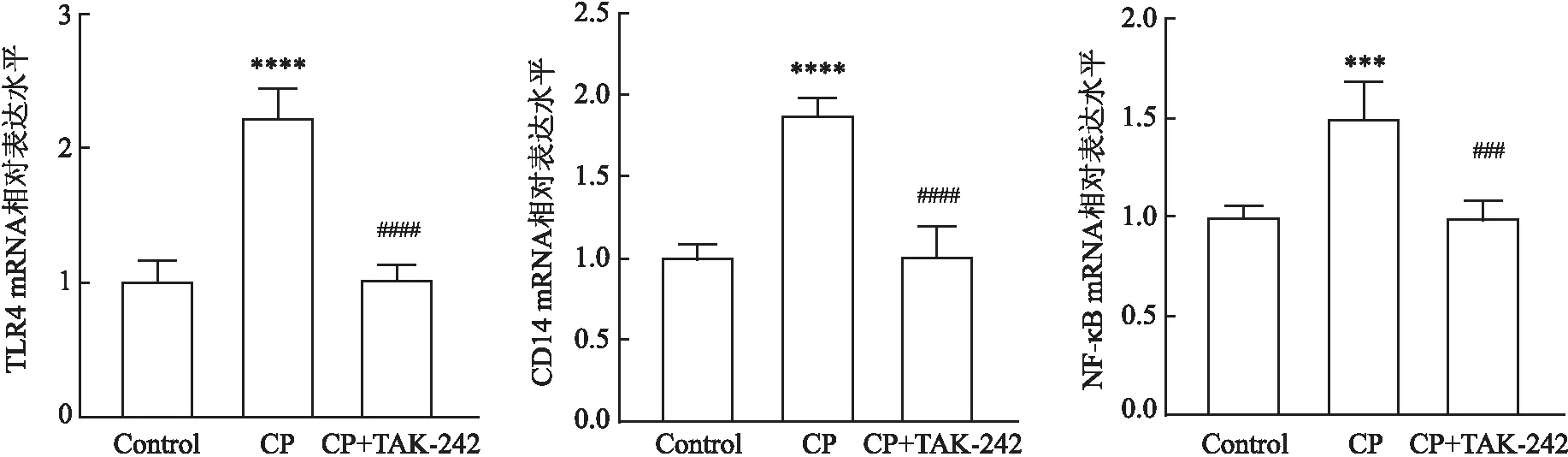
图7 实验性牙周炎大鼠海马组织中TLR4/NF-κB信号通路关键因子TLR4、CD14和NF-κB mRNA表达水平变化与Control组比较:***P<0.001,****P<0.000 1;与CP组比较:###P<0.001,####P<0.000 1
2.7 实验性牙周炎大鼠海马组织中Aβ40和Aβ42蛋白表达水平的变化如图8所示,CP组大鼠海马组织中Aβ40的蛋白表达量高于对照组,但差异无统计学意义(FAβ40=1.653,P=0.246);CP+TAK-242组Aβ40的蛋白表达量虽低于CP组,但差异无统计学意义(FAβ40=1.348,P=0.290)。与对照组相比,CP组Aβ42的蛋白表达升高,差异有统计学意义(FAβ42=30.152,P=0.002);CP+TAK-242组Aβ42的蛋白表达较CP组降低,差异有统计学意义(FAβ42=17.222,P=0.006)。

图8 实验性牙周炎大鼠海马组织中Aβ40和Aβ42蛋白表达水平变化与Control组比较:**P<0.01;与CP组比较:##P<0.01
3 讨论
牙周炎作为细菌(包括其毒力因子)和宿主炎症反应相互作用的结果,具有明显的炎症特征,炎症程度越重,牙周组织破坏程度也越重[7]。随着牙周医学的发展,越来越多的研究表明牙周炎与全身慢性炎症性疾病具有共同的潜在致病机制,牙周炎可能通过增加全身细胞因子的水平而成为全身疾病(如认知障碍)的重要危险因素[8]。
目前,牙周炎和AD的相互关系仍处于流行病学和临床病例对照研究阶段,潜在的病理机制尚未阐明。以往的动物实验研究多采用由特定病原体感染或其毒力因子作用建立模型(如牙龈卟啉单胞菌及其毒力因子牙龈卟啉单胞菌脂多糖),研究[9-10]表明腹腔注射或局部应用牙龈卟啉单胞菌脂多糖可通过激活TLR4/NF-κB信号通路引起实验大鼠的认知功能障碍,但这些建模方式具有局限性,不能模拟临床牙周炎的自然发展。该实验通过结扎大鼠上颌第一磨牙辅以牙龈卟啉单胞菌接种这一公认的方法建立实验性牙周炎大鼠模型,更类似于临床牙周炎。实验大鼠结扎后所有实验牙均探诊极易出血,探诊深度增加;Micro-CT扫描结果显示,实验大鼠结扎后牙槽骨吸收明显,说明牙周炎模型成功建立。
作为炎症的主要触发因素之一,TLR4/NF-κB信号通路在牙周炎的病理发展中起重要作用,被激活的NF-κB信号通路可以启动细胞因子的转录及翻译,从而释放出大量的炎症因子,抑制TLR4/NF-κB通路关键因子的活化可能是炎症治疗的作用靶点[2]。TAK-242作为TLR4信号传导抑制剂,可以下调TLR4下游信号分子MyD88的表达,抑制炎症因子的释放,从而抑制炎症进程[11]。该研究发现实验性牙周炎大鼠海马组织中炎症因子IL-6、IL-1β和TNF-α及TLR4、CD14和NF-κB的表达水平增加, TAK-242 预处理可以减弱已被上调的上述因子的表达,说明实验性牙周炎可上调大鼠脑组织内炎症因子的表达,进而促进神经炎症的发生。
AD最重要的病理变化之一是脑内Aβ异常沉积形成老年斑,Aβ40和Aβ42是最常见的两种亚型,具有病理意义的Aβ42是淀粉样斑块的主要成分,Aβ40不会引起病理性积聚[6]。研究发现成年野生型小鼠在长期口服牙龈卟啉单胞菌脂多糖后出现神经退行性变和海马组织中Aβ42的积聚[12]。该项研究发现实验性牙周炎大鼠海马组织中Aβ40的表达无明显变化,但具有神经毒性的Aβ42的表达增加,腹腔注射TAK-242预处理可以逆转这一变化。
该实验结果显示,通过结扎大鼠双侧上颌第一磨牙辅以接种牙龈卟啉单胞菌的方法成功建立的实验性牙周炎大鼠模型,其海马组织中炎症因子IL-6、IL-1β和TNF-α及Aβ42的表达增加,而腹腔注射TAK-242预处理可降低这些因子的表达。TAK-242作为TLR4信号传导抑制剂可以通过下调TLR4/NF-κB信号通路, 从而降低炎症因子的释放, 起到降低神经毒性的作用。该实验为通过控制或减轻牙周炎症从而缓解AD病理变化提供理论依据,为进一步探究牙周炎与AD的相互关系提供理论支持。
