BMPER 通过Wnt/β-catenin 信号通路减轻高糖高脂对MC3T3-E1 细胞成骨分化的抑制
2022-08-02刘峥谢云
刘峥,谢云
(天津医科大学朱宪彝纪念医院老年病科,天津市内分泌研究所,国家卫生健康委员会激素与发育重点实验室,天津市代谢性疾病重点实验室,天津 300134)
随着生活水平的提高和寿命的延长,2 型糖尿病(T2DM)和骨质疏松症的患病率都在增加[1]。许多研究表明,糖尿病与各种骨骼疾病有关,包括骨质疏松、骨微结构破坏和骨折率增加等[2-3]。糖尿病性骨质疏松发生的主要原因是营养条件的变化和代谢微环境改变等[4-5]。
骨形态发生蛋白内皮细胞前体来源调节因子(BMPER)最初在对果蝇胚胎内皮前体差异表达蛋白的筛选中被发现,不同情况下对骨形态发生蛋白的作用具有刺激和拮抗作用[6]。BMPER 基因敲除小鼠的骨骼和软骨发育异常[7]。BMPER 基因突变在透明椎体发育不良和坐骨棘骨发育不良中也有报道,这两种疾病均导致骨骼发育不良表型[8-9]。这一发现提示BMPER 可能参与成骨过程。目前关于BMPER在糖尿病条件下对成骨分化的作用及机制仍不清楚,因此,本研究旨在探究在糖尿病条件下BMPER在成骨分化中的生物学作用。
1 材料与方法
1.1 材料与仪器 小鼠前成骨细胞MC3T3-E1 细胞购自武汉普诺赛生命科技公司;α-MEM 培养基、胎牛血清、青-链霉素和胰蛋白酶均购自美国Gibco公司;辣根过氧化物酶标记山羊抗兔IgG(货号:LK2001)、β-actin 抗体(货号:KM9001)购自天津三箭生物技术公司;Active β-Catenin 抗体(货号:19807)购自美国Cell Signaling Technology 公司;Runx2 抗体(20700-1-AP)、Wnt3a 抗体(货号:26744-1-AP)、Wnt1 抗体(货号:27935-1-AP)购自美国Proteintech 公司;BMPER 抗体(ab73900)购于英国Abcam公司;Ⅰ型胶原α1(Col1α1)抗体(BS70155)购自美国Bioworld 公司;BCIP/NBT 碱性磷酸酯酶染色试剂盒(货号:C3206)、BCA 蛋白浓度测定试剂盒(货号:P0012S)购自上海碧云天生物技术公司;β-甘油磷酸酯和抗坏血酸购自美国Sigma 公司。低温高速离心机购自德国Eppendorf 公司;恒温金属浴购自杭州博日科技公司;凝胶成像仪购自上海天能公司;CO2恒温培养箱购自美国赛默飞公司。
1.2 细胞培养及传代 MC3T3-E1 细胞在加入10%胎牛血清、1 %青-链霉素的α-MEM 培养基中培养。细胞置于37℃,5%CO2的恒温培养箱中。每2~3 d更换1 次培养基。待细胞融合至90%左右,用0.25%胰蛋白酶消化细胞并传代。在成骨分化实验中,MC3T3-E1 细胞融合至80%时用成骨培养基(α-MEM 培养基中加入10%胎牛血清,5 mmol/L β -甘油磷酸酯和50 μg/mL 抗坏血酸)处理14 d,每3 d更换1 次培养基。
1.3 碱性磷酸酶(ALP)染色 将MC3T3-E1 细胞在成骨培养基中培养14 d,磷酸盐缓冲溶液(PBS)洗涤后,用4%多聚甲醛固定20 min,PBS 洗涤3 次,依照说明书使用BCIP/NBT 染色工作液室温避光染色30 min,去除BCIP/NBT 染色工作液,用蒸馏水洗涤2 次,终止显色反应,观察并记录。
1.4 细胞的分组及转染 将MC3T3-E1 细胞均匀接种于6 孔板中,每孔约1×105个细胞。当细胞增殖至70%~80%左右时吸掉旧培养基,用无菌PBS 洗涤2 次后,对细胞进行成骨诱导或转染。
1.4.1 成骨诱导 采用成骨培养基(OM)培养MC3T3-E1 细胞,诱导成骨分化。在成骨培养基中加入25 mmol/L 葡萄糖(HG)和0.25 mmol/L 棕榈酸(PA)模拟T2DM 环境,将MC3T3-E1 细胞分为对照(control)组、成骨诱导(OM)组和成骨诱导+高糖高脂(OM+HG/PA)组。
1.4.2 BMPER 过表达质粒转染 BMPER 过表达质粒及空载体对照质粒均委托美国GeneCopoeia 公司进行构建。将空载体对照质粒及BMPER 过表达质粒转染到MC3T3-E1 细胞中,将MC3T3-E1 细胞分为p-NC 和p-BMPER 组。采用Lipofectamine 3000试剂盒,根据转染说明书进行转染。
1.4.3 siRNA 转染 应用非特异性siRNA 及合成的靶向沉默BMPER 小干扰RNA(siRNA)转染MC3T3-E1 细胞,将细胞分为si-NC 组及si-BMPER组。以riboFECTTM 作为转染试剂,按照转染试剂盒说明进行siRNA 转染。
1.5 蛋白质印迹法检测各组蛋白表达水平 收集MC3T3-E1 细胞,用预冷的PBS 冲洗3 次,加入RIPA裂解液对各组细胞充分裂解,提取总蛋白,冰上孵育30 min,期间每10 min 混匀1 次。4℃,12 000 r/min,离心15 min,并通过BCA 蛋白检测试剂盒测定蛋白水平。蛋白经10%聚丙烯酰胺凝胶电泳(SDSPAGE)分离后,将蛋白质转移到聚偏二氟乙烯膜(PVDF)上,在室温下用5%脱脂牛奶封闭1 h。一抗β-actin(1:10 000)、active β-catenin(1:5 000)、Runx2(1:1 000)、Wnt3a(1:1 000)、Wnt1(1:1 000)、BMPER(1:1 000)、Col1α1(1:1 000)4℃孵育12~16 h。TBST 洗涤3 次,辣根过氧化物酶标记的二抗室温孵育1 h,TBST 洗涤3 遍后使用ECL 试剂盒进行化学发光显影,使用蛋白凝胶成像仪拍照。应用Image J 软件进行分析。以β-actin 为内参,目的条带灰度值与β-actin 灰度值之比表示蛋白表达水平。
1.6 统计学处理 利用GraphPad Prism 8.0 进行统计分析,正态分布的计量资料采用±s 表示结果。两组独立样本比较采用t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 高糖高脂环境抑制MC3T3-E1 细胞成骨分化 成骨诱导14 d 后,OM 组Runx2 蛋白水平较对照(control)组显著升高(t=11.628,P<0.05,图1A),而HG/PA 处理后显著降低(t=7.572,P<0.05,图1A)。此外,OM 组Col1α1 蛋白水平较对照组显著升高(t=12.202,P<0.05,图1B)。与OM 组相比,HG/PA处理后Col1α1 蛋白水平显著降低(t=8.568,P<0.05,图1B)。与OM 组相比,OM+HG/PA 组ALP 染色减轻(图1C)。
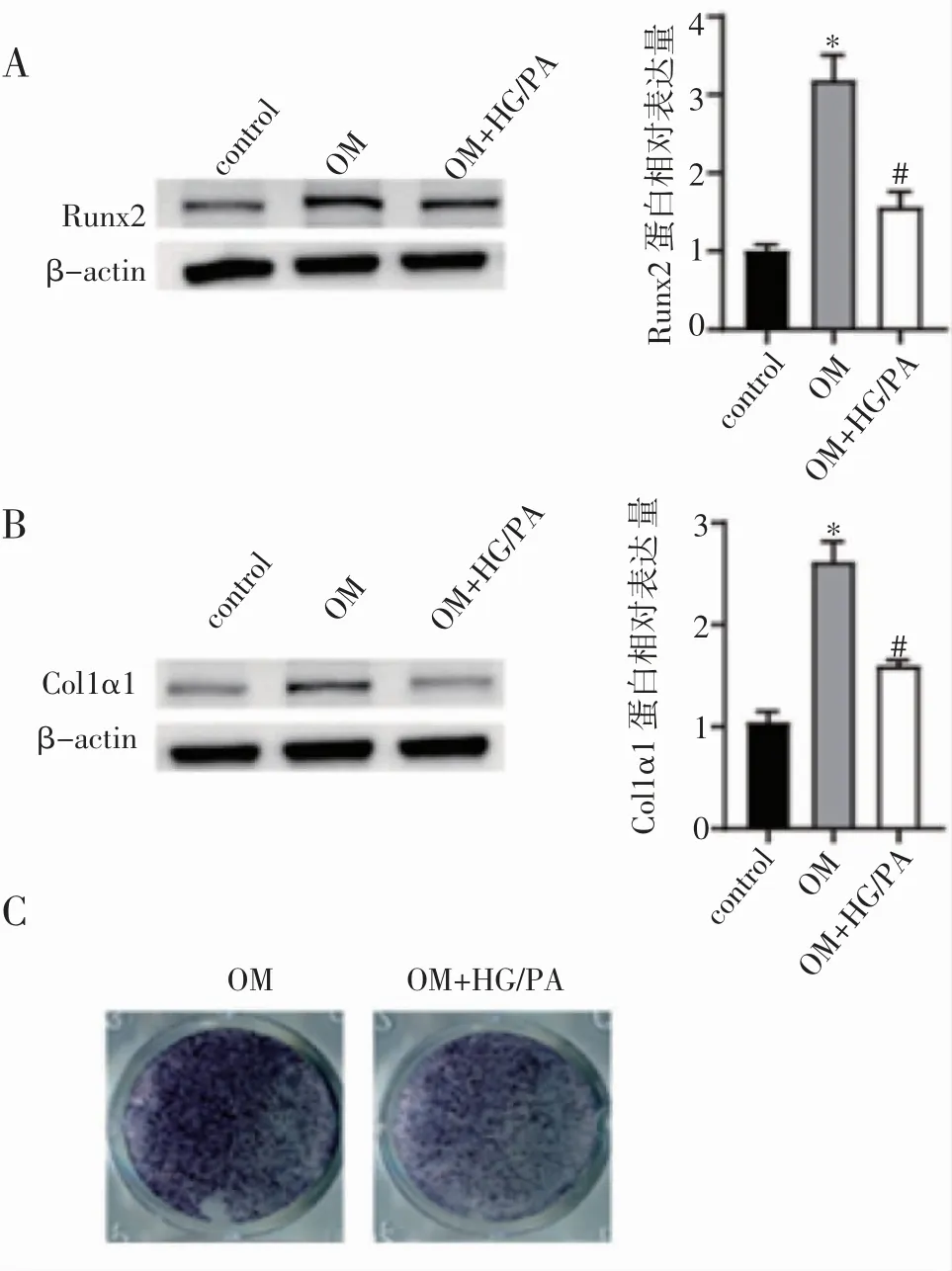
图1 高糖高脂环境抑制MC3T3-E1 细胞成骨分化Fig1 HG/PA inhibited the osteogenic differentiation of MC3T3-E1 cells
2.2 BMPER 在高糖高脂环境中表达降低 成骨培养基诱导MC3T3-E1 细胞成骨分化6 d 后,OM 组BMPER 蛋白表达水平与对照组比较无明显差异(P>0.05)。OM 成骨分化14 d 后,与对照组相比,OM 组BMPER 蛋白表达水平显著升高(t=8.535,P<0.05),见图2A。与OM 组相比,OM +HG/PA 组BMPER 蛋白表达水平显著降低(t=10.742,P<0.05),见图2B。
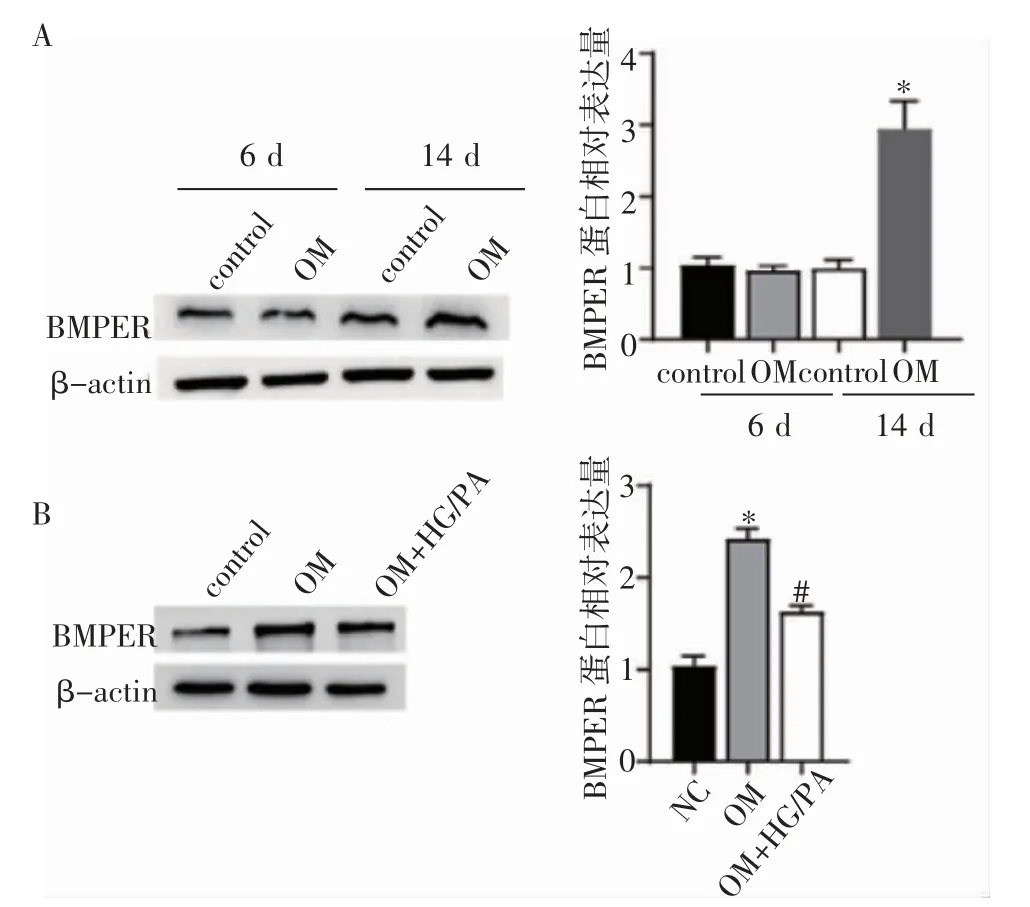
图2 BMPER 在高糖高脂环境中表达降低Fig 2 The expression of BMPER decreased in HG/PA conditions
2.3 BMPER 过表达促进成骨分化 Western 印迹显示p-BMPER 组BMPER 蛋白水平较p-NC 组明显升高(t=7.181,P<0.05),见图3A。在高糖高脂环境中,成骨分化后,与p-NC 组相比,p-BMPER 组Runx2和Col1α1 表达水平升高(t=9.816、8.331,P<0.05,图3B)。与p-NC 组相比,p-BMPER 组碱性磷酸酶(ALP)染色加深(图3C)。
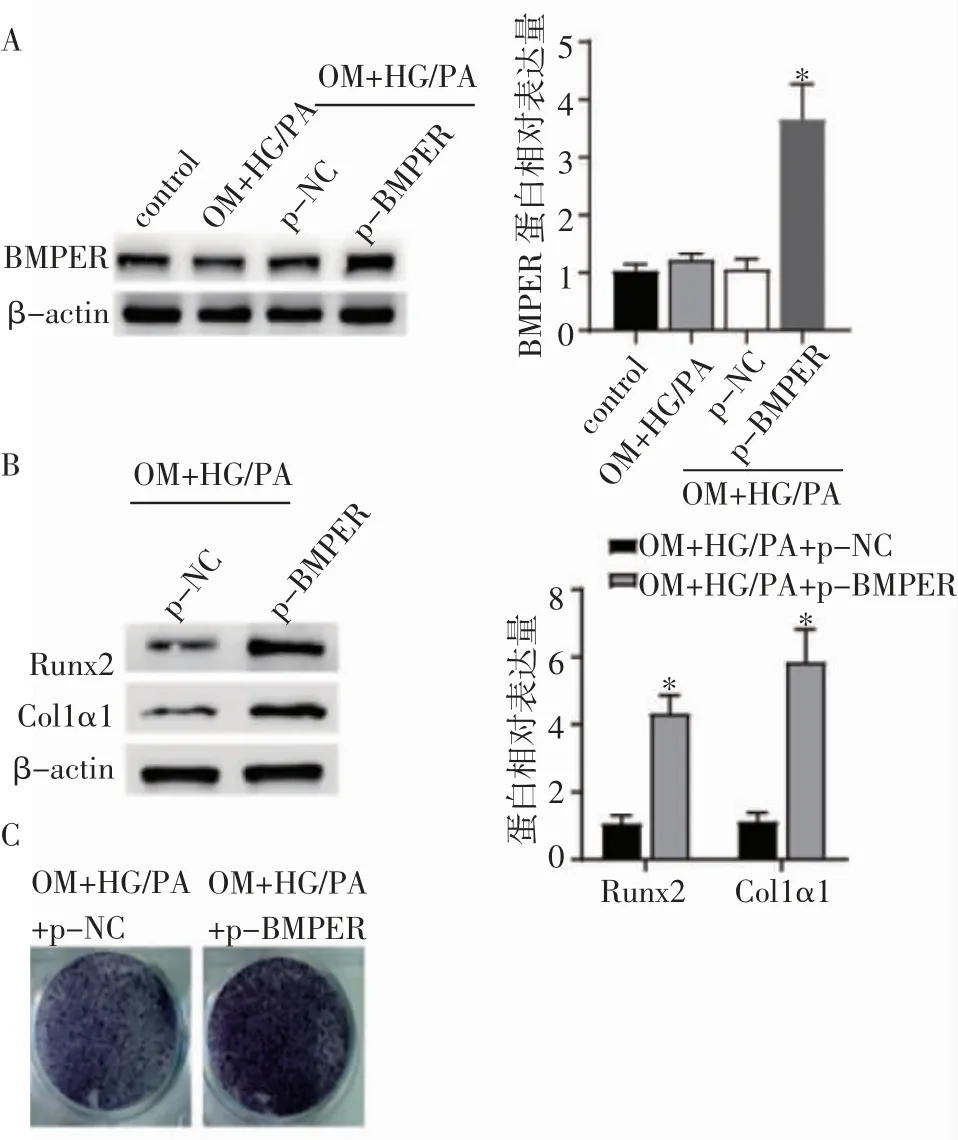
图3 BMPER 过表达促进成骨分化Fig 3 Osteogenic differentiation facilitated by the overexpression of BMPER
2.4 BMPER 过表达上调Wnt/β-catenin 信号通路 Western 印迹结果显示,BMPER 在MC3T3-E1细胞中过表达(t=13.023,P<0.05),见图4A。与p-NC组相比,p-BMPER 组MC3T3-E1 细胞中Wnt1、Wnt3a、activeβ-catenin 显著上调(t=8.413、14.343、9.156,均P<0.05),见图4B。
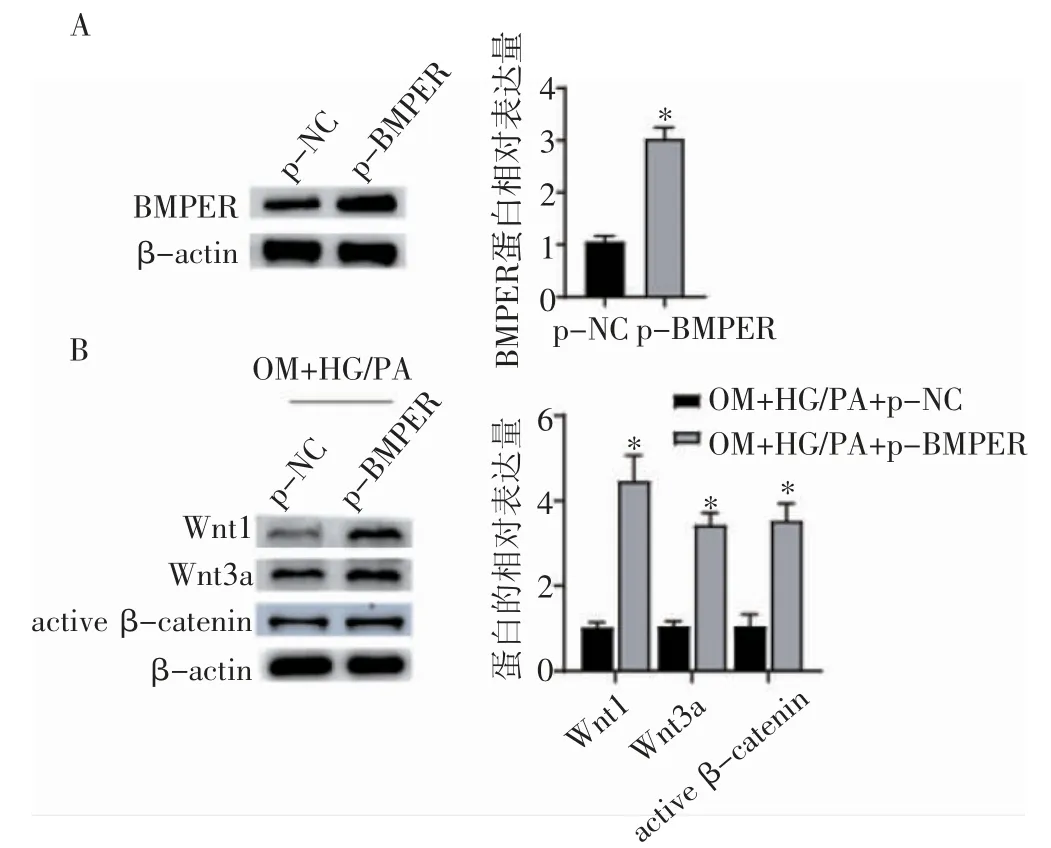
图4 BMPER 过表达上调Wnt/β-catenin 信号通路Fig 4 Wnt/β-catenin signaling pathway promoted by the overexpression of BMPER
2.5 BMPER 下调抑制Wnt/β-catenin 信号通路 Western 印迹结果显示,与si-NC 组相比,si-BMPER 组MC3T3-E1 细胞中BMPER 显著下调(t=6.911,P<0.05),见图5A。与si-NC 组相比,si-BMPER 组MC3T3-E1 细胞中Wnt1、Wnt3a、active β-catenin 的表达水平显著降低(t=10.807、8.678、10.167,均P<0.05),见图5B。
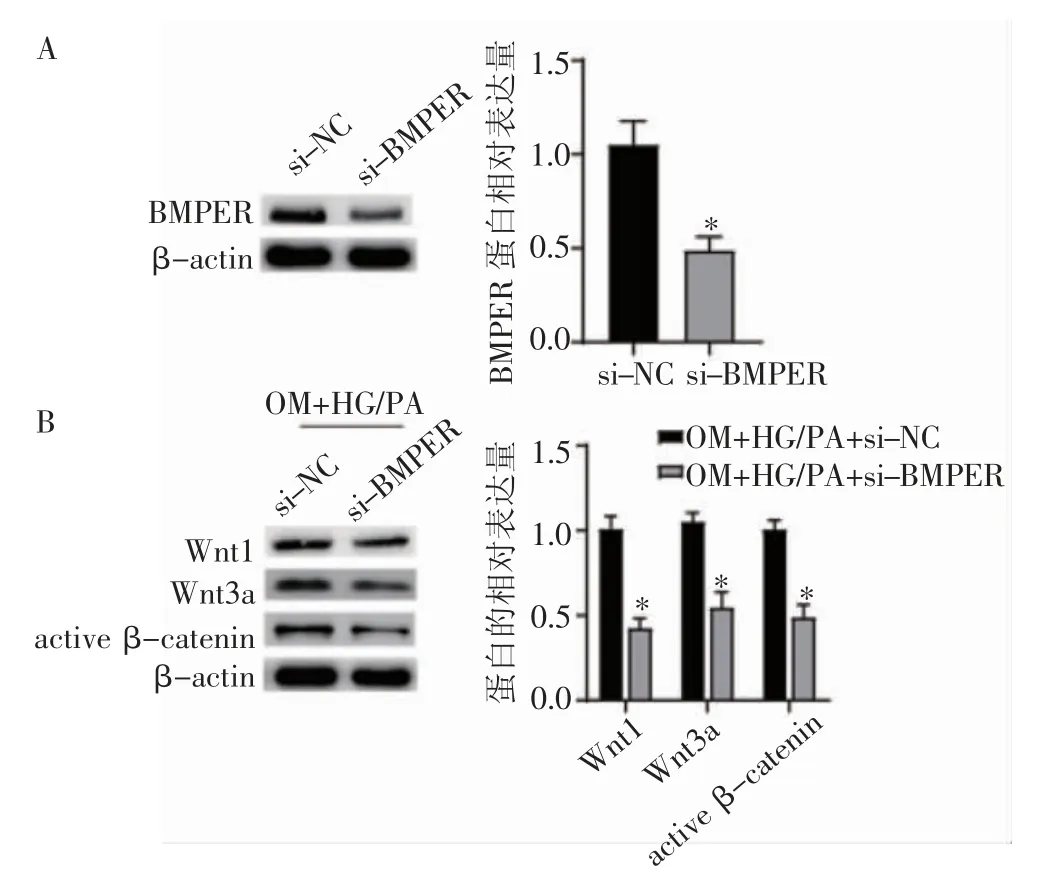
图5 下调BMPER 抑制Wnt/β-catenin 信号通路Fig 5 Wnt/β-catenin signaling pathway inhibited by the downregulation of BMPER
3 讨论
本研究探讨了BMPER 在MC3T3-E1 细胞成骨分化中的作用。结果显示,与未成骨诱导组相比,OM-MC3T3-E1 组细胞中BMPER 表达增加。BMPER 在高糖高脂环境中表达降低。在高糖高脂环境中过表达BMPER 可促进成骨分化及上调Wnt/βcatenin 信号通路,下调BMPER 抑制Wnt/β-catenin信号通路。这些数据表明,BMPER 在高糖高脂环境中MC3T3-E1 细胞成骨分化中具有促进作用。
骨质疏松症是一种常见的全身性骨骼疾病,会导致骨骼脆弱并增加骨折风险[10]。T2DM 是一种慢性代谢性疾病,以糖代谢受损和胰岛素抵抗导致血糖水平升高为特征,随着时间的推移转化为胰岛素缺乏[11]。T2DM 与骨质疏松的发生有关[12]。研究表明,糖尿病诱发的骨质疏松症是由慢性高血糖、晚期糖基化终末产物和氧化应激引起的[13-14]。在体外,高糖通过抑制成骨细胞增殖和分化显著抑制骨形成[15]。Runx2 和Col1α1 是参与调控成骨细胞分化的关键因子。在本实验中,与对照组相比,高糖高脂刺激下的MC3T3-E1 细胞成骨生物标志物Runx2 和Col1α1 的表达降低。此外,有研究发现高糖可诱导成骨细胞凋亡并抑制前成骨细胞的成骨分化[16]。
与健康个体相比,自发发展为高胰岛素血症和胰岛素抵抗的小鼠的BMPER 血清水平较低,代谢综合征(MS)患者的BMPER 血浆水平降低了约50%[17],提示BMPER 参与了调控T2DM 发生的关键分子机制。促进骨形成是治疗骨折、骨折延迟愈合和其他相关疾病的关键[18]。研究发现,BMPER 在成骨分化过程中发挥积极作用[19]。BMPER 通过上调成骨细胞标志物如ALP 和Runx2 促进人冠状动脉平滑肌细胞的成骨分化[20]。本实验发现成骨分化后BMPER 表达增加,而高糖高脂环境中的MC3T3-E1 细胞BMPER 表达减少。在高糖高脂环境中BMPER 过表达促进MC3T3-E1 细胞成骨生物标志物Runx2 和Col1α1 的表达,表明BMPER 在T2DM 患者骨质疏松发展中具有重要作用。
Wnt/β-catenin 信号通路是维持骨稳态的重要通路。该信号通路的激活促进骨形成,而该通路的失活导致骨质减少[21-22]。成骨过程中经典Wnt 信号通路的激活和失活异常分别导致硬化症和骨质疏松症[23]。活化的β-Catenin 与细胞核内TCF/LEF-1或其他转录辅激活因子相互作用,诱导成骨相关蛋白的表达,调控成骨[24-25]。Wnt3a 可与低密度脂蛋白受体相关蛋白5/6(LRP5/6)协同受体结合,通过诱导GSK-3β 磷酸化,稳定细胞质β-catenin。β-catenin在细胞质中积累,并转运到细胞核中对靶基因进行调控[25]。在笔者的研究中,BMPER 过表达上调Runx2和Col1α1,证明BMPER 过表达促进成骨分化。此外,BMPER 过表达上调Wnt/β-catenin 信号通路,而BMPER 下调抑制Wnt/β-catenin 信号通路。这些数据表明,BMPER 通过Wnt/β-catenin 信号通路促进MC3T3-E1 细胞成骨分化。
本研究的所有数据均来自于使用MC3T3-E1细胞株建立的T2DM 模型,因此还需要使用其他成骨细胞株进行进一步验证。此外,目前的研究还没有从T2DM 动物模型或T2DM 患者中获得对应结果,这些数据还需要进一步收集,以证实体外结果。
总之,本研究发现BMPER 在成骨分化后表达增加,而在高糖高脂环境中的MC3T3-E1 细胞中表达减少。BMPER 通过Wnt/β-catenin 信号通路减轻高糖高脂对MC3T3-E1 细胞成骨分化的抑制。本研究揭示了BMPER 在MC3T3-E1 细胞成骨分化中发挥重要的调节作用。BMPER 可能成为T2DM 患者骨代谢疾病临床治疗的潜在靶点。
