宏基因组二代测序在恶性血液病并发感染患者中的诊断价值
2022-08-02王晓芳冯靖
王晓芳,冯靖
(1.天津医科大学总医院呼吸内科,天津 300052;2.天津市职业病防治院综合内科,天津 300011)
感染在恶性血液病患者治疗过程中较常见[1],是免疫功能低下患者死亡的主要原因,合理地使用抗菌药物能够改善患者预后[2]。恶性血液病患者由于接受肿瘤放化疗、长期使用糖皮质激素或免疫抑制剂导致免疫功能受到抑制,易同时感染多种病原菌,临床往往仅表现为发热,多数患者感染部位不明确。目前临床常用的检测方法包括病原体检测(如血尿便、分泌物及肺泡灌洗液等标本的培养)、炎症指标、影像学检查等,临床医师可结合这些常用的检测方法经验性选择抗菌药物,但是这些传统的检测方法检出阳性率低、特异性差,往往不能同时检测出多种病原菌,特别是对于真菌、病毒以及特殊病原体的检测,导致经验性抗感染治疗往往只能覆盖部分致病菌甚至未能覆盖,延误诊治。且有部分免疫功能低下患者,同时并发细菌、真菌和病毒感染,增加了病原学诊断的难度。临床上急需一项快速准确的诊断方法。
宏基因组二代测序(metagenomic next-generation sequencing,mNGS)是近年来快速发展的病原学诊断方法,能够在单次实验中检测100 万个以上碱基对的核酸序列,序列数可以与基因组数据库比对,从而识别病原体[1-3]。能够快速识别病原体,24~48 h内可获得结果[4];并且可同时检测多种病原体,提供病原菌物种、菌株、抗生素耐药性,甚至毒力等特征。对于恶性血液病并发感染的患者而言,快速准确地做出病原菌的诊断至关重要。因此本研究回顾性分析了mNGS 在恶性血液病并发感染患者中的临床数据,提示mNGS 检测联合传统的检测方法可对临床医生合理应用抗菌药物提供帮助。
1 对象与方法
1.1 研究对象 收集2019 年1 月—2020 年12 月就诊于天津市第一中心医院血液科的恶性血液病患者。纳入标准:(1)明确诊断为恶性血液病。(2)长期服用激素或其他免疫抑制剂或多次经过肿瘤放化疗导致免疫功能低下。(3)同时完善血培养和血浆mNGS。(4)发热(体温>37.5℃)考虑可能为感染。排除标准:(1)病史资料不全的患者。(2)标本培养结果考虑为污染的患者。本研究已获得天津市一中心医院伦理委员会批准,符合伦理要求。所有受试者均知情同意。
共纳入患者190 例,其中男性132 例,女性58 例,中位年龄49(10~81)岁,常见基础疾病分别为:急性髓系白血病77 例(40.53%)、急性淋巴细胞白血病48 例(25.26%)、淋巴瘤24 例(12.63%)、骨髓增生异常综合征11 例(5.79%)、多发性骨髓瘤5 例(2.63%)、原发性骨髓纤维化4 例(2.11%)、其他21例(包括华氏巨球蛋白血症、淀粉样变性、Castleman 病等)。
1.2 研究方法
1.2.1 样本的收集及处理 于患者寒战时或体温峰值前半小时,同时采集血浆mNGS 和血培养。血培养样本送往天津市第一中心医院微生物实验室进行培养;mNGS 样本在2 h 内送往天津华大基因实验室,完善DNA 提取和文库制备,应用MGISEQ-2000 基因测序仪完成样本中微生物核酸片段的序列测定,与基因组数据库进行比对,用来识别病原体。
1.2.2 mNGS 阳性标准 所有mNGS 结果均在48 h内回报,阳性标准如下:(1)细菌或病毒:覆盖率比任何其他微生物高10 倍。(2)真菌:覆盖率比任何其他真菌高5 倍。(3)在该处>30%的相对丰度细菌、病毒或真菌中的属水平。(4)结核分枝杆菌:由于DNA 提取困难和污染可能性低,至少有一个序列数[5]。
1.2.3 临床诊断参考标准 根据医院感染诊断标准(试行)[6],依据患者临床症状、体征、传统的病原菌检测结果以及对治疗的反应做出综合诊断。抗感染有效定义为:患者使用抗菌药物72 h 后体温峰值下降0.5℃或7 d 后无发热[7]。
1.3 统计学处理 对所有纳入的190 例患者的检测结果进行分析,建立Excel 表格并分类录入数据。频数资料采用例数及百分比(保留两位百分比);应用SPSS22.0 统计学软件进行数据分析,通过Pearson χ2检验或McNemar 检验对离散变量进行比较分析,对符合正态分布的计量资料以±s 表示,采用t检验,对于不符合正态分布的计量资料,应用Mann-Whitney U 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 mNGS 结果分析 mNGS 检测结果显示共检测出68 种病原微生物,其中细菌45.59%(31/68)、病毒26.47%(18/68)、真菌20.59%(14/68),其他为非典型病原体7.35%(5/68)。最常见的细菌、真菌、病毒分别为葡萄球菌、热带念珠菌和细环病毒。按照种属分布,常见细菌、真菌、病毒的分布如图1~3。此外根据mNGS 结果,同时检出混合病原体的患者为35.79%(68/190),分别为细菌+病毒、细菌+真菌、病毒+真菌及细菌+病毒+真菌。
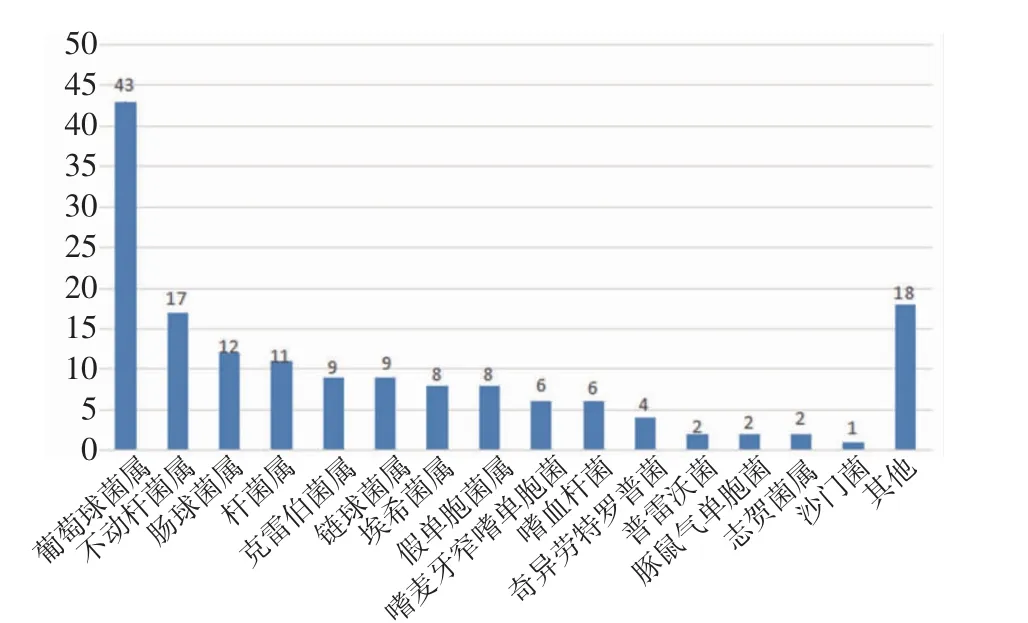
图1 细菌菌属分布Fig 1 Bacterial genus distribution
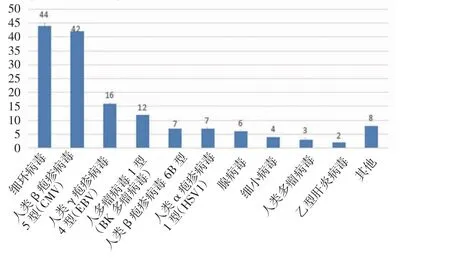
图2 病毒种类的分布Fig 2 Distribution of virus species
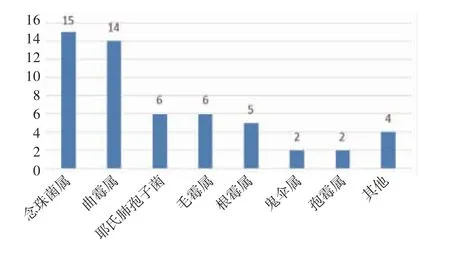
图3 真菌菌属的分布Fig 3 Distribution of fungal genera
2.2 mNGS 与血培养阳性率比较 190 例患者中mNGS 阳性率为77.37%(147/190),血培养阳性率为8.02%(13/190),mNGS 阳性率显著高于血培养(χ2=13.36,P<0.01)。其中,mNGS 检出细菌的阳性率为46.80%(89/190),血培养检出细菌阳性率为92.30%(12/13),血培养检出细菌阳性率较mNGS 高(χ2=4.69,P<0.05);mNGS 在真菌检测中阳性率为24.74%(47/190),血培养阳性率为7.70%(1/13),mNGS 检出真菌的阳性率高于血培养(χ2=3.84,P<0.05);病毒均在mNGS 中可检测到。
2.3 mNGS 与血培养所需时间的比较 从实验室获取标本开始直至结果的汇报,血培养所需要时间平均为(102.31±12.31)h,而mNGS 为(29.18±3.28)h,两者之间存在显著差异(t=22.37,P<0.01)。
2.4 mNGS 诊断性能及其与血培养的一致性分析 根据临床医师的最终诊断,考虑为感染的患者数为162 例(85.26%),非感染患者数为17 例(8.95%),临床尚未确定的患者数为11 例(5.79%)。血培养检测到的致病菌在血mNGS 中均被检测到。根据最终临床诊断,mNGS 的敏感性为80.25%,特异性为47.06%,阳性预测值为93.53%,阴性预测值20%。血培养的敏感性为8.02%,特异性为100%,阳性预测值为100%,阴性预测值为10.24%。mNGS 敏感性高于血培养(χ2=10.83,P<0.01),特异性低于血培养(χ2=8.21,P<0.01)。
2.5 mNGS 与血培养检测病原体分析 13 例mNGS 和血培养均为阳性。分析两种检测方法的结果:1 例患者结果完全一致,为单核细胞李斯特菌。11 例患者结果部分一致,血培养及mNGS 培养均检测到的病原体为:大肠埃希菌、肺炎克雷伯杆菌、人葡萄球菌、鲍曼不动杆菌、热带念珠菌。mNGS 检测到而血培养未检测到的病原体主要涉及赤曲霉、人类疱疹病毒5 型(CMV)、JC 多瘤病毒、鬼伞属、近平滑念珠菌、轮生镰刀菌。1 例完全不一致,血mNGS为热带念珠菌,血培养为纹带棒状杆菌。
2.6 mNGS 检测对临床抗感染治疗的影响 190 例患者在接受经验性抗感染治疗后完善mNGS 结果,抗菌药物覆盖情况如图4,部分患者抗病毒和抗真菌为预防用药。根据mNGS 结果,75 例(46.30%)患者调整抗菌药物使用后,评价有效率为49.30%。值得注意的是,87 例患者未根据血浆mNGS 的结果调整抗感染治疗方案,考虑并非所有检出病原体均为致病菌,61 例(37.65%)患者因经验性抗菌药物已经覆盖所检测出的致病菌而未调整抗感染方案,26例(16.05%)患者考虑检出病原体为非致病菌(如细环病毒等定植微生物),因而未调整抗菌药物。
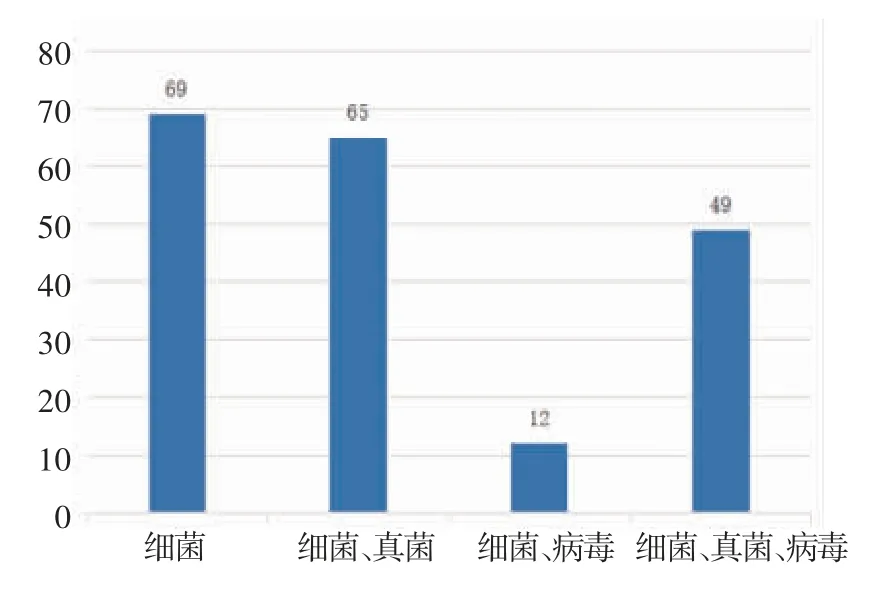
图4 预防性抗生素覆盖情况Fig 4 Prophylactic antibiotic coverage
3 讨论
恶性血液病是骨髓、造血组织和淋巴组织发生的恶性肿瘤,如各类白血病、骨髓增生异常综合征、骨髓增殖性肿瘤、浆细胞疾病、霍奇金和非霍奇金淋巴瘤等。此类疾病病情进展迅速,死亡率高。早期规范放化疗或行造血干细胞移植可延缓疾病进展,部分患者甚至可达到完全缓解状态。但与此同时,放化疗出现骨髓抑制导致患者免疫功能低下增加感染风险,导致死亡率升高。因此早期对恶性血液病并发感染的患者进行病原学诊断至关重要,可降低此类患者死亡率。因此本文对190 例恶性血液病患者进行回顾性分析,血浆mNGS 的病原菌检出率为77.37%。Shen 等[8]在国家儿童健康临床研究中心儿童医院血液科的发热住院患者中统计发现,传统微生物检测在7.14%的患者中发现致病微生物,当常规检测阴性时,mNGS 报告病原体检测率为57.40%。笔者结果似乎较既往研究高,这可能有免疫功能低下患者容易受到感染及入组患者特征不同等因素的影响。细菌是190 例患者中检出率最高的病原菌(49.2%),最常见的细菌、真菌、病毒分别为人葡萄球菌、热带念珠菌和细环病毒。
传统的血培养阳性率通常在10%左右[9],免疫缺陷患者由于多种广谱抗生素的使用,使血培养检出率更低。本研究表明,mNGS 敏感性高于血培养(P<0.001),但是特异性低于血培养(P=0.004),敏感性与既往研究报告中结果基本一致[10]。mNGS 特异性低,可能与其血浆样本检测的是游离核酸片段,可能是活病原生物基因组纯化,也有可能是已经死亡病原生物脱落的核酸碎片有关,因此导致检测结果与临床预期不符。
传统的检测方法(包括血培养)很难同时检测出多种病原体。而恶性血液病患者常常由于化疗等原因导致免疫功能缺陷,极易导致机会致病菌感染。本研究中,162 例考虑感染的患者中,有13 例血培养与mNGS 检测结果均为阳性。其中1 例检测到的病原体完全一致,为单核细胞李斯特菌。12 例部分一致,其余1 例完全不一致。两种检测方法部分一致匹配的病原体为大肠埃希菌、肺炎克雷伯杆菌、人葡萄球菌、鲍曼不动杆菌、热带念珠菌。部分不一致和完全不一致的主要涉及病毒和部分真菌。结合患者病情特点考虑为混合病原体感染。根据药敏结果加用抗生素的同时,依mNGS 检测结果分别加用抗病毒和抗真菌治疗,72 h 后患者未再发热。190 例患者中mNGS 结果为多种病原体(细菌+病毒、病毒+真菌、细菌+真菌+病毒)的比例为35.79%。与免疫功能正常的患者相比,免疫功能低下患者中易发现更多的混合病原体[11]。文献表明,mNGS 在诊断病毒方面的敏感性低于PCR,但它能够检出常规方法检测不到的病毒[12],且对细菌和真菌的阳性率显著高于血培养(P<0.001)。同时mNGS 在(29.18±3.28)h 内可诊断出病原体,而普通血培养往往长达(102.31±12.31)h,检测速度快是mNGS 的优势之一。对于恶性血液病并发感染患者,尤其化疗后粒细胞缺乏感染部位不明确的人群,及早快速准确的获得病原体类型,对于降低患者死亡率至关重要。因此mNGS 可作为传统检测的一种有效补充手段,结合病原体检测结果指导抗病原微生物药物的选择,从而优化抗感染治疗。
值得注意的是,根据血浆mNGS 结果,75 例(46.30%)患者的经验性抗感染治疗未覆盖或未完全覆盖病原菌,经过调整后,评价有效率为49.30%。其中51/101(50.50%)例根据血浆mNGS 结果调整抗菌药物的使用,26/51 例患者经过调整后评价有效率为50.99%。此外,恶性血液病并发感染患者由于免疫功能缺陷,经常使用大量抗生素,不仅易导致耐药,甚至可能影响患者的预后[13]。笔者根据mNGS结果对使用不恰当的抗生素降级或停止,并且未产生不良预后。该结果与既往的研究一致[14]。因此,在经验性使用抗菌药物后,传统的病原学诊断方法受限制时,mNGS 可以帮助临床医生调整抗感染方案。
目前有文献表明,肺泡灌洗液、肺组织、脑脊液、皮肤和软组织等感染部位的mNGS 可用于病原菌的诊断,病原菌检出率可达80%以上[14-20]。然而对于恶性血液病患者,部分不能耐受或者不能接受肺泡灌洗或者肺组织活检等有创操作,血浆标本相比而言更易获得。恶性血液病并发感染患者临床可能仅表现为发热,多数没有明确的感染灶,血浆mNGS与传统的检测方法如胸部CT、培养、PCR 等相结合,可使得病因学诊断更准确。然而,尚不能确定血浆mNGS 阳性是否可直接诊断为菌血症或明确感染部位。
总之,本研究表明,mNGS 与传统的检测方法相比,能够及时、准确的帮助临床医师进行病原学诊断,及时调整抗生素的使用,这对恶性血液肿瘤并发感染的患者至关重要。
但是本研究是有一定的局限性的,如样本量较少,患者基础疾病诊断种类较多。尽管NGS 在感染患者中已被广泛接受和应用,但敏感性较高,其结果易受到污染等因素的干扰,尚无统一的标准来修改或指导临床治疗策略,特别是对于一些疑难杂症,限制了其在临床研究中的应用。尽管存在一些局限性,但本研究表明,mNGS 可以帮助临床医生迅速调整抗菌药物,具有一定的临床意义。
