自噬在肿瘤坏死因子-α诱导成骨细胞凋亡中的作用
2021-08-20史方富崔红旺
史方富,崔红旺,孙 博
成骨细胞与破骨细胞的平衡维持着人体正常的骨量,成骨细胞形成缺陷或者异常凋亡将会引起骨质疏松等一系列疾病[1]。炎症因子在导致骨质疏松中发挥着重要的作用。肿瘤坏死因子-α(TNF-α) 是经典的多效促炎性细胞因子,其表达水平与骨损伤呈正相关[2],实验研究[3]发现,TNF-α可以诱导成骨细胞凋亡。自噬是机体内的一种自我修复程序,可以清除受损的细胞器,维持细胞的稳态,成骨细胞、骨细胞和破骨细胞的自噬在维持骨稳态中起着关键作用,自噬活性降低会加速细胞凋亡[4]。本研究观察小鼠MC3T3-E1成骨细胞株的自噬在TNF-α诱导成骨细胞凋亡中的作用,为治疗骨质疏松寻找潜在靶点。
1 材料与方法
1.1 细胞来源、试剂和仪器小鼠MC3T3-E1成骨细胞株购自中国科学院上海细胞库。TNF-α、雷帕霉素(RAP)、四甲基偶氮噻唑蓝(MTT)、胰蛋白酶、青霉素和链霉素购自Sigma-Aldrich公司,DMEM-F12 培养基购自Gibco公司,胎牛血清(FBS)购自杭州四季青公司。细胞凋亡检测试剂盒购自武汉默沙克生物科技有限公司,微管相关蛋白Ⅰ/Ⅱ轻链3(LC3-Ⅰ/Ⅱ)抗体、内参GAPDH抗体以及辣根过氧化物酶标记二抗购于Cell Signaling公司,聚氟乙烯膜购于Millipore公司。细胞培养箱购自SANYO公司,Elx800 全波长酶标仪购自Bio Tek公司,流式细胞仪购自BD Biosciences公司。
1.2 细胞培养以及实验分组MC3T3-E1成骨细胞株接种于DMEM-F12培养基(含10% FBS+1%青霉素/链霉素),置于37 ℃,5% CO2的培养箱中培养,细胞融合度约达到80%时,0.25%胰蛋白酶消化传代,得到培养液。参考文献[5]方法进行分组:① 对照组——培养液不做处理;② TNF-α观察组——培养液中加入40 μg/L TNF-α;③ RAP观察组——培养液中加入100 nmol/L RAP作用1 h后再加入40 μg/L TNF-α。
1.3 MC3T3-E1成骨细胞增殖活力的MTT法检测将3组细胞接种于96孔板中,每孔3×103个细胞,按照1.2项分组处理后培养68 h,然后每孔加入0.5 μg/L MTT继续培养4 h,去上清液,加入二甲基亚砜,酶标仪470 nm处检测吸光度的变化,计算细胞增殖抑制率=(1-观察组OD值/对照组OD值)×100%。
1.4 MC3T3-E1成骨细胞的凋亡检测将3组细胞接种于6孔板中,每孔1×105个细胞,按照1.2项分组处理后培养24 h,0.25%胰蛋白酶消化收集各组MC3T3-E1细胞,按照凋亡检测试剂盒说明书加入膜联蛋白V(Annexin V)和碘化丙啶(PI),染色30 min后,流式细胞仪检测凋亡细胞(Annexin V+/PI-和Annexin V+/PI+细胞)的占比。
1.5 MC3T3-E1成骨细胞蛋白表达的免疫印迹法(Western Blot)检测将3组细胞接种于6孔板中,每孔1×105个细胞,按照1.2项分组处理后培养24 h,0.25%胰蛋白酶消化收集各组MC3T3-E1成骨细胞,加入蛋白裂解液,每组取10 μg蛋白经聚丙烯酰胺凝胶电泳分离后,电转印至聚氟乙烯膜。10%脱脂奶粉常温封闭2 h,加入LC3-Ⅰ、LC3-Ⅱ和GAPDH抗体,4 ℃孵育过夜,次日加入二抗,化学发光反应后,Tanon 600图像分析系统扫描并进行定量分析。对照内参计算LC3-Ⅰ和LC3-Ⅱ蛋白的相对表达水平,计算LC3-Ⅱ/LC3-Ⅰ表达水平的比值。
1.6 统计学处理采用SPSS 22.0软件进行统计学分析。多组比较采用单因素方差分析,两两比较采用SNK-q检验。
2 结果
2.1 自噬对TNF-α诱导MC3T3-E1成骨细胞增殖和凋亡的影响见表1和图1。MC3T3-E1成骨细胞增殖抑制率、细胞凋亡率:3组比较差异均有统计学意义(P<0.001); TNF-α观察组、RAP观察组均明显高于对照组(P<0.01);TNF-α观察组明显高于RAP观察组(P<0.01)。
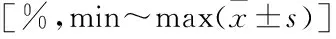
表1 3组MC3T3-E1成骨细胞增殖抑制率和凋亡率的比较
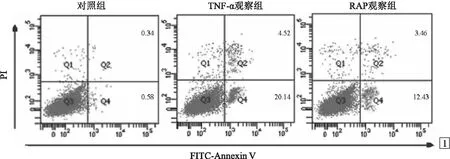
图1 3组MC3T3-E1成骨细胞凋亡的检测
2.2 自噬在TNF-α诱导MC3T3-E1成骨细胞损伤中的变化见图2、3。MC3T3-E1成骨细胞自噬蛋白LC3-Ⅱ/LC3-Ⅰ比值:对照组、TNF-α观察组和RAP观察组分别为0.10~0.50(0.22±0.07)、0.03~0.14(0.09±0.02)和0.96~1.52(1.25±0.26),组间比较差异有统计学意义(F=24.824,P<0.001);RAP观察组明显高于对照组和TNF-α观察组(P<0.01);TNF-α观察组明显低于对照组(P<0.01)。
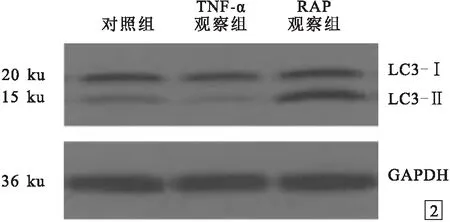
图2 自噬蛋白的Western Blot检测
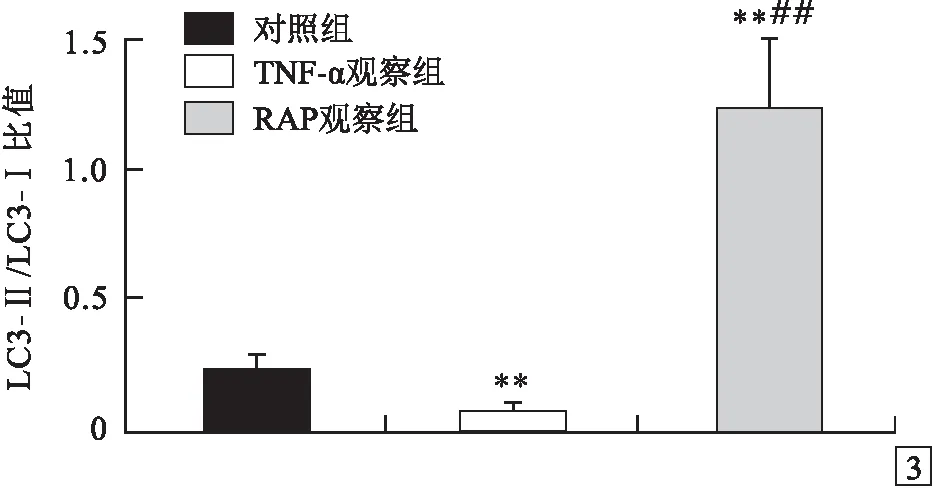
图3 3组LC3-Ⅱ/LC3-Ⅰ比值的比较 与对照组比较:**P<0.01;与TNF-α观察组比较:##P<0.01
3 讨论
随着我国人口老龄化的进程,骨质疏松症已成为中老年人骨痛、骨折的主要原因,抗骨吸收是采用雌激素、二膦酸盐类药物治疗骨质疏松的主要用药目的,但其治疗效果欠佳,寻找骨质疏松症的潜在治疗靶点仍然是近几年来研究者们关注的重点[6]。研究[7-8]显示,促炎性细胞因子在骨代谢中起重要作用,TNF-α是炎症通路中的一个关键促炎性细胞因子。临床流行病学调查和动物实验研究均显示,TNF-α表达升高与骨质疏松密切相关,而且TNF-α可以抑制骨髓干细胞向成骨细胞分化[9-10],从而激活核因子-κB信号通路诱导破骨细胞形成[11]。本研究中,TNF-α可以明显抑制小鼠MC3T3-E1成骨细胞增殖和促进成骨细胞凋亡。研究[12]发现骨质疏松患者处于自噬抑制状态,这被认为是骨质疏松发病的一种新机制,自噬体的形成是自噬激活的标志,LC3-Ⅱ是自噬体的关键组成蛋白,自噬发生时大量 LC3-Ⅰ水解成LC3-Ⅱ,实验中常用LC3-Ⅱ/LC3-Ⅰ蛋白表达的比值反映细胞自噬激活的程度。薛凯文 等[13]的研究显示,成骨细胞自噬通路被激活后,TNF-α的表达也会显著降低。本研究中,TNF-α观察组LC3-Ⅱ/LC3-Ⅰ比值显著低于对照组,说明MC3T3-E1成骨细胞经TNF-α处理后,抑制了自噬;对MC3T3-E1成骨细胞增殖抑制和凋亡的分析发现,TNF-α观察组细胞抑制率和凋亡率均显著高于对照组,说明TNF-α抑制自噬后,MC3T3-E1成骨细胞生长得到抑制,细胞凋亡增加。为了验证这一结果的可靠性,使用自噬激动剂RAP干预后,RAP观察组LC3-Ⅱ/LC3-Ⅰ比值显著高于TNF-α观察组,说明自噬显著激活;RAP观察组细胞增殖抑制率和凋亡率显著低于TNF-α观察组,说明拮抗TNF-α可明显增强MC3T3-E1成骨细胞自噬,进一步显著降低TNF-α对成骨细胞的损伤。
综上所述,自噬在TNF-α诱导MC3T3-E1成骨细胞凋亡中发挥一定作用,增强自噬可以显著降低TNF-α对成骨细胞的损伤。
