基于网络药理学及体内外实验研究连翘不同提取液抗RSV 作用
2022-07-30马元荣张会敏
王 平,马元荣*,张会敏
(1.山东省中医药研究院,山东 济南 250014;2.天津大学精密测试技术及仪器国家重点实验室,天津 300072;3.山东省济南市长清区平安街道社区卫生服务中心,山东 济南 250300)
呼吸道合胞病毒(respiratory syncytial virus, RSV)隶属副黏液病毒科肺炎病毒属[1],是诱发婴幼儿、老年人及免疫功能低下者呼吸道感染常见的RNA 病毒[2-3]。 感染发病率高,以不同程度的发热、咳嗽、咽痛及呼吸急促为常见临床症状[4],若病情未得到及时有效的控制,极易发生哮喘、急性呼吸衰竭及心力衰竭,甚至死亡[5-8]。 临床对RSV 患者常给予利巴韦林、干扰素治疗[9],但上述药物疗效有限,常出现发热、过敏等不良反应[10-11]。目前RSV 感染的流行趋势依旧严峻,至今尚无安全有效的疫苗和特效的防治方法。
中药防控病毒性感染有着数千年的临床实践经验[12],除了直接杀灭病毒、抑制病毒复制、阻止病毒致细胞损伤外,还能减轻严重的炎症反应、加强机体对病毒的免疫应答,同时具有毒副作用少、药源丰富、价格低廉及抗毒谱广等优势[13-15]。 中药连翘为中医学中广泛应用的一种清热药,无毒,安全性高[16]。《中华人民共和国药典》记载,连翘为木犀科植物连翘Forsythia suspensa (Thunb.) Vahl 的干燥果实[17]。《本草图经》中记载,连翘味苦,性微寒,归肺、心、小肠经,具有清热解毒、消肿散结、疏散风热等功效,主要的药效物质为连翘酯苷、挥发油、连翘苷等[18]。 田文静等[19]发现连翘水提液抗RSV 活性存在明显的量效关系,而且在不同感染时间给药都能产生抑制作用。借助网络药理学系统地预测连翘抗RSV 的活性成分、潜在靶点、信号通路,并结合体内外实验对连翘不同提取液抗RSV 活性进行初步验证,获得在体内外都有较好抗RSV 效果的连翘提取物,为研发高效抗病毒单体奠定基础。
1 材料
1.1 主要的仪器设备
CKX41 型倒置显微镜(奥特光学仪器有限公司);IL-161CT 型CO2培养箱(施都凯仪器设备有限公司);SB5200DTS 型超声波双频清洗机(宁波新芝生物科技股份有限公司);Allegla X-30R 型全能高速冷冻离心机(美国贝克库曼尔特有限公司);TDL-5-A 型离心机(上海安亭科学仪器厂)。
1.2 药品及主要试剂
连翘经山东省中医药研究院生药教研室鉴定;利巴韦林(批号:J1202A,大连美仑生物技术有限公司)。
磷酸盐PBS 缓冲盐溶液(批号:0025018)、胎牛血清(批号:1842926)、2% DMEM 维持液(批号:0021019)均购自以色列Biological Industries 公司;胰蛋白酶-EDTA 消化液(批号:20190430)、青霉素/链霉素混合液(批号:20181211)均购自北京索拉比奥科技有限公司; 二甲基亚砜(dimethyl sulfoxide,DMSO)(批号:20180715,天津市富宇精细化工有限公司);噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)(批号:715F0522,北京索莱宝科技有限公司)。
1.3 实验细胞与病毒
人肺癌细胞(A549)由山东省医学科学院基础所微生物室惠赠,于山东中医药大学病原微生物实验室传代后使用。
RSV 由山东省医学科学院基础所微生物室惠赠,-80 ℃保存于山东中医药大学病原微生物实验室。
1.4 实验动物
BALB/c 小鼠60 只,SPF 级,购自济南朋悦实验动物繁育有限公司,实验动物许可证号为SCXK(鲁)2019-0003。
2 方法
2.1 连翘抗RSV 的机制研究[20]
2.1.1 活性成分的筛选及成分靶点的收集 搜集TCMSP 数据库,以“连翘”为检索词,以口服生物利用度(oral bioavailability, OB)≥30%且药物相似性(drug likeness, DL)≥0.18 为条件, 初步筛选出活性成分。
活性成分输入Open Babel 数据库,将其结构转化为SMILES,导入Swiss TargetPrediction 数据库,设置物种为“Homo sapiens”,移除非人源、不规矩及重复靶点,将数据库中靶点与化合物进行模拟对接,选取结果Probability>0.5 的靶点建立数据库。
2.1.2 RSV 靶点预测及网络图构建 以“RSV”为关键词,在GeneCards、GenCLiP3 和NCBI 中搜索,删除重复靶点,建立RSV 靶点库。将活性成分-RSV 靶点导入Cytoscape 3.8.2,构建网络图。
2.1.3 富集分析 将连翘抗RSV 的作用靶点输入DAVID 6.8 数据库,进行GO 功能及KEGG 通路富集分析。
2.2 连翘不同提取液抗RSV 的体外实验研究
2.2.1 供试品制备 煎煮液:精密称取样品,加6 倍量水,回流提取2 h,滤过,得到浓度为2 g/mL 的溶液。 超声液:精密称取样品,加10 倍量水,超声处理30 min,滤过,得到浓度为2 g/mL 的溶液。 煎煮、超声离心液:吸取适量煎煮液及超声液,8000 r/min,离心10 min(离心半径18 cm)。 煎煮、超声过滤液:吸取适量煎煮液及超声液,用0.22 μm 滤膜过滤。利巴韦林溶液:精密称取利巴韦林粉末,用PBS 配制成最终浓度为4 mg/mL 的溶液。
2.2.2 A549 细胞的复苏和培养 将液氮罐内冻存的A549 细胞在37 ℃水浴锅内晃动1 min,使其快速融化。 1000 r/min 离心5 min(离心半径16 cm),弃掉上清液。 加适量的10% DMEM 培养液,反复吹匀,取适量悬液,转入培养瓶,补加培养液至12 mL。放置于37 ℃、5% CO2恒温培养,细胞长成单层后,加1 mL 0.25%的胰酶消化,1∶3 传代。
2.2.3 RSV 扩增和保存 RSV 接种于A549 单层细胞上,1 h 后,加入12 mL 含2%胎牛血清的DMEM维持液,恒温培养。 实时观察细胞病变情况,待细胞病变出现80%以上时,取出后离心,1000 r/min 离心5 min(离心半径16 cm),收集上清液,定量分装,-80 ℃保存,备用。
2.2.4 病毒毒力测定 病毒液用2% DMEM 维持液10 倍比稀释成8 个不同浓度梯度,依次接种在96 孔板内单层细胞上,纵向重复6 孔,设两列细胞对照。培养3 d,每日观察细胞病变情况。培养结束前4 h,弃废液。 加入10 μL MTT 和100 μL PBS,置于恒温培养箱4 h。 弃废液,加200 μL DMSO,490 nm 波长检测OD 值。 根据Reed-Muench 公式,计算病毒液半数感染剂量(TCID50)。
2.2.5 细胞毒性测定 连翘不同提取液用2%DMEM 维持液从原始浓度开始2 倍比稀释成10 个梯度;分别接种于96 孔板内,接种量为50 μL/孔,重复4 孔,同设2 列空白对照;于37 ℃、5% CO2恒温培养,每日观察细胞病变情况,持续3 d。 弃掉废液,加100 μL PBS 和10 μL MTT,培养箱内培养4 h;弃上清染液,加200 μL DMSO,490 nm 测定OD值,采用Reed-Muench 方法计算药物半数毒性浓度(TC50)。
2.2.6 抗RSV 毒性测定[21]将配比好的连翘不同提取液及阳性药利巴韦林横向接种,50 μL/孔,重复4孔;除空白对照外,每孔接种50 μL 病毒液;每日观察细胞病变情况,3 d 后,加入100 μL PBS 和10 μL MTT,培养箱内培养4 h;弃染液,加200 μL DMSO,490 nm 波长检测OD 值。 用Reed-Muench 方法计算半数有效浓度(EC50)及治疗指数(TI)。
2.3 连翘煎煮离心液抗RSV 的体内实验研究

小鼠每侧鼻腔内滴入35 μL 病毒液(100 个TCID50),正常组小鼠滴入等量的DMEM 维持液[22],待小鼠完全吸入后放入笼中继续观察,连续滴鼻3 d,1 次/d[23]。
滴鼻3 h 后,观察小鼠是否死亡,并灌胃给药0.2 mL/15 g,1 次/d,正常组和模型组给予等体积的生理盐水[21]。 连续灌胃5 d,期间观察并记录小鼠的精神、活动、饮食等情况。
2.3.2 血常规测定 眼眶取血,血液滴入加有EDTA-2K 的EP 管,检测白细胞(white blood cell,WBC)、淋巴细胞(lymphocyte count,LYM)、单核细胞(mononcyte, MON)、中性粒细胞(neutrophil, NEU)计数。
2.3.3 肺指数测定 取血结束后,脱颈法处死小鼠,摘取完整肺组织并称重,计算出肺指数。肺指数=肺质量/体质量。随后将肺组织处理,进行病理学检测。
2.3.4 病理观察 取相同大小同一位置的左肺,制备石蜡切片行HE 染色,显微镜观察肺部病变情况并拍照记录。
2.3.5 肺组织免疫组化检测 石蜡切片行DAB 染色,脱水封片,置于显微镜下镜检,计算平均光密度值。
2.3.6 统计学分析 采用SPSS 17.0 统计软件,计量资料用“±s”表示。多组之间比较采用单因素方差分析,两两比较采用LSD 检验,以P<0.05 为差异有统计学意义。
3 结果
3.1 连翘抗RSV 的机制研究
筛选出21 个活性成分,抗RSV 潜在作用靶点129 个,详见图1。 GO 分析得到548 个条目,连翘参与的生物过程主要有基因表达的正调控、凋亡过程的负调控、药物的反应、DNA 模板转录的正向调节等;在细胞成分中,主要涉及胞质溶胶、质膜部分等;分子功能主要包括酶结合、转录因子结合等,详见图2。 KEGG 分析筛选出作用通路共112 条,有癌症通路、癌症中的蛋白多糖、乙型肝炎、HIF-1 信号通路、TNF 信号通路、Toll 样受体信号通路等相关通路,详见图3。
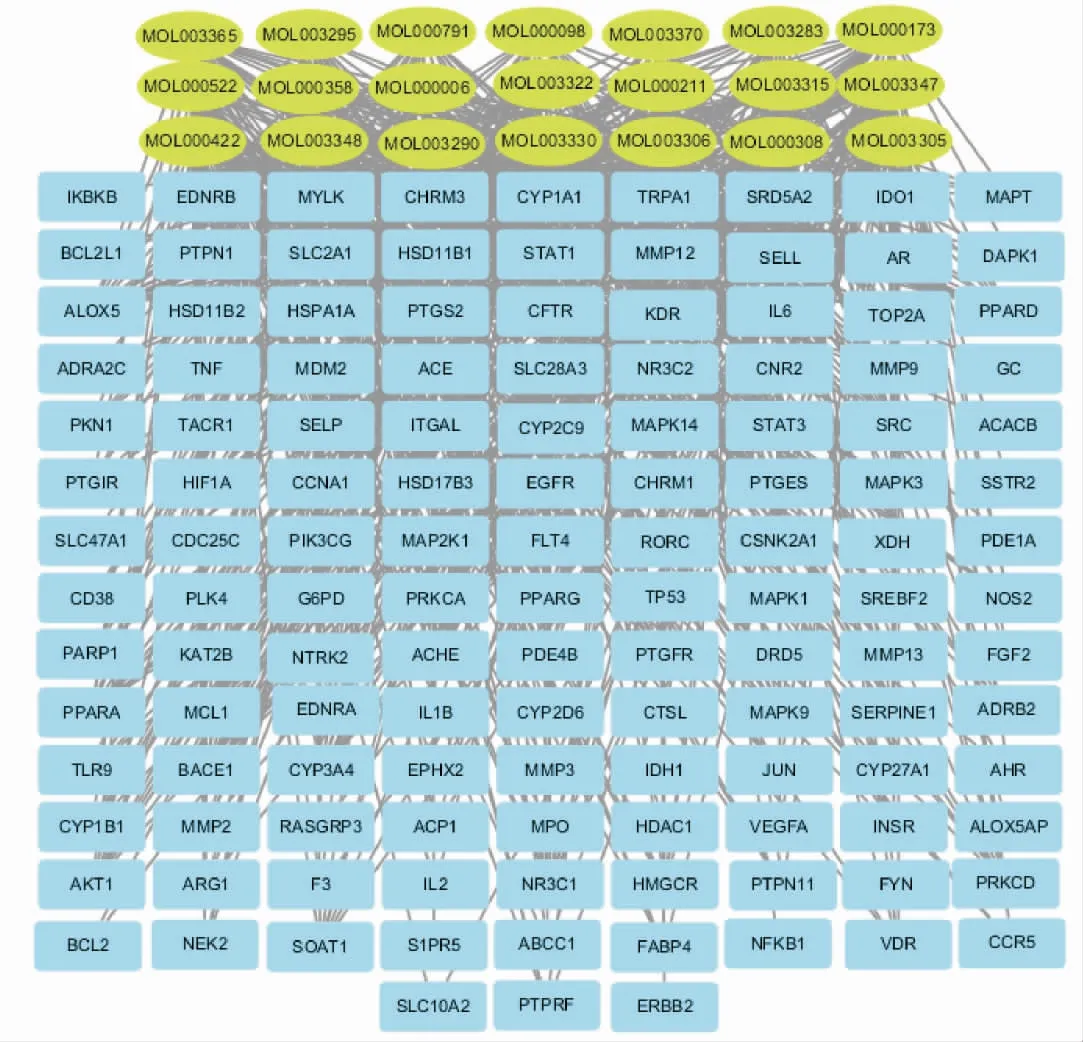
图1 连翘抗RSV 靶点网络图

图2 GO 富集分析图
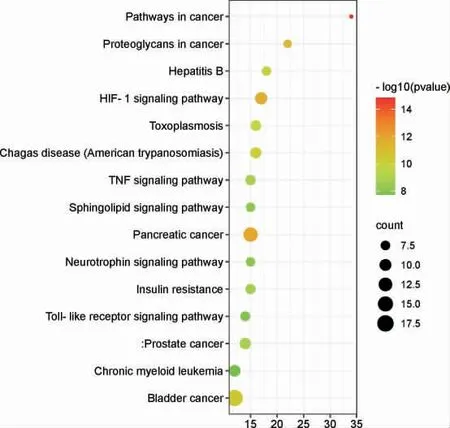
图3 KEGG 信号通路分析图
3.2 连翘不同提取液抗RSV 的体外实验研究
3.2.1 RSV 半数感染剂量(TCID50) 培养72 h,根据病毒所致A549 细胞病变情况, 计算出RSV 的TCID50为10-3.77。
3.2.2 连翘不同提取液对RSV 的抑制作用 体外连翘不同提取液抗RSV 效果:煎煮离心液>超声离心液,超声液、煎煮液较前两者略差。 详见表1。

表1 连翘不同提取液对细胞的毒性和抗RSV 活性
3.3 连翘煎煮离心液抗RSV 的体内实验研究
3.3.1 各组小鼠血常规水平比较 与正常组相比,模型组WBC、LYM、MON 计数升高,NEU 计数下降,差异均有统计学意义(P<0.05);与模型组相比,利巴韦林组、高剂量组、中剂量组、低剂量组WBC、LYM、MON 计数明显下降,NEU 计数升高,差异均有统计学意义(P<0.05);与利巴韦林组相比,中剂量组、低剂量组WBC、LYM、MON 计数升高,NEU 计数下降,差异均有统计学意义(P<0.05),高剂量组WBC、LYM 计数升高,差异均有统计学意义(P<0.05);与高剂量组相比,低剂量组WBC、LYM 计数升高,NEU 计数下降,差异均有统计学意义(P<0.05)。 详见表2。
表2 各组小鼠血常规检测结果(±s,n=10)
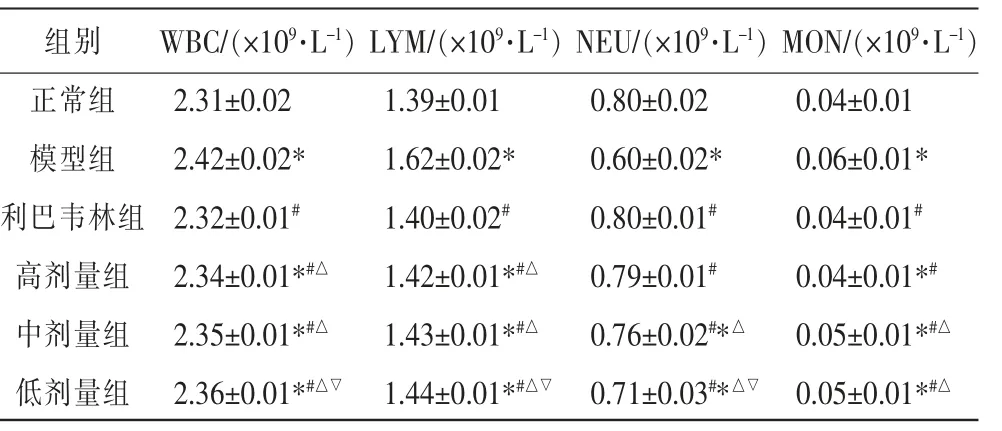
表2 各组小鼠血常规检测结果(±s,n=10)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与利巴韦林组相比,△P<0.05;与高剂量组相比,▽P<0.05。
组别正常组模型组利巴韦林组高剂量组中剂量组低剂量组WBC/(×109·L-1)2.31±0.02 2.42±0.02*2.32±0.01#2.34±0.01*#△2.35±0.01*#△2.36±0.01*#△▽LYM/(×109·L-1)1.39±0.01 1.62±0.02*1.40±0.02#1.42±0.01*#△1.43±0.01*#△1.44±0.01*#△▽NEU/(×109·L-1)0.80±0.02 0.60±0.02*0.80±0.01#0.79±0.01#0.76±0.02#*△0.71±0.03#*△▽MON/(×109·L-1)0.04±0.01 0.06±0.01*0.04±0.01#0.04±0.01*#0.05±0.01*#△0.05±0.01*#△
3.3.2 各组小鼠肺指数比较 与正常组相比,模型组肺指数升高(P<0.05),说明造模成功。与模型组相比,利巴韦林组、高剂量组、中剂量组、低剂量组肺指数下降(P<0.05);与利巴韦林组相比,高剂量组、中剂量组、低剂量组肺指数升高(P<0.05);与高剂量组相比,中剂量组、低剂量组肺指数升高(P<0.05)。 详见表3。
表3 各组小鼠肺指数的结果(±s,n=10)
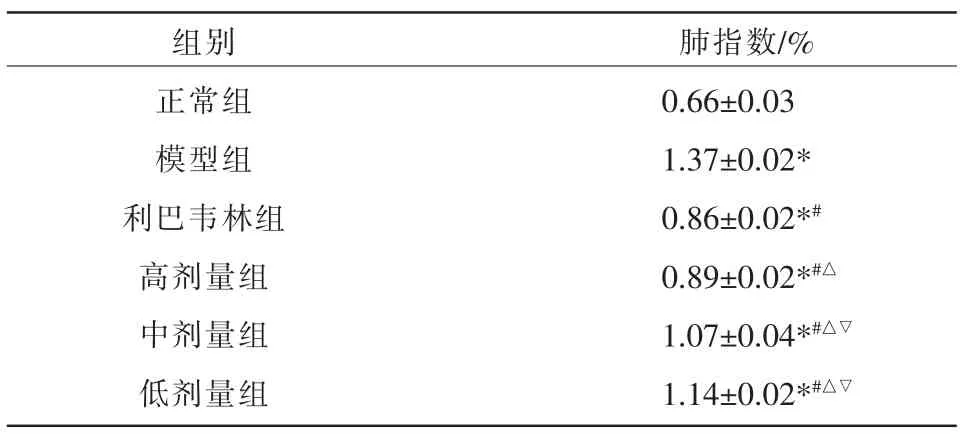
表3 各组小鼠肺指数的结果(±s,n=10)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与利巴韦林组相比,△P<0.05;与高剂量组相比,▽P<0.05。
组别正常组模型组利巴韦林组高剂量组中剂量组低剂量组肺指数/%0.66±0.03 1.37±0.02*0.86±0.02*#0.89±0.02*#△1.07±0.04*#△▽1.14±0.02*#△▽
3.3.3 各组小鼠感染RSV 后肺组织的病理变化 正常组肺泡腔大小正常,泡壁完整、未见明显炎性细胞浸润,管腔无分泌物;模型组小鼠肺组织增生,间质内出现大量炎性细胞且分布均匀,支气管上皮增生、脱落,支气管周围慢性炎性细胞浸润,肺动脉上皮增生显著;利巴韦林组小鼠个别支气管上皮轻度增生,肺泡大致正常;高剂量组小鼠个别支气管上皮轻度增生、脱落,肺泡间质轻度增生;中剂量组小鼠支气管周围轻度慢性炎性细胞浸润,部分上皮组织增生,间质部分肺泡充血;低剂量组小鼠肺泡壁增厚,支气管上皮细胞增生,脱落至管腔,间质细胞增生,肺泡腔可见充血,慢性炎性细胞浸润较明显。 详见图4。

图4 各组小鼠肺组织HE 染色结果图(×200)
3.3.4 各组小鼠肺组织TLR4、NF-κB p65、p38 MAPK表达比较 与正常组相比,模型组的TLR4、NF-κB p65、p38 MAPK 平均光密度值升高(P<0.05),肺组织出现大量阳性细胞染色;与模型组相比,利巴韦林组、高剂量组TLR4、NF-κB p65 及p38 MAPK 平均光密度值下降(P<0.05),中剂量组TLR4、p38 MAPK平均光密度值下降(P<0.05);与利巴韦林组相比,中剂量组、低剂量组NF-κB p65 平均光密度值升高(P<0.05);与高剂量组相比,中剂量组、低剂量组NF-κB p65 平均光密度值升高(P<0.05)。详见表4,图5-7。
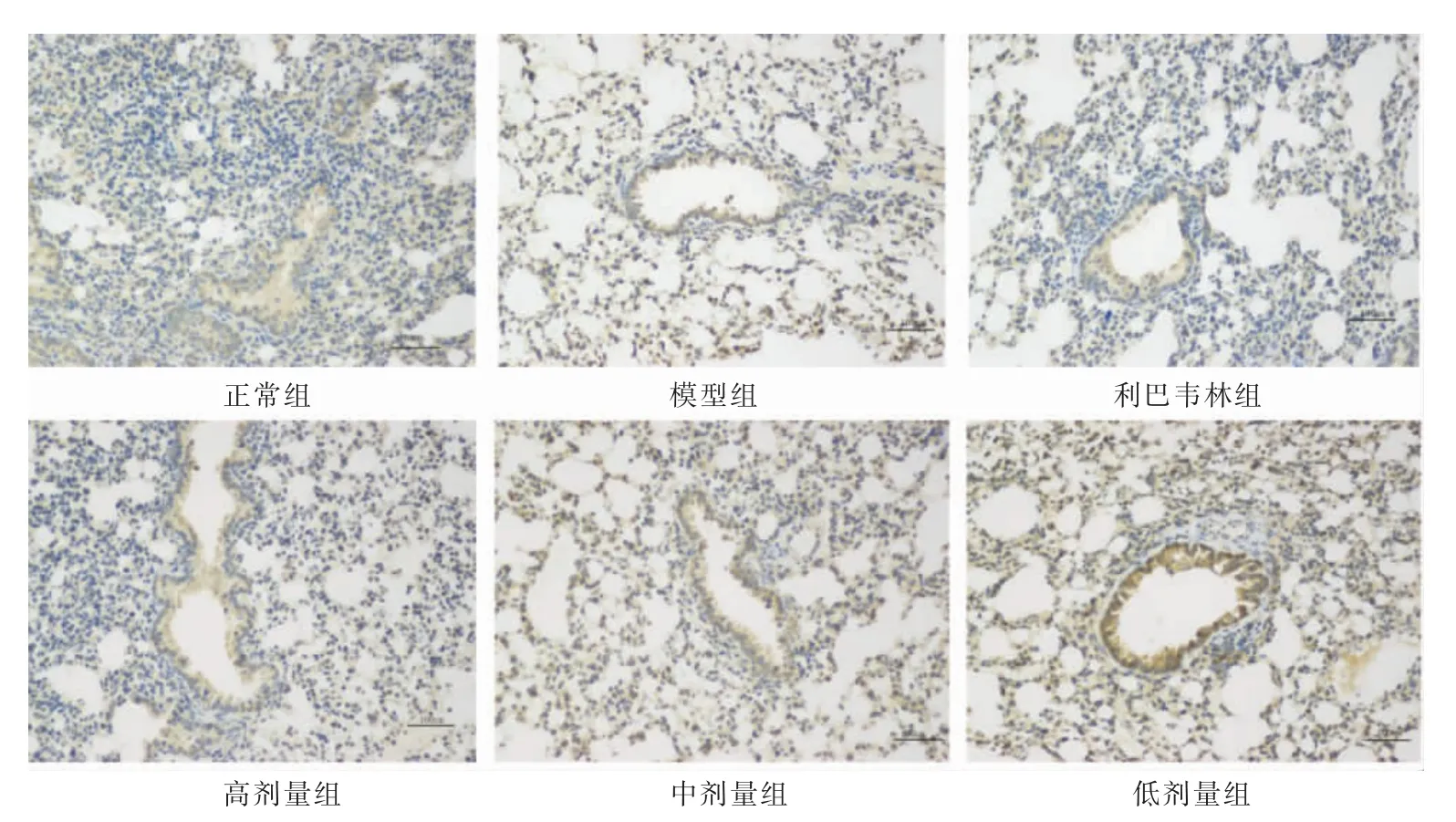
图5 各组小鼠肺组织TLR4 的免疫组化染色图(×200)
表4 各组小鼠肺组织TLR4、NF-κB p65、p38 MAPK 的平均光密度值比较(±s,n=18)

表4 各组小鼠肺组织TLR4、NF-κB p65、p38 MAPK 的平均光密度值比较(±s,n=18)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与利巴韦林组相比,△P<0.05;与高剂量组相比,▽P<0.05。
组别正常组模型组利巴韦林组高剂量组中剂量组低剂量组NF-κB p65 0.060±0.011 0.073±0.014*0.062±0.008#0.064±0.007#0.071±0.016*△▽0.072±0.010*△▽TLR4 0.056±0.004 0.062±0.006*0.056±0.004#0.055±0.004#0.057±0.007#0.058±0.010 p38 MAPK 0.052±0.006 0.116±0.184*0.049±0.004#0.048±0.004#0.055±0.013#0.067±0.009
4 讨论
连翘是临床常用清热解毒药,目前研究较为充分的是连翘的不同化学成分抗病毒活性,但其抗病毒机制的研究却相对缺乏。本研究利用网络药理学的方法对连翘抗RSV 的活性成分、作用靶点、相关通路等进行了探讨,筛选出槲皮素、连翘苷、木犀草素等21 个活性成分,129 个抗RSV 靶点,富集548个生物过程及112 条信号通路。结果表明连翘多成分协同影响宿主自身IL-1B、IL-2、IL-6 等细胞因子水平,干预HIF-1、TNF 等信号通路,从而发挥抗RSV作用[24-25]。 借助网络药理学的方法证实连翘通过多成分、多靶点、多通路发挥抗RSV 作用,但其方法预测药效机制有局限性。此外,本研究通过体外细胞实验和体内动物实验验证了其抗RSV 的活性。

图6 各组小鼠肺组织NF-κB p65 的免疫组化染色图(×200)

图7 各组小鼠肺组织p38 MAPK 的免疫组化染色图(×200)
在体外细胞水平上进行连翘抗RSV 作用的验证,用预防给药的方法证明连翘不同提取液对RSV病毒有杀灭作用。 但其不同方法的提取液抗RSV 的效果差异较大,提示煎煮液经离心或过滤后,毒性杂质减少,活性成分的组成及含量增加。
体内实验从血常规、肺指数检测、HE 染色方面研究连翘煎煮离心液对RSV 感染后的小鼠的影响,证实中剂量组、高剂量组对RSV 引起的肺炎具有较好的调节作用。 TLR4 是与RSV 感染的密切受体之一,可通过识别病毒的F 蛋白和细胞表面脂多糖,激活下游的p38 MAPK 和NF-κB[26-27]。 干预调控TLR4,可使得下游NF-κB p65 引发的炎性因子表达受阻,缓解RSV 引起的肺部病理损伤。 免疫组化结果推测连翘煎煮离心液可通过调动宿主免疫系统的功能,产生大量的免疫因子来阻止病毒的复制、繁殖,达到抗病毒的效果。 RSV 感染者外周血T 淋巴细胞亚群及Th1、Th2 细胞因子呈现异常表达[28],课题组可进一步研究连翘高剂量给药能否恢复RSV肺炎小鼠体内CD3+、CD4+、CD4+/CD8+、IL-2、IFN-γ、TNF-α、IL-4、IL-10 水平,从而发挥抗RSV 作用。
