基于网络药理学和实验验证探讨降糖通脉方治疗糖尿病肺损害的作用机制
2022-07-30郑承红
丁 念,郑承红
(1.湖北中医药大学,湖北 武汉 430000;2.武汉市中医医院,湖北 武汉 430014)
1976 年,Schuyler 提出糖尿病肺损害属于糖尿病微血管病变,因肺脏血供丰富,所以肺脏也是糖尿病损害的靶器官之一[1]。 肺脏有丰富的血管系统,极易受到高糖状态的影响。 糖尿病微血管病变是造成糖尿病肺损害的主要原因。 彭丽媛等[2]发现糖尿病患者的肺脏微血管通透性及肺脏结构破坏明显高于健康对照组。 KODOLOVA 等[3]观察了不同严重程度和不同病程的糖尿病患者肺血管组织,发现这些肺血管组织的微血管病变与其他脏器(如肾脏)的微血管病性改变极其相似。 糖尿病肺损害的基本病机是阴虚燥热、络脉瘀阻,阴虚为本,燥热、气滞、痰湿、瘀血为其标,而瘀血贯穿疾病的始终。针对“虚”“瘀”两个核心, 临床采用降糖通脉方以滋阴清热、 活血化瘀。 降糖通脉方主药为女贞子12 g、黄连5 g、川芎10 g,其中:女贞子补肝肾之阴、清虚热,发挥养阴之力,以治其本;消渴日久,脏腑虚弱,必生痰湿、瘀血等内毒,黄连清热解毒燥湿;川芎行气活血化瘀治其标。前期研究发现,降糖通脉方可以下调糖尿病大鼠TGF-β1 表达,减少细胞外基质的堆积,改善血管的超微病理结构来干预糖尿病微血管病变[4]。 临床研究也发现,降糖通脉方可以改善糖尿病患者的肺功能损害。为进一步探究降糖通脉方治疗糖尿病肺损害的分子学机制,通过网络药理学的方法,探究降糖通脉方治疗糖尿病肺损害的物质基础和作用机制,并结合糖尿病肺损害模型大鼠对其中的关键信号通路进行验证,可为后续基础研究和临床实践提供依据。
1 材料
1.1 实验动物
选用健康的SPF 级雄性8 周龄SD 大鼠60 只,体质量180~200 g,实验动物使用许可证号:SYXK(鄂)2018-0104,购于三峡大学实验动物中心。 饲养环境为温度22~26 ℃,湿度50%~60%,人工光照明、暗各12 h。 在本次实验过程中,按照《实验动物管理条例》等相关文件标准进行饲养与处置。
1.2 主要试剂
戊巴比妥钠(批号P3761)、链脲佐菌素(STZ)(批号S0130)均购自美国Sigma 公司;二甲双胍(批号M107827,阿拉丁试剂有限公司);二甲苯(批号10023418)、无水乙醇(批号10009218)、碳酸锂(批号20022818)、冰乙酸(批号10000218)均购自国药集团化学试剂有限公司;伊红(批号E8090)、中性树脂(批号G8590)、苏木素(批号G1004)均购自武汉赛维尔生物科技有限公司;蛋白质Marker(批号X1109A,美国Helix 公司);十二烷基硫酸钠(SDS)(批号1019Y032)、TEMED(批号CT29143440)、过硫酸铵(批号603B0313)、BCA 蛋白浓度测定试剂盒(批号120720210514)、RIPA(强)组织细胞快速裂解液(批号20201027)、Tween-20(批号C2011141)均购自北京索莱宝科技有限公司;PVDF 转移膜(批号R9JA64128)、化学发光试剂(批号20345A4/20345A4)均购自德国Millipore 公司;TGF-β 一抗(批号20201014)、SnoN 一抗(批号20200312)、Smad2一抗(批号20200525)、Smad3 一抗(批号20200218)、Smad7 一抗(批号20200622)、p-Smad2 一抗(批号GR200003-85)均购自英国Abcam 公司;p-Smad3 一抗(批号15,CST)、p-Smad7一抗(批号20201012)、GAPDH 一抗(批号20200525)、Goat anti-Rabbit IgG(批号20200507)均购自华联科股份有限公司。
1.3 主要仪器
正置显微镜(型号DM1000,德国徕卡显微系统有限公司);TB-718L 型生物组织包埋机-冷冻机、GNP-9080 型隔水式恒温培养箱均购自泰维科技股份有限公司;电泳仪(型号mini protean 3 cell,美国BIO-RAD 公司);全自动化学发光分析仪(型号Tanon-5200,上海天能有限公司)。
2 方法
2.1 降糖通脉方治疗糖尿病肺损害的网络药理学研究
2.1.1 药物有效活性成分的筛选 应用TCMSP 数据库(https://tcmsp-e.com/)及BATMAN-TCM 数据库(http://bionet.ncpsb.org/batman-tcm/)检索药物方中主要药物女贞子、黄连、川芎的所有活性成分。 根据研究结果,以口服生物利用度(oral bioavailability, OB)>30%、类药性(drug-likeness, DL)≥0.18 为限制条件进行筛选,得到药物的有效活性成分。
2.1.2 药效成分-靶点互作网络构建 应用TCMSP数据库及BATMAN-TCM 数据库平台检索药物所有活性成分的靶基因,并将TCMSP 数据库筛选所得所有靶蛋白名称导入DrugBank 数据库(https://www.drugbank.ca/) 以及UniProt 数据库(https://www.uniprot.org),设置物种为人类(Homo sapiens),对得到的靶蛋白进行比对和基因名校正,转换成标准的基因名,并删除无对应基因名的靶蛋白。
2.1.3 糖尿病肺损害的疾病靶点筛选 设置检索词为“type 2 diabetes lung injury”,通过GeneCards数据库(https://www.genecards.org/)进行检索,筛选得到糖尿病肺损害疾病靶点,并应用UniProt 数据库(https://www.uniprot.org)对疾病靶点进行标准化,获得Swiss-Prot ID。
2.1.4 活性成分与疾病的共同靶点筛选及蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络构建 明确糖尿病肺损害相关靶点与药物潜在靶点之间的相互作用,应用R 语言(https://www.r-project.org/)软件及Perl 语言程序将疾病靶点与药物靶点进行交集,并输入Venny 2.1 软件(http://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图。 应用STRING(https://string-db.org/) 插件构建共同靶点PPI,将蛋白种类设置为“Homo sapiens”,将Settings 设为“high confidence:0.9”,并隐藏无关系的靶点,其他参数保持默认设置,获得PPI 网络。 应用count.R 插件获得共同蛋白靶点出现的频次。
2.1.5 GO 生物功能分析和KEGG 富集 应用R 语言(https://www.r-project.org/)软件中clusterProfiler GO.R 包及Perl 语言对活性成分与糖尿病肺损害的共同靶点进行GO 分析,GO 分析主要用于描述基因产物的功能, 其中包括细胞组分 (cellular component, CC)、分子功能(molecular function, MF)和生物学过程(biological process, BP),并应用clusterProfiler KEGG.R 包进行KEGG 富集分析。 利用Cytoscape 3.7.2 软件构建核心靶基因-信号通路互作网络图。根据富集因子值分析核心通路富集程度,查阅相关文献, 基于构建的网络探讨降糖通脉方治疗糖尿病肺损害的潜在机制。
2.2 降糖通脉方治疗糖尿病肺损害药理学实验验证
2.2.1 大鼠糖尿病肺损害模型的复制与鉴定 根据随机数字表法取10 只大鼠作为正常对照组(NC组),另取50 只大鼠作为糖尿病造模组。大鼠均予高糖高脂饲料(含蔗糖10%、猪油10%、蛋黄粉10%、胆固醇1.5%、胆酸钠0.5%、全价饲料68%)喂养4 周,后造模,大鼠禁食不禁水12 h 后,在配制好的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH=4.2)的基础上,配制1% STZ溶液,按照35 mg/kg 腹腔注射1% STZ 溶液,72 h后采尾静脉血及检测,随机血糖值大于16.7 mmol/L、尿糖≥(+++)的大鼠为糖尿病造模成功[5]。 大量研究表明持续高糖环境可以直接引起糖尿病肺损伤[6-8]。本实验研究,在制备出具有2 型糖尿病特征的大鼠模型后,继续高糖高脂饲料喂养8 周。 在饲养第8周末,取大鼠肺组织做病理检查,发现肺泡腔减少,肺泡腔增厚,部分肺泡腔萎缩甚至塌陷,有大量炎性细胞渗透、纤维组织增生,纤维细胞浸润明显,说明已经成功复制了大鼠糖尿病肺损害模型。
2.2.2 动物分组和样本采集 造模成功后,将大鼠分为6 组进行药物干预,每组10 只大鼠。 (1)NC组:不给药,普通饲料喂养;(2)糖尿病模型组(DM组):等体积生理盐水灌胃,每天灌胃一次,连续8周,继续使用高脂饲料喂养;(3)降糖通脉方低剂量组(JTTM 低剂量组):JTTM 63 mg/mL 混悬液灌胃给药1 mL/(kg·d),持续8 周后继续高脂饲料喂养;(4)降糖通脉方中剂量组(JTTM 中剂量组):JTTM 126 mg/mL混悬液灌胃给药1 mL/(kg·d),持续8 周后高脂饲料喂养;(5)降糖通脉方高剂量组(JTTM 高剂量组):JTTM 252 mg/mL 混悬液灌胃给药1 mL/(kg·d),持续8 周后,高脂饲料喂养;(6)二甲双胍组(Met 组):二甲双胍54.3 mg/mL 水溶液灌胃给药1 mL/(kg·d),持续8 周后,继续高脂饲料喂养。
于第8 周末药物干预完成后,颈椎脱臼法处死各组大鼠,将血标本离心,取上清液置-80 ℃冰箱保存。 取一侧肺组织用4%多聚甲醛固定,另一侧肺脏组织放入液氮保存。
2.2.3 HE 染色观察大鼠肺组织形态学变化 石蜡切片,常规二甲苯脱蜡,梯度乙醇水化至蒸馏水洗;苏木素染色8 min,自来水冲洗;盐酸乙醇分化30 s(提插数下);温水返蓝;置伊红液中2 min;常规梯度乙醇脱水,二甲苯透明,中性树胶封片;观察肺组织的病理变化,拍照分析。
2.2.4 Western blot 法检测大鼠肺组织中的TGFβ1、Smad2、Smad3、Smad7 和SnoN表达 将冻存于-80 ℃冰箱的肺组织取出备用,使用RIPA 裂解液将细胞裂解,按说明书步骤配制总蛋白溶液,置于组织匀浆器中,13 800 r/min, 离心15 min 离心半径6 cm,取上清液,使用BCA 试剂盒测定蛋白质浓度。 取总蛋白上样、电泳分离、切胶,转至PVDF 膜上,5%脱脂牛奶封闭2 h,加入TGF-β1 一抗(1∶1000)、Smad2 一抗(1∶1000)、Smad3 一抗(1∶1000)、Smad7一抗(1∶1000)、p-Smad2 一抗(1∶1000)、p-Smad3一抗(1∶1000)、p-Smad7 一抗(1∶1000)、GAPDH一抗(1∶1000),4 ℃摇床过夜;PBST 洗膜, 加二抗(1∶20 000),4 ℃摇床过夜,PBST 洗膜, ECL 发光试剂盒显色、显影,以GAPDH 为内参蛋白,采用目标蛋白条带灰度值/GAPDH 条带灰度值来表示目的蛋白相对表达水平。
2.2.5 统计分析 采用SPSS 21.0 进行数据分析。计量资料以“±s”表示,两组间比较采用独立样本t检验,多组间比较使用单因素方差分析,P<0.05 为差异有统计学意义。
3 结果
3.1 降糖通脉方治疗糖尿病肺损害的网络药理学机制分析
3.1.1 降糖通脉方活性成分筛选 通过TCMSP、BATMAN-TCM 数据库对女贞子、黄连、川芎的活性成分进行检索,并以OB>30%和DL≥0.18 为限制条件进行筛选,其中得到川芎8 种有效活性成分、黄连14 种有效活性成分、女贞子14 种有效活性成分。详见表1。

表1 有效活性成分信息表
3.1.2 糖尿病肺损害的疾病靶点筛选 通过检索GeneCards 数据库得到2 型糖尿糖肺损害的疾病治疗靶点,删去重复靶点后共得到584 个与2 型糖尿病肺损害的疾病治疗靶点。
3.1.3 共同靶点筛选及PPI 网络构建 得到的109个药物活性成分靶点与584 个相关疾病靶点,分别导入在线韦恩图制作网站InteractiVenn,相匹配映射得到降糖通脉方治疗2 型糖尿病肺损害的潜在作用靶点共95 个,药物有效活性成分-疾病交集靶点Venny 图(图1)。 将95 个潜在靶基因导入STRING在线分析网站(https://string-db.org/),设置隐藏未连接的靶点,设定最低互作评分中的“highest confidence>0.900”,并导出PPI 结果数据(图2)。进一步通过Cytoscape 3.7.2 软件得到潜在靶基因的PPI,运用其中的cytoHubba 插件筛选Hub 基因,使用Degree算法,得出排名前20 位潜在核心靶基因(图3)。

图1 药物活性成分靶点与2 型糖尿病肺损害疾病靶点Venny 图

图2 共同靶点的PPI 网络图

图3 Degree 值排名前20 的靶点
3.1.4 活性成分-肺损害-靶点互作网络构建 采用Cytoscape 3.7.2 软件在中药活性成分-2 型糖尿病肺损害-靶点互作网络图中,共获得121 个节点、415 条边(靶点95 个,活性成分24 个)(图4)。

图4 中药活性成分-2 型糖尿病肺损害-靶点互作网络
3.1.5 药物治疗糖尿病肺损害的生物功能(GO)分析及核心通路筛选 运用R 语言中的Bioconductor包、clusterProfiler 包对24 个中药活性成分-疾病交集靶点进行GO 和KEGG 富集分析,结果显示:95个潜在靶基因GO 分析可见其主要富集于DNA-转录因子结合、蛋白质异二聚化活性、配体激活的转录因子活性、SMAD 结合等(图5)。 而KEGG 富集分析发现其主要集中于糖尿病并发症中的TGF-β 信号通路、AGE-RAGE 信号通路以及TNF 信号通路等(图6)。并对“3.1.3”中筛选得到的核心靶基因Smad2、Smad3、Smad7、Skil 相关蛋白(Ski-related novel protein,SnoN)中富集的信号通路进行展示,利用Cytoscape

图5 GO 生物功能分析气泡图

图6 KEGG 富集分析气泡图
3.7.2 软件构建核心靶基因-信号通路互作网络图(图7)。

图7 核心靶点与2 型糖尿病相关性肺损害信号通路之间的关系
3.2 降糖通脉方对糖尿病肺损害大鼠的干预作用
3.2.1 各组糖尿病大鼠肺组织病理结构的变化 NC组大鼠肺组织结构正常。 与NC 组相比,DM 组的肺泡腔减少,肺泡腔增厚,部分肺泡腔萎缩甚至塌陷,有大量炎性细胞渗透,纤维组织增生。 与DM 组相比,JTTM 各剂量组和Met 组均有明显改善。 随着JTTM 剂量的增加,肺组织损害明显改善,炎症细胞浸润减少,纤维组织增生减少,肺泡间距恢复正常。详见图8。
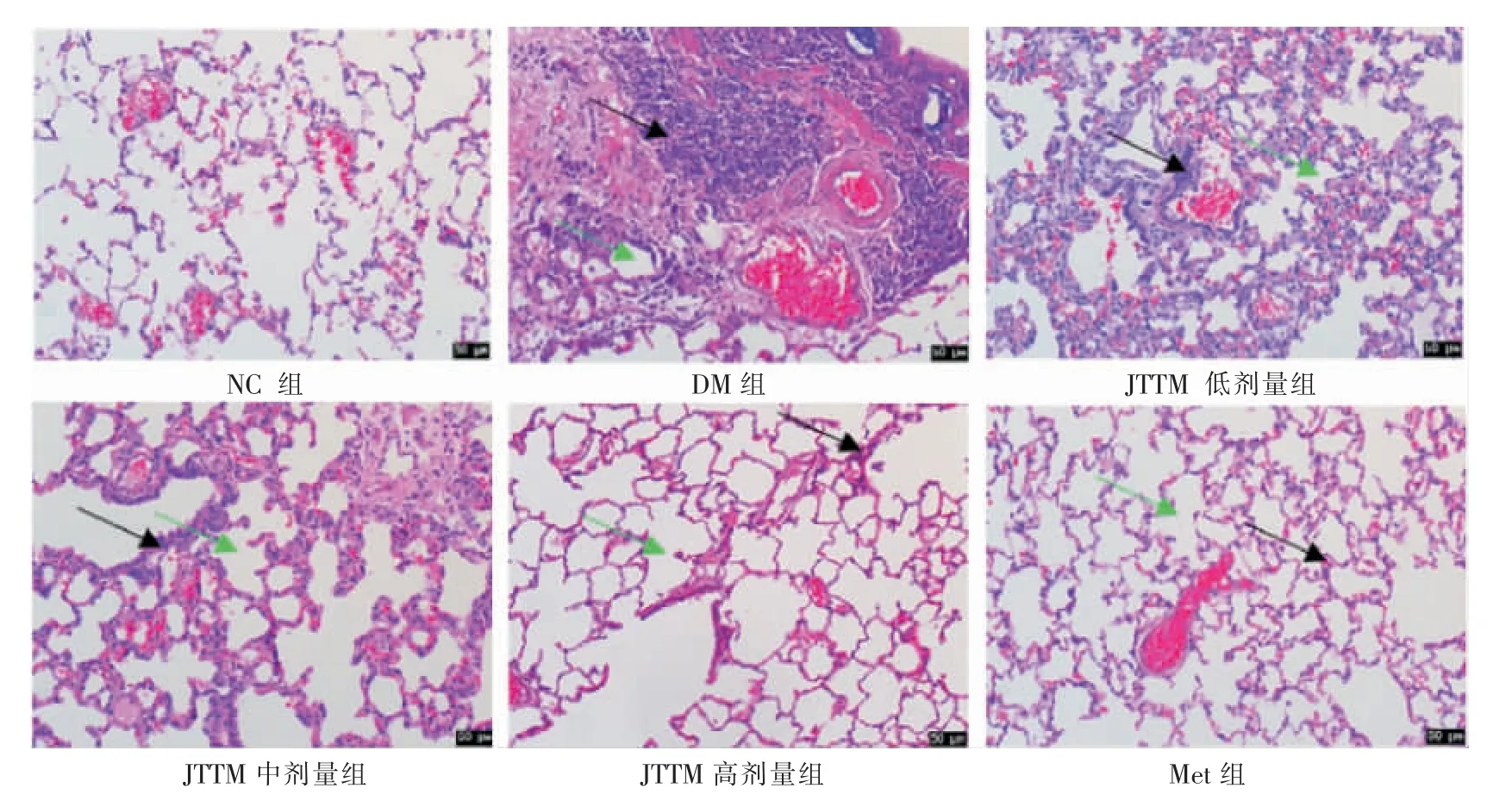
图8 各组大鼠肺组织HE 染色病理结构改变(200×)
3.2.2 各组TGF-β1/Smads 信号通路上的相关蛋白表达 与NC 组相比,DM 组的Smad2、Smad3 和Smad7差异无统计学意义(P>0.05),而p-Smad2 和p-Smad3 在DM组中显著升高(P<0.01)。 p-Smad2 和p-Smad3 在JTTM 组和Met 组中的表达均较DM 组降低(P<0.05)。随着JTTM 剂量的增加,p-Smad2 和p-Smad3 表达水平显著降低(P<0.05)。 而p-Smad7在DM 组中的表达低于NC 组,JTTM 组和Met 组p-Smad7 水平高于DM 组,随着JTTM 剂量的增加,p-Smad7 表达水平显著升高(P<0.05)。 DM组SnoN的表达低于NC 组(P<0.01),但JTTM 组和Met 组SnoN 表达较DM 组增加(P<0.05),与p-Smad7 的表达相一致。 与DM 组相比,JTTM 各剂量组中TGFβ1 降低(P<0.05)。 详见图9。

图9 各组大鼠TGF-β1/Smads 信号通路上的相关蛋白表达
4 讨论
现代研究认为,糖尿病引起的免疫功能下降、氧化应激和微血管病变均可导致肺损害,高血糖会导致肺泡慢性损伤,而细胞外基质(ECM)沉淀增多,破坏肺泡的正常结构,使其顺应性降低,最终导致肺通气和弥散功能丧失而危及生命[9]。 中医学认为其病位在肺,涉及脾肾,属本虚标实之证,本虚以肺脾肾亏虚为主,而阴虚血瘀贯穿糖尿病微血管病变始终,在治疗糖尿病肺损害的过程中以滋阴化瘀为主要治法[10]。 降糖通脉方以女贞子滋阴、黄连清热、川芎活血化瘀,标本兼顾,共奏滋阴化瘀之效,与糖尿病肺损害的病机对应。
通过网络药理学的研究方法,建立了“化合物-靶点”的关系网络,为降糖通脉方多成分的复杂性、多靶点的不确定性、多通路的交叉性提供了科学依据。由“3.1.4”可知降糖通脉方的活性成分中阿魏酸、川芎嗪、小檗碱和女贞苷等与糖尿病肺损害的关系程度明显高于其他。 研究表明,川芎提取物对STZ诱导的糖尿病大鼠具有明显降血糖作用[11]。 阿魏酸通过抑制JAK2/STAT6 免疫信号通路抑制肺癌细胞增殖和转移[12]。 川芎嗪可有效阻断大鼠气道壁中Ⅲ型胶原的合成,抑制网状基底膜层增厚,进而抑制气道重塑早期纤维化的发生[13]。 小檗碱通过cAMP/GP 信号通路可改善2 型糖尿病小鼠的肝糖原结构,修复受损糖原结构以调节肝糖代谢,从而发挥降糖作用[14]。 小檗碱可能通过与AngⅡ诱导IL-1β/NF-κB 通路介导的促炎性反应显著降低2 型糖尿病小鼠血糖[15]。 黄连素可抑制LPS 刺激下大鼠Ⅱ型肺泡上皮细胞促凝及纤溶抑制相关因子表达凝和纤溶抑制[16]。 女贞苷通过提高细胞中AMP 与ATP 浓度的比值激活AMPK 通路从而促进脂联素的高聚化,而脂联素的高聚化对于提高葡萄糖耐受性和胰岛素敏感性具有重要意义[17]。女贞子通过上调T-bet 基因表达和下调GATA3 基因表达, 调节Th1/Th2 之间的平衡,抑制IgE 生成和炎性细胞因子表达,减轻肺和气道的炎症反应[18]。由此可以发现,降糖通脉方的活性成分在治疗糖尿病肺损害方面可能发挥了重要的作用。
根据网络药理学PPI 网络分析筛选得到的核心基因Smad2、Smad3、Smad7、SnoN(Skil)等靶点与文献报道相一致[19]。 GO 生物功能分析中,与降糖通脉方作用靶点即相关联的有DNA-转录因子结合、蛋白质异二聚化活性、 配体激活的转录因子活性、Smad 结合等。 KEGG 信号通路分析得出,降糖通脉方作用靶点主要通过TGF-β 信号通路、AGERAGE 信号通路以及TNF 信号通路等干预糖尿病肺损害,同时也与糖尿病其他微血管并发症存在密切的关系[20]。
通过数据库及文献筛选,降糖通脉方中共得到36 个活性分子、作用靶点有109 个,其中与糖尿病肺损害相关的作用靶点有95 个。 PPI 网络中主要节点有Smad2、Smad3、Smad7、SnoN(Skil)等。分析结果显示,降糖通脉方主要通过蛋白质异二聚化活性、配体激活的转录因子活性、Smad 结合等BP 参与糖尿病肺损害,通过TGF-β 信号通路、AGE-RAGE信号通路以及TNF 信号通路等干预糖尿病肺损害。前期研究发现,此方可以下调TGF-β1 基因表达来干预糖尿病血管损害[21-22]。相关研究也表明,SnoN(Skil)和TGF-β1/Smads 通路与糖尿病肺损害最为密切,可能是其危险因素或共用信号通路[23]。
动物实验结果表明,DM 组肺组织病理结果发现大鼠肺组织的肺泡腔缩小,炎性细胞浸润,肺泡腔被破坏增厚,大量胶原纤维增生,显示早期肺纤维化表现,这与文献报道的糖尿病肺损害大鼠肺组织病理结果是一致的[24-26]。随着JTTM 药物干预剂量的增加,各炎症因子的表达逐渐减少,降糖通脉方可以减轻糖尿病肺损害,有助于糖尿病肺损害的治疗和预后。Smads 作为TGF-β1 家族的下游信号分子,也是TGF-β1 的唯一底物[27]。 在外界刺激下,TGF-β1 受体Ⅰ直接磷酸化Smad2 和Smad3,最后与Smad4 形成三聚体,并在内部转移到细胞核参与调节靶基因转录[28]。 Smad7 是一个抑制Smads 的蛋白,可降低TGF-β1 的表达,通过负反馈调节TGF-β1 信号转导,对糖尿病肺组织起到保护作用[29]。
本研究表明,DM 组TGF-β1 蛋白水平明显高于NC 组,提示糖尿病肺损害与TGF-β1 的过度表达密切相关。 糖尿病大鼠Smad2/3 表达增加、Smad7表达降低,提示TGF-β1 参与糖尿病的肺损害的机制是上调Smad2/3 的表达和下调Smad7 表达。 各组经JTTM 干预后,Smad2/3 表达降低、Smad7 表达上调[30-32]。SnoN 蛋白属于Ski 蛋白家族,它最重要的功能是通过结合Smad 蛋白相互作用,以负向调控TGFβ1 信号转导,有效抑制糖尿病肺损害的发生[33]。 未受TGF-β1 刺激时,SnoN 蛋白与Smad4 结合在DNA 特异性结合位点(Smad binding element, SBE)上,SBE 是Smad2、Smad3、Smad4 多聚体与Smad7基因启动因子的结合位点;反之,SnoN 会与SBE 分离,而Smad2、Smad3、Smad4 多聚体与SBE 结合,使负调控因子Smad7 基因的转录蛋白启动,Smad7 表达增多从而抑制TGF-β1 信号传导[34-35]。 在本研究中,当糖尿病肺损害发生时,TGF-β1/Smads 信号通路与SnoN 蛋白相互作用,可以抑制炎症信号。
综上所述,本研究通过网络药理学预测降糖通脉方治疗糖尿病肺损害的作用机制,并通过动物实验对降糖通脉方治疗糖尿病肺损害的作用效果和潜在的信号通路进行验证,为中医药治疗糖尿病肺损害提供了新的思路。
