灵芝酸A 通过激活Nrf2/GPX4 信号通路减轻七氟烷诱导的HT22 细胞铁死亡
2022-07-30张玉婷谢小娟王彩云张梦露
张玉婷,谢小娟*,王彩云,张梦露
(河南科技大学第一附属医院/河南科技大学临床医学院,河南 洛阳 471003)
七氟烷是临床上常见的挥发性麻醉药,具有麻醉效果好、性质稳定等优点,但七氟烷可引起神经障碍,影响认知功能[1]。 麻醉相关认知障碍常发生在老年患者手术之后,这种现象称为术后认知功能障碍,60 岁以上老年患者出现术后认知功能障碍的比例约为25%[2]。 有研究[3]发现,七氟烷能够诱导神经细胞铁死亡,这可能是七氟烷损伤神经的机制之一。寻找减轻七氟烷造成神经损伤的有效方法是临床麻醉研究中的难点之一。灵芝是十分珍贵的药用真菌,灵芝酸A(ganoderic acid A, GAA)是从灵芝中分离出来的三萜类活性成分,有解毒、镇静、止痛、保肝、抗肿瘤等作用[4]。 另外,GAA 还具有降低胆固醇、调节免疫等作用[5]。有研究[6]发现,GAA 可改善氯化锂-匹鲁卡品诱导的癫痫大鼠海马神经元损伤,对癫痫神经元损伤有改善功效。 此外,GAA 可以减弱Aβ25-35 诱导的HT22 细胞活力降低、 细胞凋亡和衰老[7]。与此同时,GAA 也可以通过刺激β 肾上腺素能受体在体外保护神经细胞免受NO 诱导的应激损伤[8]。 因此,推测GAA 可能对于神经细胞具有保护作用,使其免受外界不良刺激引发的应激反应。与此同时,细胞铁死亡与氧化应激又具有密切的联系[9],核转录因子E2 相关因子2(nuclear factor erythroidrelated factor 2, Nrf2)具有抗氧化应激的作用,Nrf2可诱导谷胱甘肽过氧化物酶4(phospholipid glutathione peroxidase 4, GPX4)表达、抵抗氧化应激,进而减少铁死亡,神经认知功能障碍与Nrf2/GPX4信号通路调控的神经元细胞铁死亡有关[10]。 目前,对GAA 影响七氟烷诱导的神经细胞铁死亡的作用和机制尚不清楚。本研究探讨GAA 对七氟烷诱导的小鼠海马神经元HT22 细胞铁死亡的影响和作用机制,为七氟烷麻醉神经损伤的治疗提供参考。
1 材料与方法
1.1 细胞
小鼠海马神经元HT22 细胞(CL-0697)购自武汉普诺赛生命科技有限公司,使用含有10%胎牛血清的DMEM 培养液培养细胞,置于含有5% CO2的37 ℃恒温培养箱中培养。
1.2 主要试剂和仪器
Fe2+检测试剂盒(E1042-100),购自北京普利莱基因技术有限公司;兔抗GPX4 抗体,购自美国Gene-Tex 公司;谷胱甘肽(glutathione, GSH)检测试剂盒、丙二醛(malondialdehyde, MDA)检测试剂盒,购自北京索莱宝科技有限公司;Lipofectamine 2000,购自美国英杰生命技术有限公司;4-羟基壬烯醛(4-hydroxy-2E-nonenal,4-HNE,批号:ab238538)检测试剂盒,购自美国Abcam 公司;兔抗Nrf2 抗体(批号:sc-365949), 购自美国Santa Cruz Biotechnology 公司;兔抗酯酰辅酶A 合成酶长链家族成员4(Acyl-CoA synthetase long-chain family member 4, ACSL4, 批号:22401-1-AP)抗体,购自美国Proteintech公司;兔抗溶质载体家族成员7 成员11(solute carrier family 7 member 11, SLC7A11,批号:A13685)抗体,购自武汉爱博泰克生物科技有限公司;GAA 纯度≥98%,购自上海源叶生物科技有限公司;七氟烷(生产批号:201008,国药准字H20070172),购自上海恒瑞医药有限公司。 细胞恒温培养箱购自美国赛默飞世尔科技有限公司。
1.3 细胞处理
参考文献中的方法[11],将HT22 细胞分成对照组(Control 组)、七氟烷诱导组(Sev 组)、GAA-25 μmol/L组、GAA-50 μmol/L 组、GAA-100 μmol/L 组。 Sev组、GAA-25 μmol/L 组、GAA-50 μmol/L 组、GAA-100 μmol/L 组细胞在实验0 h 时均给予4%七氟烷处理6 h;另外,不同浓度GAA 组细胞分别添加浓度25、50、100 μmol/L 的GAA 干预。 Control 组细胞按照常规方法培养。 HT22 细胞培养在含有10%胎牛血清的DMEM 细胞培养液中,置于37 ℃、5% CO2培养箱中培养。
1.4 CCK-8 实验检测细胞增殖情况
HT22 细胞接种到96 孔板内,每个孔内添加3000 个细胞,分别在细胞中添加0、25、50、100、200、400、800 μmol/L 的GAA,按照“1.3”项中分组方法处理,培养48 h,在七氟烷处理后,在细胞中添加CCK-8 溶液10 μL,继续孵育3 h。 检测450 nm 处细胞的OD 值,计算细胞存活率。
1.5 比色法检测Fe2+含量
HT22 细胞按照“1.3”项中分组方法处理,收集细胞,用PBS 洗涤细胞2 次,然后用Fe2+检测试剂盒测定Fe2+含量,步骤根据试剂盒说明书操作。
1.6 Western blot 检测Nrf2、GPX4、ACSL4、SLC7A11蛋白表达
HT22 细胞按照“1.3”项中分组方法处理,收集细胞,在细胞中添加含有PMSF 的RIPA 溶液,放在冰上裂解20 min。 4 ℃、12 000×g 离心10 min,吸取上清液,经过BCA 方法检测浓度后,在蛋白上清液中添加5×Loading Buffer,于100 ℃煮沸5 min。采用10%分离胶、5%浓缩胶进行电泳,每个样品孔中添加40 μg 蛋白样品,在浓缩胶中采用90 V 电压电泳,在分离胶中采用120 V 电压电泳。 设置110 V电压转膜,转膜时间为120 min。 将硝酸纤维素膜放在5%脱脂奶粉溶液中,于室温下结合2 h。 然后将NC 膜放在稀释后的一抗溶液(1∶1000 稀释)内,于4 ℃反应过夜。 最后将NC 膜放在稀释后的二抗(1∶2000 稀释)内,在室温下结合2 h。 ECL 方法显色。ImageJ 扫描条带的灰度值,设置GAPDH 作为参照,根据灰度值计算目的蛋白表达量。 目的蛋白表达量=目的条带灰度值/GAPDH 灰度值。
1.7 DCFH-DA 法检测ROS 的相对含量
HT22 细胞按照“1.3”中分组方法处理,收集细胞,PBS 洗涤2 次。 添加10 μmol/L 的DCFH-DA,在37 ℃反应10 min。PBS 洗涤2 次,荧光显微镜下观察并拍照,另外通过荧光酶标仪检测荧光强度,根据荧光强度计算ROS 相对含量。
1.8 检测细胞中MDA、GSH、4-HNE 水平
HT22 细胞按照“1.3”项中分组方法处理,收集细胞,用MDA 检测试剂盒(可见分光光度法)、GSH检测试剂盒(微量法)、4-HNE 检测试剂盒(比色法)测定细胞中MDA、GSH、4-HNE 含量,步骤参照试剂盒说明书进行。
1.9 统计学分析
数据均利用GraphPad Prism 8.0 软件进行统计分析,所有数据资料运用“±s”表示,采用单因素方差分析对组间差异进行分析,P<0.05 表示差异存在统计学意义。
2 结果
2.1 GAA 对HT22 细胞增殖的影响
与0 μmol/L比较,200 μmol/L(P<0.01)、400 μmol/L(P<0.001)、800 μmol/L(P<0.001)GAA 作用后HT22细胞的存活率下降。详见图1。选择对HT22 细胞增殖活性无影响的25、50、100 μmol/L GAA 进行后续实验研究。
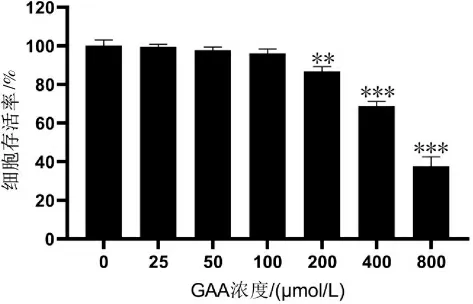
图1 不同浓度的GAA 处理后的HT22 细胞存活率
2.2 GAA 改善七氟烷诱导的HT22 细胞增殖活性降低和铁死亡
与Control 组比较,Sev 组HT22 细胞存活率下降,Fe2+水平升高,并且细胞中ACSL4、SLC7A11 蛋白表达减少(P <0.001);与Sev 组比较,GAA-25 μmol/L 组(P<0.05)、GAA-50 μmol/L 组(P<0.001)、GAA-100 μmol/L 组(P<0.001)的HT22 细胞存活率升高。 与Sev 组比较,GAA-25 μmol/L 组(P<0.01)、GAA-50 μmol/L 组(P<0.001)、GAA-100 μmol/L 组(P<0.001)的HT22 细胞Fe2+水平降低。 与Sev 组比较,GAA-50 μmol/L 组(P<0.001)、GAA-100 μmol/L组(P<0.001)的HT22 细胞中ACSL4、SLC7A11 蛋白表达增多。 详见图2。
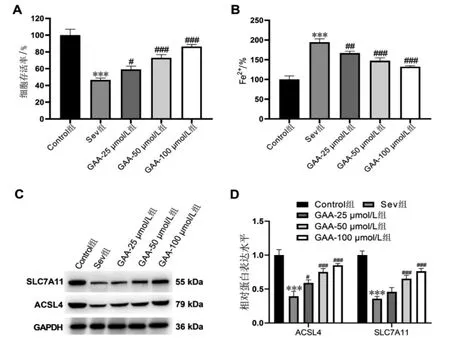
图2 GAA 对七氟烷诱导的HT22 细胞增殖和铁死亡的影响
2.3 GAA 降低七氟烷诱导的HT22 细胞氧化应激
与Control 组比较,Sev 组HT22 细胞中ROS、MDA、4-HNE 含量升高(P<0.001),而GSH 含量降低(P<0.001);与Sev 组比较,GAA-50 μmol/L 组、GAA-100 μmol/L 组的HT22 细胞中ROS、MDA、4-HNE 含量降低(P<0.001),而GSH 含量升高(P<0.001)。详见图3。
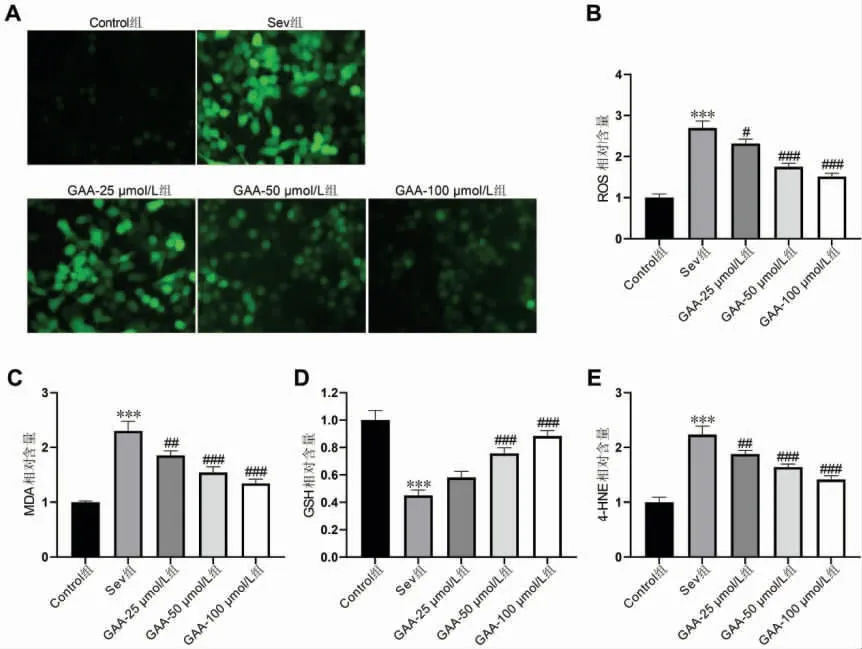
图3 GAA 对七氟烷诱导的HT22 细胞氧化应激的影响
2.4 GAA 激活七氟烷诱导的HT22 细胞中Nrf2/GPX4 信号通路
与Control 组比较,Sev 组HT22 细胞中Nrf2、GPX4 蛋白表达减少(P<0.001);与Sev 组比较,GAA-25 μmol/L 组(P<0.05)、GAA-50 μmol/L 组(P<0.001)、GAA-100 μmol/L 组(P<0.001)的HT22 细胞中Nrf2、GPX4 信号通路。 详见图4。
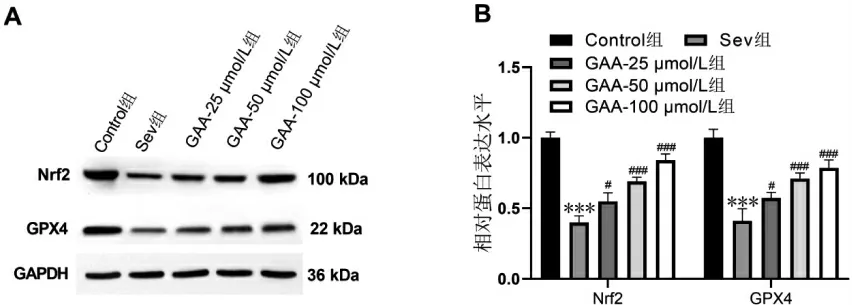
图4 GAA 对七氟烷诱导的HT22 细胞中Nrf2/GPX4 信号通路相关蛋白表达的影响
3 讨论
七氟烷作为临床十分常见的吸入性麻醉药,其可以诱导认知损害[12]。 研究[3]表明,七氟烷处理后的神经细胞增殖活性降低,铁死亡增多,这可能是七氟烷造成神经功能障碍的关键因素之一。 铁死亡的发生常常伴随ROS 含量增多、铁离子水平升高、脂质过氧化异常等现象,铁死亡是细胞死亡的方式之一,在神经系统损伤、肿瘤、肾损伤等相关疾病中存在[13]。铁死亡时,细胞内游离了大量的Fe2+,Fe2+具有极强的氧化作用,其可以与过氧化氢作用,产生羟基自由基,诱导脂质过氧化,MDA、4-HNE 是脂质发生过氧化后的产物[14]。ACSL4 在脂肪酸代谢中发挥作用,可促进长链不饱和脂肪酸活化,ACSL4 缺失时,可导致长链不饱和脂肪酸被氧化,诱导铁死亡[15]。 本研究显示,七氟烷处理后的HT22 细胞增殖活性下降,细胞中Fe2+增多,ACSL4、SLC7A11 蛋白表达减少,这提示七氟烷诱导神经细胞铁死亡,与之前的研究报道一致[15],表明铁死亡可能是七氟烷神经损伤的关键因素之一。七氟烷诱导HT22 细胞增殖活性降低和铁死亡,而GAA 能够提高HT22 细胞增殖活性并减少铁死亡。 GAA 处理能够减弱七氟烷对细胞活性和Fe2+水平的影响,并且能够促进ACSL4、SLC7A11蛋白表达。 这些实验结果表明GAA 可能通过抑制七氟烷神经元细胞铁死亡发挥神经保护作用,GAA 可能是治疗七氟烷麻醉造成的神经损伤的潜在药物。
各种原因导致的过度氧化应激是神经功能损伤的主要诱因之一。 在氧化应激条件下,神经细胞内ROS 水平增加,大量的ROS 可促进细胞内膜脂质和蛋白质发生过氧化,进而导致神经元氧化损伤[16]。GSH 是人体内重要的抗氧化物,其可以清除ROS,将过氧化氢还原为H2O,修复生物膜,抵抗铁死亡[17]。另外,GSH 耗竭还可以诱导GPX4 活性降低,而GPX4 是铁死亡和抗氧化反应的中心调控因子,GPX4 异常被认为是细胞铁死亡的必要条件[18]。GSH的合成受到半胱氨酸浓度影响,半胱氨酸含量不足时,能够阻断GSH 的合成,而SLC7A11 是半胱氨酸蛋白转运系统的重要组成部分[19]。本研究结果显示,七氟烷处理后的HT22 细胞ROS、MDA、4-HNE 含量升高,GSH 含量降低,表明七氟烷导致HT22 神经细胞出现氧化损伤。 同时,GAA 处理可降低细胞中ROS、MDA、4-HNE 水平,并且能够提高GSH 含量,这说明GAA 有抗七氟烷诱导的HT22 细胞氧化应激的作用。
Nrf2 是氧化应激的关键调控因子,其一方面可促进GPX4 表达,一方面又可以诱导GSH 合成,进而抑制铁死亡[20]。 Nrf2/GPX4 信号是氧化应激、铁死亡的重要参与者[21]。 Nrf2 和GPX4 在脓毒症相关认知障碍中发挥作用,Nrf2/GPX4 信号信号通路可能通过诱导海马神经元细胞铁死亡影响神经功能[10]。本实验进一步说明,Nrf2/GPX4 信号参与七氟烷神经损伤,七氟烷神经损伤可能与Nrf2/GPX4 信号通路抑制有关。 GAA 促进Nrf2、GPX4 蛋白表达,说明GAA 可能是通过激活Nrf2/GPX4 信号通路,抑制七氟烷诱导的HT22 细胞铁死亡, 进而发挥神经保护作用。
综上所述,GAA 可减轻七氟烷诱导的HT22 细胞铁死亡,作用机制与激活Nrf2/GPX4 信号通路有关,GAA 可能是改善七氟烷麻醉神经损伤的治疗药物。 本实验结果为七氟烷麻醉神经损伤的治疗提供了思路,为研究七氟烷麻醉神经损伤机制奠定了基础。 后续将继续探讨GAA 抗七氟烷麻醉神经损伤的具体分子靶向机制。
