基于AGEs/RAGE/NF-κB 通路探讨左归降糖通脉方对大鼠脑微血管内皮细胞损伤的保护作用
2022-07-30李钰佳李定祥刘春华邓奕辉
李钰佳,李定祥,张 熙,彭 珣,刘春华,邓奕辉*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省第二人民医院,湖南 长沙 410035)
糖尿病是一种以高血糖为特征的代谢异常疾病。 2019 年国际糖尿病联合会的统计结果显示,全球糖尿病患病率为9.3%(4.63 亿人),预计到2030 年,糖尿病患病率将增至10.2%(5.78 亿人)[1]。糖尿病因其病因复杂、病情控制不理想、并发症多、致残率及致死率高,目前仍需寻求多种有效治疗方法及药物。研究认为,慢性高血糖引起的体内各种糖基化蛋白的过量堆积所形成的晚期糖基化终末产物(advanced glycation end products, AGEs)是造成糖尿病血管病变的主要因素之一[2]。 AGEs 是由蛋白质、 核酸和脂质非特异性糖基化结合形成的稳定不可逆的终末产物[3]。AGEs 可通过结合晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)、破坏正常的分子构象、促进交联、改变酶的活性、 损害受体识别等来影响血管的正常功能[4]。 AGEs 通过与RAGE 结合,诱导核因子κB(nuclear factor kappa-B, NF-κB)的活化,激活一系列下游信号通路,上调炎症因子如白介素-1β(interleukin-1β, IL-1β)、 肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、 细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1 (vascular adhesion molecule-1, VCAM-1)等的释放,最终引起血管壁的损伤,诱发一系列血管并发症[5]。 大量研究认为,抑制RAGE 活性能阻断炎症反应发生途径, 该结论提示RAGE 可能成为糖尿病相关炎症反应通路中的潜在作用靶点,抑制AGEs/RAGE/NF-κB 通路的激活可成为治疗糖尿病脑血管疾病的潜在作用机制[6]。 左归降糖通脉方是中医临床有效方剂,临床研究表明其对糖尿病脑血管并发症的治疗有显著的疗效[7],但目前对该方作用于脑微血管内皮细胞(brain microvascular endothelial cells, BMECs)的作用机制尚不明确。本实验基于AGEs/RAGE/NF-κB 通路探讨左归降糖通脉方对AGEs 诱导BMECs 损伤的干预机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞和动物 实验细胞株选用原代大鼠BMECs,购自武汉原生原代生物医药科技有限公司,批号:RAT-CELL-0039。
SPF 级健康雄性SD 大鼠30 只,鼠龄42 d,体质量(220±20) g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002,于湖南中医药大学动物实验中心内饲养。 大鼠均采用无菌颗粒饲料饲养,自由饮水,环境温度稳定在20~25 ℃,室内通风良好,定时更换垫料。 所有操作符合实验动物伦理学要求,已通过湖南中医药大学实验动物中心伦理审查,伦理审查编号:LL202060301。
1.1.2 药物、试剂和仪器 左归降糖通脉方的方剂组成:熟地黄20 g,枸杞子12 g,山茱萸12 g,黄芪30 g,黄连10 g,地龙12 g,丹参20 g,川芎12 g,水蛭8 g,石菖蒲8 g。 共144 g,购自湖南中医药大学第一附属医院中药房。 采用水煎法,水煎2 次后合并煎液,过滤药渣浓缩至含生药2 g/mL,4 ℃冰箱中储存备用。 尼莫地平片(20 mg/片,正大青春宝药业有限公司,国药准字:H33022285,批号:BJ57178);格列齐特缓释片(30 mg/片,施维雅制药有限公司,国药准字:H20044694,批号:1182108109);RAGE抑制剂(FPS-ZM1)、吡咯烷二硫代氨基甲酸铵(pyrrolidinedithiocarbamate ammonium, PDTC)(美国Med-ChemExpress 公司,批号:945714-67-0、5108-96-3)。
原代细胞培养体系(武汉原生原代生物医药科技有限公司,批号:MED-SUP-0002);人血清白蛋白、吩嗪硫酸二甲酯(美国Sigma 公司,批号:061M700V、P9625);D-葡萄糖、透析袋(北京索莱宝科技有限公司,批号:G8150、YA1045);青霉素、庆大霉素(大连美仑生物科技有限公司,批号:N0521A、J0520A);CCK-8 试剂(日本同仁化学研究所,批号:21208262);兔抗RAGE 抗体(英国Abcam 公司,批号:ab3611);兔抗NF-κB 抗体(美国CST 公司,批号:8242);山羊抗兔IgG、β-actin 抗体(美国Proteintech 公司,批号:SA00001-2、60008);TRIzol(美国Invitrogen 公司,批号:15596018);逆转录试剂盒(北京康为世纪科技有限公司,批号:CW2020S)。引物由上海生物工程公司合成。
高速冷冻离心机(德国Eppendorf 公司,型号:5910R);倒置显微镜(德国Olympus 公司,型号:IX51);电泳仪、电泳槽、荧光定量RCP 仪(美国Biorad 公司,型号:164-5050、165-8000、1855195);转膜仪(北京六一生物科技有限公司,型号:DYCZ-40A);多功能酶标仪(美国伯腾仪器有限公司,型号:Cytation3);旋转蒸发器(上海亚荣生化仪器厂,型号:RE-52AA)。
1.2 方法
1.2.1 BMECs 原代细胞的培养 原代细胞培养体系培养,加入胰蛋白酶1 mL 覆盖于细胞后吸出消化液,作用1~3 min,倒置显微镜下观察,待细胞变圆变亮后与胰蛋白酶脱离、弃去,加入2 mL 完全培养液终止消化,用吸管轻轻吹打培养瓶底部,至细胞脱落,15 mL 离心管中离心(离心半径17.8 cm,800 r/min,5 min),吸去上清液。 加入2 mL 培养液,以1 mL的Tip 头上下吸放数次以打散细胞团块,混和均匀后,转移至新的培养瓶中,每个培养瓶再加完全培养基,置于37 ℃含5% CO2的培养箱中培养。 每1~2 天换液1 次,取传代至4~5 代生长状态良好的细胞用于正式实验。
1.2.2 体外制备AGEs AGEs 的体外制备参照糖孵育法[8],在含100 mmol/L 的D-葡萄糖、200 mg/L的青霉素、70 μg/L 庆大霉素和1.5 mmol/L 吩嗪硫酸二甲酯的磷酸缓冲液(100 mmol/L)中加入人血清白蛋白,于37 ℃恒温箱孵育8 周。 以相同条件但不含葡萄糖的缓冲液孵育的人血清白蛋白作为对照。 孵育结束后以无菌的透析袋置于磷酸盐缓冲液(pH 7.4)中,透析24 h 除去未结合的D-葡萄糖,用0.22 μm 微孔滤膜过滤除菌后置于4 ℃冰箱中保存。
1.2.3 空白血清及含药血清的制备 SD 大鼠适应性喂养1 周,根据体质量按照随机数字表法分为空白组、左归降糖通脉方组和尼莫地平+格列齐特组,每组10 只。左归降糖通脉方组的灌胃剂量按动物体表面积剂量换算法[9],以60 kg 成人2 倍临床等效剂量的药液灌胃[36 g/(kg·d),即4 mL/d],每天1次,持续5 d;尼莫地平+格列齐特组给予尼莫地平片及格列齐特缓释片灌胃,将尼莫地平片及格列齐特缓释片研磨成粉末,加入超纯水配成终浓度分别为2 mg/mL、3 mg/mL的溶液,以60 kg 成人2 倍临床等效剂量灌胃,分别为18.35 mg/(kg·d)、27.5 mg/(kg·d)[10],共4 mL/d;空白组予以相同体积的蒸馏水灌胃。 末次灌胃前禁食12 h,待末次灌胃1 h 后,无菌条件下腹主动脉采血。将所采集的血清置于4 ℃冰箱过夜,待充分凝固后离心(离心半径17.8 cm,3000 r/min,15 min),取上清液,恒温水浴锅56 ℃水浴30 min,灭菌后存放于-80 ℃冰箱。
1.3 药物干预及分组
参考课题组前期研究结果[11],根据CCK-8 结果计算细胞存活率,选取最接近细胞半数抑制率的AGEs 浓度200 mg/L 作用24 h,左归降糖通脉方含药血清最高增殖率浓度5%作用24 h 为造模及给药的最佳作用浓度及时间。 将贴壁70%~80%的BMECs 用胰蛋白酶消化至5 mL 离心管中,细胞计数后调节细胞浓度至104个/mL,细胞悬液随机分成6 组后贴壁培养。 分组为空白组(BMECs+细胞培养液4 mL)、模型组(BMECs+200 mg/L AGEs 细胞培养液4 mL)、左归降糖通脉方组(BMECs+200 mg/L AGEs 细胞培养液4 mL 作用24 h+5%左归降糖通脉方含药血清4 mL)、 尼莫地平+格列齐特组(BMECs+200 mg/L AGEs 细胞培养液4 mL 作用24 h+5%尼莫地平+格列齐特含药血清4 mL)、FPS-ZM1 组(为RAGE 抑制剂,BMECs+FPS-ZM 预处理1 h+200 mg/L AGEs 细胞培养液4 mL 作用24 h)及PDTC 组(为NF-κB 抑制剂,BMECs+PDTC 预处理1 h+200 mg/L AGEs 细胞培养液4 mL 作用24 h)。
1.4 CCK-8 法检测细胞存活率
将贴壁70%~80%的BMECs 用胰蛋白酶消化至5 mL 离心管中,细胞计数后将吹打混匀的细胞悬液浓度调节至1000 个/孔,接种于96 孔板中,孔内的细胞随机分为4 组:空白组(BMECs+细胞培养液)、模型组(BMECs+200 mg/L AGEs 细胞培养液)、左归降糖通脉方组(BMECs+5%左归降糖通脉方含药血清)、尼莫地平+格列齐特组(BMECs+5%尼莫地平+格列齐特含药血清),每孔100 μL,另设仅加细胞培养液的空白孔作为对照。每组设6 个复孔,放入培养箱中培养24 h,待BMECs 充分贴壁后吸出孔内原细胞培养液,加入上述各组不同干预药物,作用24 h,吸出AGEs,加入新鲜细胞培养液,再向每孔中加入10 μL 的CCK-8 溶液,在培养箱内继续孵育1.5 h,用酶标仪测定其在450 nm 处的光密度(optical density,OD)值并进行统计学分析,计算各组细胞存活率。 细胞存活率计算公式:细胞存活率=(给药组OD 值-空白孔OD 值)/(空白组OD 值-空白孔OD 值)×100。
1.5 Western blot 法检测RAGE、NF-κB 蛋白表达
PBS 洗涤各组细胞1~2 次,加入RIPA 裂解液60 μL,冰上裂解30 min,用细胞刮子将裂解后的细胞刮下,低温高速离心机4 ℃低温离心(离心半径17.1 cm,3000 r/min,15 min),取上清液。 采用BCA蛋白定量试剂盒进行蛋白定量;每孔上样40 μg蛋白量,经缓冲液处理后加热变性,以10%聚丙烯酰胺凝胶电泳,先恒压80 V 电泳30 min,待样品至分离胶时,调整电压至110 V 继续电泳90 min;电转移法将蛋白条带转移至聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜上,200 mA 转膜,约2 h;用1×TBST 配制5%的脱脂奶粉,室温封闭1 h;漂洗后分别加入兔抗RAGE 抗体(1∶1000)及兔抗NF-κB抗体(1∶1000),4 ℃冰箱过夜;1×TBST 洗3 次,每次10 min;加入山羊抗兔IgG(1∶5000),37 ℃恒温箱孵育1 h;将洗好的膜用滤纸吸去表面液体,加入1 mL配制好的显影液,放进化学发光凝胶成像仪中进行显影,分析目的蛋白条带的相对灰度值,目的条带灰度值/内参条带灰度值即为目的蛋白相对表达量。每个样品重复3 次。
1.6 RT-PCR 法检测RAGE、NF-κB mRNA 表达
采用TRIzol 试剂提取各组细胞总mRNA。 按照试剂盒操作说明于PCR 仪中进行逆转录;反应完成后,按照说明进行扩增。反应条件为95 ℃10 min,95 ℃15 s,60 ℃1 min,共40 个循环。 每组取3个样本,每个样本3 个复管进行逆转录,确认PCR 的扩增曲线和熔解曲线,记录各个基因的循环阈(cycle threshold, Ct)值。 以β-actin 作为内参,采用2-△△Ct法,计算mRNA 的相对表达量,每组重复3 次。 详见表1。
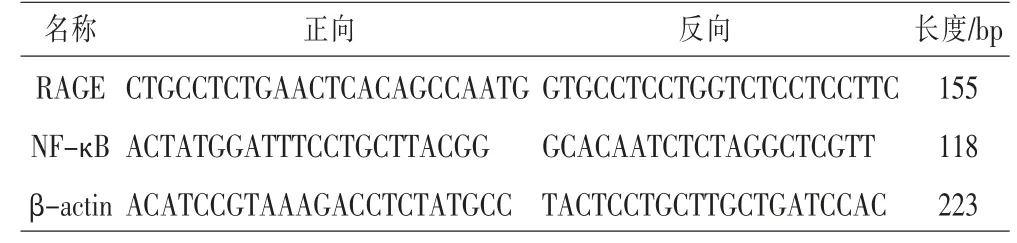
表1 各基因引物序列表
1.7 统计学方法
2 结果
2.1 AGEs 对BMECs 形态的影响
镜下观察BMECs 为梭形,单层贴壁生长,融合后呈“鹅卵状”排列。镜下可见正常细胞胞膜完整,细胞透光性较强;加入200 mg/L 的AGEs 作用24 h后,倒置显微镜下可见BMECs 形态发生明显改变,细胞间隙增宽,细胞分离,胞膜皱缩、轮廓不清甚至破裂。 详见图1。
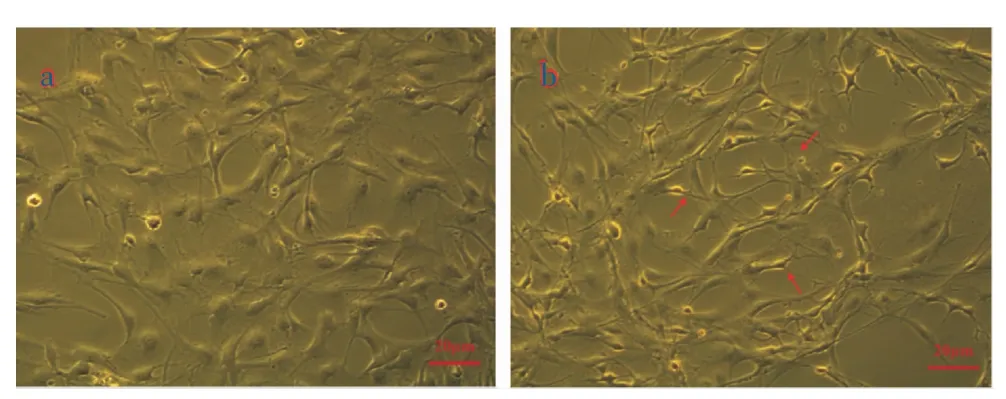
图1 AGEs 对BMECs 形态的改变(倒置显微镜,×200)
2.2 各组细胞存活率比较
与空白组比较,模型组细胞存活率明显下降(P<0.01);与模型组比较,左归降糖通脉方组及尼莫地平+格列齐特组细胞存活率升高(P<0.01);与左归降糖通脉方组比较,尼莫地平+格列齐特组细胞存活率降低(P<0.05)。 详见表2。
表2 各组BMECs 中细胞存活率比较(±s,n=6)

表2 各组BMECs 中细胞存活率比较(±s,n=6)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与左归降糖通脉方组比较,&P<0.05。
组别空白组模型组左归降糖通脉方组尼莫地平+格列齐特组存活率/%100.00±7.88 74.30±4.75**121.19±2.72**##107.82±1.53**##&
2.3 各组RAGE、NF-κB 的蛋白表达水平比较
与空白组相比,模型组RAGE、NF-κB 蛋白表达水平明显上调(P<0.01);与模型组比较,左归降糖通脉方组、 尼莫地平+格列齐特组、FPS-ZM1 组及PDTC 组RAGE、NF-κB 的蛋白表达水平明显下调(P<0.05);与左归降糖通脉方组比较,尼莫地平+格列齐特组RAGE、NF-κB 及PDTC 组RAGE 蛋白表达水平降低(P<0.05);与尼莫地平+格列齐特组比较,FPS-ZM1 组RAGE、NF-κB 的蛋白表达水平升高(P<0.05);与FPS-ZM1 组比较,PDTC 组RAGE 蛋白表达水平降低(P<0.01)。 详见图2、表3。
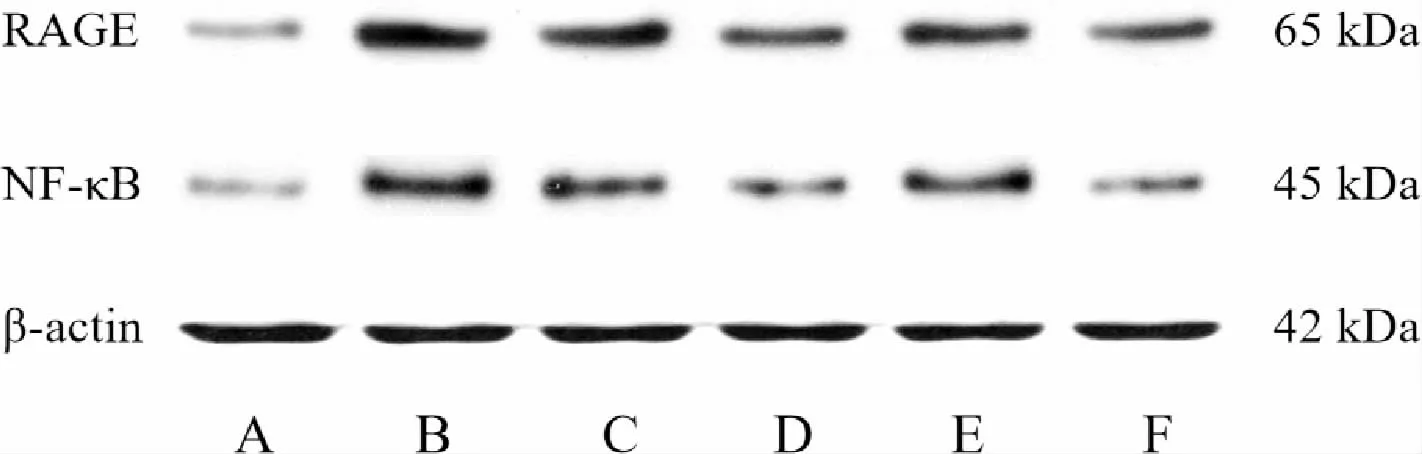
图2 各组BMECs 中RAGE、NF-κB 的蛋白表达电泳图
表3 各组BMECs 中RAGE、NF-κB 蛋白表达水平比较(±s,n=6)
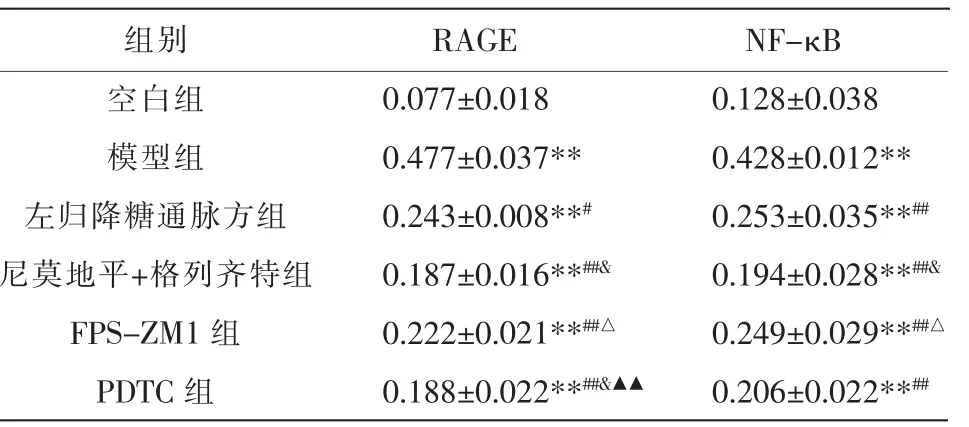
表3 各组BMECs 中RAGE、NF-κB 蛋白表达水平比较(±s,n=6)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与左归降糖通脉方组比较,&P<0.05;与尼莫地平+格列齐特组比较,△P<0.05;与FPS-ZM1 组比较,▲▲P<0.01。
组别空白组模型组左归降糖通脉方组尼莫地平+格列齐特组FPS-ZM1 组PDTC 组RAGE 0.077±0.018 0.477±0.037**0.243±0.008**#0.187±0.016**##&0.222±0.021**##△0.188±0.022**##&▲▲NF-κB 0.128±0.038 0.428±0.012**0.253±0.035**##0.194±0.028**##&0.249±0.029**##△0.206±0.022**##
2.4 各组RAGE、NF-κB mRNA 表达水平比较
与空白组比较,模型组RAGE、NF-κB mRNA表达水平明显上调(P<0.01);与模型组比较,左归降糖通脉方组、尼莫地平+格列齐特组、FPS-ZM1 组及PDTC 组RAGE、NF-κB mRNA 表达水平明显下调(P<0.05);与左归降糖通脉方组比较,尼莫地平+格列齐特组及PDTC 组RAGE mRNA 表达水平降低(P<0.05);与尼莫地平+格列齐特组比较,FPS-ZM1组RAGE mRNA 及PDTC组RAGE、NF-κB mRNA表达水平明显升高(P<0.05)。 详见表4。
表4 各组BMECs 中RAGE、NF-κB 的mRNA 表达水平比较(±s,n=6)
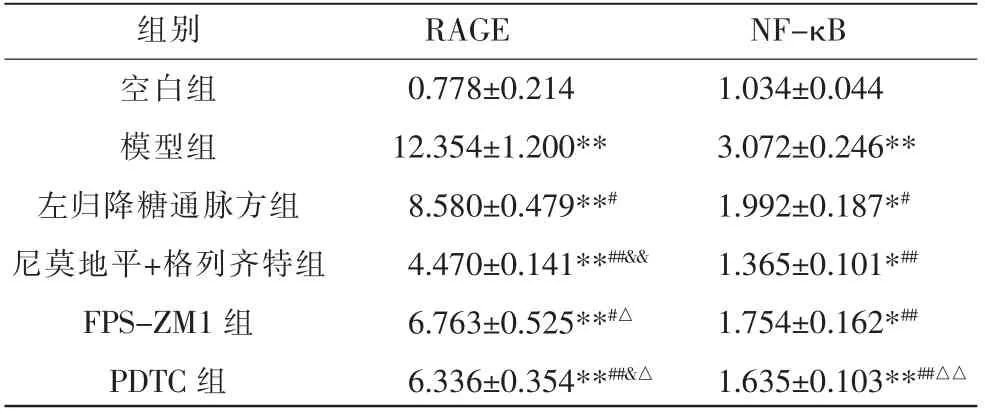
表4 各组BMECs 中RAGE、NF-κB 的mRNA 表达水平比较(±s,n=6)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与左归降糖通脉方组比较,&P<0.05,&&P<0.01;与尼莫地平+格列齐特组比较,△P<0.05,△△P<0.01。
组别空白组模型组左归降糖通脉方组尼莫地平+格列齐特组FPS-ZM1 组PDTC 组RAGE 0.778±0.214 12.354±1.200**8.580±0.479**#4.470±0.141**##&&6.763±0.525**#△6.336±0.354**##&△NF-κB 1.034±0.044 3.072±0.246**1.992±0.187*#1.365±0.101*##1.754±0.162*##1.635±0.103**##△△
3 讨论
AGEs 能介导内皮细胞、平滑肌细胞和单核吞噬细胞等细胞的促炎作用并诱导氧化应激,是引起糖尿病及其并发症发生、发展的主要因素[12]。 AGEs作用于机体导致疾病发生的途径有多种,目前认为受体途径是引起血管内皮损伤导致疾病发生的最主要途径[4]。 RAGE 是AGEs 的主要作用受体,当细胞或局部组织处出现RAGE 的配体或炎症因子聚集时,可上调RAGE 的表达。 NF-κB 是一种蛋白质复合物,是促炎症因子的转录因子之一,能对有害的细胞刺激,如感染、炎症反应等作出迅速的反应[13]。当细胞处于静息状态时,NF-κB 与其抑制分子相结合,以非活化的状态存在于胞质中;NF-κB 被促炎症因子、细菌成分、病毒等刺激后,NF-κB 复合物发生磷酸化并降解,激活后的NF-κB 发生核转移,与下游靶基因的增强子位点结合,启动靶基因的转录和表达,激活下游信号通路,诱导各种炎症反应的发生并释放炎症因子,破坏了血管内皮细胞的正常生理功能及形态结构,最终造成血管细胞的损伤[14]。NF-κB 参与了AGEs 介导的多条信号通路,在与AGEs 相关的炎症反应中起着关键作用。RAGE 的激活能活化静息状态下的NF-κB,活化后的NF-κB又能上调RAGE 的活化和表达,形成反馈调节系统,放大炎症反应效应。 糖尿病患者长期的高血糖状态引起血液中AGEs 含量的增多,RAGE 表达上调,激活NF-κB,诱导释放多种炎症因子,造成不同程度的血管内皮损伤,从而引起血管并发症的发生[15]。
糖尿病血管并发症包括各种大血管及微血管并发症,大血管在体内直行分布,运输血液沟通上下,微血管为大血管的分支,呈网状分布于全身,将营养物质运输至各组织器官。 在生理结构及功能上,大血管类似于中医的“经脉”,微血管类似于中医的“络脉”,共同构成了人体的经络网络体系[16-17]。 基于中医络病学理论,现代医家认为糖尿病血管并发症的病位在脉络,痰瘀阻滞,日久化热,瘀、热、痰等多种病理产物在络脉中相互胶结,合而为毒,糖尿病性脑病的主要病机为络脉瘀结,毒损脑络[18]。 消渴日久,气血日益亏虚,气血运行无力,久则化瘀,加之消渴病本为阴虚燥热,阴虚津亏则瘀愈甚,津凝为痰,痰瘀互结,阻滞脉络则发而为病[19-20]。 左归降糖通脉方由左归丸加减化裁而来,滋阴益气、化瘀解毒,使祛瘀而不伤正、扶正而不留滞。 前期研究证明,该方可对抗实验性糖尿病大鼠的脂质过氧化对机体的损伤,能显著缓解糖尿病合并脑血管并发症患者的临床症状,改善糖尿病并发脑梗死患者的神经功能缺损,并在一定程度上抑制炎症反应的发生和发展,具有良好的降糖、降脂、抗炎等作用[7]。
本课题组前期研究了AGEs 对人静脉内皮细胞及BMECs 的影响,认为其对内皮细胞的损伤作用主要为炎性损伤[8],为了证实中药复方的有效性,选择尼莫地平片+格列齐特缓释片作为阳性对照药物[10]。 既往研究表明,随着浓度的增加和作用时间的延长,一定浓度的AGEs 可造成细胞不可逆损伤,释放IL-1β、ICAM-1、VCAM-1 等炎症因子[11]。 倒置显微镜下可见加入AGEs 后,BMECs 结构遭到明显破坏,提示糖尿病患者体内持续的血管内皮高糖状态导致BMECs 活力下降、损伤甚至死亡。Western blot及RT-PCR 结果表明,与加入了AGEs 的受损细胞的模型组相比,左归降糖通脉方含药血清能明显降低细胞内RAGE、NF-κB 蛋白及mRNA 的表达;通过各药物组与模型组之间的比较以及药物组间的比较发现,左归降糖通脉方组、尼莫地平+格列齐特组、FPS-ZM1 组和PDTC 组细胞的RAGE、NFκB 蛋白和mRNA 的表达水平均出现不同程度的降低,其中左归降糖通脉方组表达水平的下降程度与FPS-ZM1 组更为接近,由此可以推测左归降糖通脉方含药血清干预BMECs 的作用机制可能与FPSZM1 的作用机制更为接近。 FPS-ZM1 和PDTC 分别抑制了下游炎症反应信号通路发生的两个作用阶段,即AGEs 与RAGE 的结合以及NF-κB 的激活。 FPSZM1 是高亲和力的RAGE 抑制剂,可在高糖环境中通过抑制RAGE 的表达抑制神经炎症反应的发生[21]。 PDTC 是一种可以通透细胞膜的NF-κB 活化抑制剂,能直接抑制NF-κB 信号通路的激活及下游信号的传递,阻断多种炎症反应的发生[22]。本研究结果提示,左归降糖通脉方干预AGEs 损伤BMECs可能是通过直接阻断AGEs 与膜蛋白受体RAGE 的结合,进而抑制下游关键因子NF-κB 的活化,阻断下游信号的传递,抑制炎症反应的发生和炎症因子的释放,降低AGEs 对BMECs 的炎性损伤。RAGE阻滞剂和NF-κB 抑制剂两组之间的蛋白和mRNA的表达较为接近,这可能是由于NF-κB 与RAGE 之间存在反馈调节机制,以至于两组间差异不明显。
综上所述,本研究证明左归降糖通脉方能有效抑制AGEs 对BMECs 的炎性损伤,其作用机制可能是通过抑制AGEs 与RAGE 的结合,抑制了AGEs/RAGE/NF-κB 通路,并下调了炎症因子的释放,从而对BMECs 起到保护作用。
