附带溶媒药品有效期的风险防控管理
2022-07-29章萍尹冬苗文娟刘宁褚娜
章萍 尹冬 苗文娟 刘宁 褚娜
为了便于药物稀释、溶解或满足某些药品所需溶解度、pH值和稳定性等要求,部分注射用药品在包装内随主药配备了专用溶媒(简称附带溶媒药品)[1]。除附带溶媒为灭菌注射用水或0.9%氯化钠注射液可用替代品外,其他附带的专用溶媒均难以替代,临床使用中如以其他溶媒替代,可能导致药物溶解度下降、pH 值变化、稳定性降低等情况,增加患者用药的风险[1-6]。笔者在工作中发现,附带溶媒药品存在药品外包装有效期标识不统一,药品附带溶媒标注信息不全,药品生产企业质量管理人员、医药公司配送人员、医疗机构使用人员知晓程度不足,患者对于附带溶媒药品内外包装有效期包装不一致产生疑问等情况。为此,笔者调查分析了中国医学科学院血液病医院2017 年7 月—2020 年12 月附带溶媒药品的内外包装信息标注情况、药品验收、药品发放及临床应用等环节存在的风险隐患,制定了不同环节的管控对策,以保证医疗质量和患者的用药安全。
1 资料与方法
1.1 一般资料
本研究时间为2017 年7 月—2020 年12 月,分为情况调研阶段(2017 年7—12 月)和管控措施实践阶段(2018 年1 月—2020 年12 月)。收集本研究持续时间内中国医学科学院血液病医院使用的所有附带溶媒的药品说明书,记录内外包装标注信息、外包装封签情况,对该类药品生产企业质量管理人员、医药公司药品配送人员、本医疗机构使用人员等的访谈信息。
1.1.1 内外包装信息标注情况 由2 位研究者分别收集2017 年7 月—2020 年12 月中国医学科学院血液病医院使用的所有附带溶媒药品说明书,记录药品外包装标注的有效期、批号,内包装标注的主药和溶媒的有效期、批号,采用自行设计的Excel 数据记录表录入药品名称、规格、生产厂家,外包装标注的有效期、批号,内包装标注的主药有效期、批号,附带溶媒成分、生产厂家、有效期、批号,由双人交叉复核数据。采用Excel 软件,对收集到的信息进行描述性统计分析。
1.1.2 外包装封签检查 由2 位研究者共同完成外包装封签的检查和记录。查看中国医学科学院血液病医院使用的所有附带溶媒药品的外包装是否带有封签或粘胶,以确定能否在不影响药品销售的情况下开盒查验内包装信息。采用Excel 软件,对收集到的信息进行描述性统计分析。
1.1.3 附带溶媒药品生产、配送、使用人员访谈记录(1)通过电话或当面访谈的形式,了解药品生产企业质量管理人员和医药公司配送人员对附带溶媒药品相关法规、管理流程的知晓程度;(2)通过当面访谈形式了解病区护士对附带溶媒药品的临床使用情况和溶媒成分、有效期管理的知晓程度。对收集到的信息进行描述性记录。
1.2 方法
对情况调研阶段(2017 年7—12 月)的调查结果进行汇总分析,找出附带溶媒药品管理中存在的风险点。从2018年1月—2020 年12 月开展风险管控实践,并与情况调研阶段的情况进行对比,分析管控措施实践的效果。
1.2.1 加强药品入库前监管 建议附带溶媒药品生产厂家加强附带溶媒药品有效期的标注管理,若主药及溶媒有效期发生变更时,均须提供书面说明并交至中国医学科学院血液病医院药剂科备案,做到每一个附带溶媒药品外包装、主药、溶媒有效期标注变化均在药剂科监控之中。对外包装标注主药有效期,但溶媒有效期短于主药有效期的药品,暂停采购,直至符合《药品组合包装与药品专用溶媒注册说明》[7]中“所配溶媒的有效期不得短于药品的有效期”的要求。对溶媒未标注效期的药品,由生产厂家提供书面证明,证明溶媒效期与主药有效期的关联性。
1.2.2 完善附带溶媒药品的管理流程 完善药品有效期管理制度,制定附带溶媒药品效期管理规范及验收流程。由附带溶媒药品生产企业向医药公司提供每批次主药、溶媒有效期信息,医药公司依据附带溶媒药品生产企业提供的每批次主药、溶媒有效期信息,填写《附带溶媒药品信息登记表》,内容包括附带溶媒药品名称、规格、外包装生产厂家、批准文号,批号、有效期,内包装主药批号、有效期,内包装附带溶媒批号、有效期等。医药公司将药品配送至医疗机构药库时,药库药师进行入库验收,除查验药检报告、随货单及登记药品外包装批号、有效期外,须同时验收医药公司登记中国医学科学院血液病医院设计的主药及溶媒有效期信息表《附带溶媒药品信息登记表》,保证入库药品符合“所配溶媒的有效期不得短于药品的有效期”的要求。药库药师每月1次对附带溶媒药品进行拆包装抽查,进一步确保该类药品符合“所配溶媒的有效期不得短于药品的有效期”的要求。
1.2.3 加强药师及医护人员宣传教育 对药师及医护人员,采取培训、微信群、邮件发送等方式加强对附带溶媒药品有效期风险管理的宣传教育,对于1 个包装中含有1 支以上的主药和溶媒的附带溶媒药品(如注射用丁二磺酸腺苷蛋氨酸),药师发放该类药品和护士配置该类药品时,要逐支核对主药和溶媒的有效期。医疗机构引进新的附带溶媒药品时,药库药师需通过微信群、邮件等方式将附带溶媒药品主药和溶媒批号、成分、有效期、配置方法等信息通知药房药师和医护人员。
2 结果
2.1 情况调研结果
2017 年7—12 月,中国医学科学院血液病医院药品目录中注射剂药品共420 种,有16 种为附带溶媒药品,详见表1。其中,国产药品9 种(表1 中1~9 号);进口分装药品6 种(表1中10~15 号),进口药品1 种(表1 中16 号)。
2.1.1 内外包装信息标注情况 16 种附带溶媒药品中,存在外包装有效期标识不统一,内包装溶媒标注有效期、批号、生产厂家不全,溶媒成分标识不明的情况。
(1)外包装有效期标识不统一。表1 中16 种附带溶媒药品外包装均只标有1 个批号及有效期,其中,15 种药品外包装(1~7 号、9~16 号)仅标注主药有效期,1 种药品(8 号)外包装仅标注主药有效期或溶媒有效期。外包装标注主药有效期的15 种药品中,1 种(9 号)药品的溶媒有效期短于主药,1 种(10 号)药品的溶媒未标注有效期,属于溶媒游离于有效期监管外的风险。2017 年7—12 月共进10 批次伏立康唑,其中3 个批次溶媒有效期短于主药,但外包装只标注主药有效期,详见表2。2017 年7—12 月共进5 个批次注射用右雷佐生,3 个批次主药和溶媒相同,1 个批次溶媒有效期长于主药,1 个批次溶媒有效期短于主药,外包装标注为有效期短者,详见表3。虽未造成主药或溶媒游离在有效期监管外的风险,但不符合《药品组合包装与药品专用溶媒注册说明》[7]中“所配溶媒的有效期不得短于药品的有效期”的要求。
(2)内包装溶媒标注生产厂家、有效期、批号信息不全。16 种附带溶媒药品中,有9 种药品(1~3 号、8~9 号、11~12 号、15~16 号)同时标注溶媒的生产厂家、有效期和批号;10 种药品标注了溶媒生产厂家,溶媒生产厂家均同主药生产厂家,6 种药品(4~7 号、13~14 号)的溶媒未标注生产厂家。1 种药品(10 号,注射用重组人粒细胞刺激因子)未标注溶媒有效期。5 种药品(4 号、7 号、10 号、13~14 号)未标注溶媒批号。
(3)溶媒成分标识不明。16 种附带溶媒药品中,有溶媒成分标识者14 种,包括注射用水7 种(1 号、5~6 号、10号、13~15 号)、组合溶媒3 种(4 号、7 号、9 号)、含苯甲醇稀释液2 种(11~12 号)、0.9%氯化钠注射液1 种(16 号)、乳酸钠注射液1 种(8 号),未明确标识溶媒成分、仅标注稀释剂者2 种(1 号、3 号)。
2.1.2 附带溶媒药品外包装封签情况 16 种附带溶媒药品中,有4 种(1 号、3 号、7 号、15 号)(表1)外包装有封签或粘胶,无法在不影响药品销售的情况下,开盒查验内包装信息。
2.1.3 附带溶媒药品生产企业、配送企业、使用人员知晓情况调查 调研阶段,研究者对16 种附带溶媒药品的13家药品生产企业的13 名质量管理人员进行了13 次电话访谈,了解其对附带溶媒药品有效期管理的知晓程度。结果显示,有5 家企业质量管理人员不清楚附带溶媒药品按照《药品组合包装与药品专用溶媒注册说明》[7]中“所配溶媒的有效期不得短于药品的有效期”规定。对8 家医药公司配送人员进行8 次访谈,了解其对附带溶媒药品有效期管理规范、操作流程的知晓情况。结果显示,被访谈医药公司均无相应管理规范和验收流程。对中国医学科学院血液病医院18 名病区护士共进行18 次访谈,了解其对附带溶媒药品的有效期标注及配置信息知晓情况,18 名护士均未发生过用其他溶媒代替专用溶媒和弃用专用溶媒、直接用其他溶媒溶解主药的情况,但有10 名护士存在临床配置药品时仅核对外包装有效期及主药有效期,未核对附带溶媒有效期的情况。
2.2 管控实践效果
2.2.1 内外包装有效期标注情况 2018 年1 月—2020 年12月管控措施实践阶段结果显示,调研阶段的16 种附带溶媒药品,除2 种(表1,11 号、12 号)取消附带溶媒、2 种停用(表1,7 号、15 号),其余12 种以及新增该类3 个品种(表4,17~19 号)外包装均标注了主药的有效期,并且溶媒有效期长于或等于主药有效期。2018 年1 月—2020 年12 月中国医学科学院血液病医院共采购46 批次国产注射用伏立康唑,其中44 批次溶媒有效期长于主药有效期,2 批次溶媒有效期等于主药有效期;共采购右雷佐生30 批次,外包装均标注为主药有效期,溶媒有效期不短于主药有效期。从2018 年1 月起,内包装未标注溶媒生产厂家的药品(表1,10 号)生产厂家提供了该药品溶媒有效期与主药有效期关联性佐证材料,证明溶媒与主药有效期相同,符合《药品组合包装与药品专用溶媒注册说明》[7]中“所配溶媒的有效期不得短于药品的有效期”规定。2018 年1 月—2020 年12 月管控措施实践阶段,中国医学科学院血液病医院附带溶媒药品主药和溶媒均在有效期监管范围内。
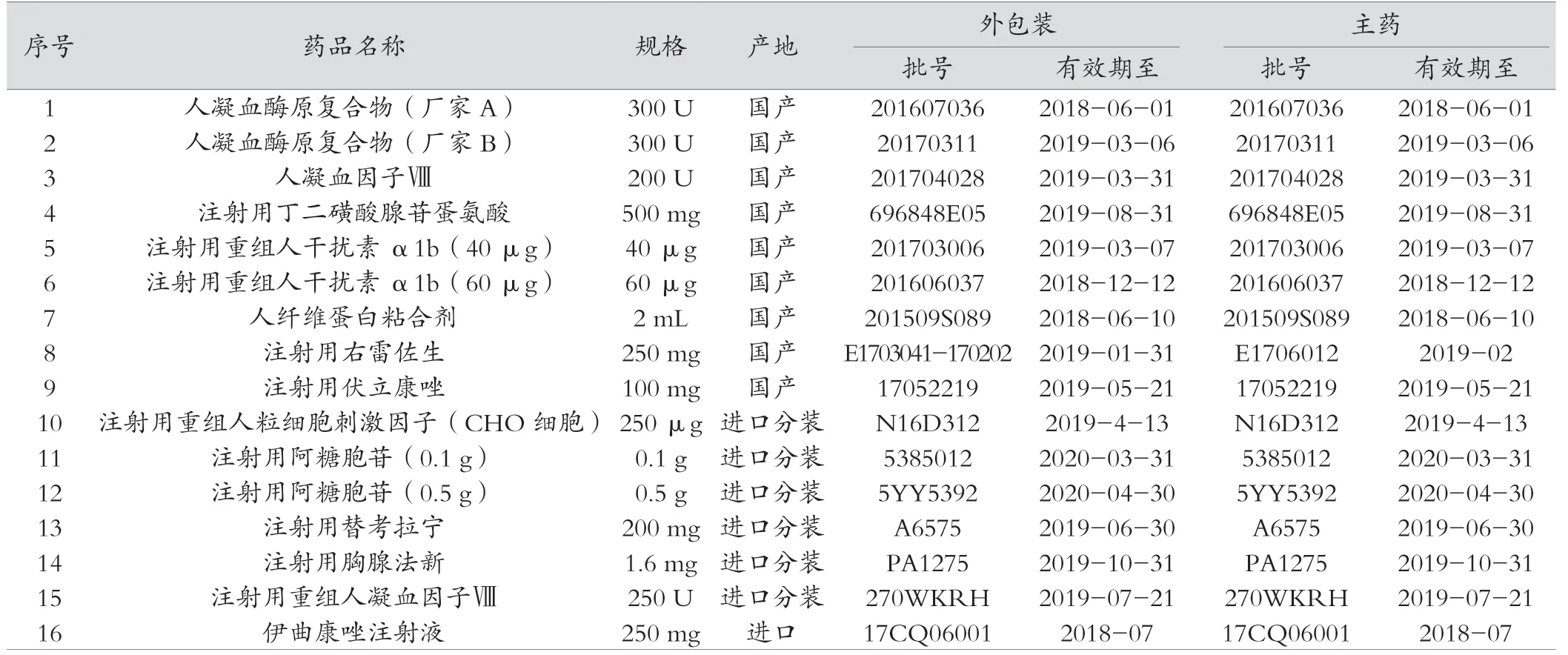
表1 附带溶媒药品的内外包装信息标注调查结果

表1 (续)
2.2.2 附带溶媒药品品种变化管理 管控措施实践期间,中国医学科学院血液病医院附带溶媒药品品种变化如下,详见表4。注射用阿糖胞苷(10 号、11 号)溶媒为含抑菌剂(苯甲醇)的稀释液,为减少不良反应的发生,该药品于2018 年4 月起取消附带溶媒。人纤维蛋白粘合剂停用。注射用重组人凝血因子Ⅷ(15 号)替换为新品种注射用重组人凝血因子Ⅷ(17 号),新增注射用重组人凝血因子Ⅷ(500 IU,18 号)和重组人凝血因子Ⅸ(19 号)。新品种均按照附带溶媒药品有效期管控流程要求,未发生内外包装有效期标注的风险漏洞。
2.2.3 临床宣教指导效果 加强宣教指导后,每年进行1次附带溶媒药品管理知识考核,2018—2020 年管控措施实施阶段,共进行3 次药师及医护人员对附带溶媒药品培训考核,合格率均达100%。
3 讨论
附带溶媒药品内包装主药及溶媒分别标注有效期,而外包装仅标注1 个有效期,会造成主药或溶媒之一游离在有效期管理之外,给用药安全带来极大隐患。北京市药品评审中心发布的《药品组合包装与药品专用溶媒注册说明》[7]指出,附带溶媒药品包装中的药品及所用溶媒必须是已获准注册的药物,所配溶媒有效期不得短于药品有效期。对于附带溶媒药品的外包装是仅标注主药有效期、还是主药和溶媒均标注有效期,目前并无相关法规要求。通常情况下,主药和溶媒分别标注有效期、批号等信息,但药品外包装只标注一个批号和有效期。李然等[8]对19 种附带溶媒药品内外包装上有效期标注进行的调研结果显示,仅个别药品(1/19)的外包装同时标注了主药和溶媒的有效期。《中华人民共和国药品管理法》[9]规定,若药品超过有效期销售则按劣药论处。
笔者调研的结果显示,10 个批次伏立康唑中(表2),有3 个批次存在外包装标注主药有效期,而内包装溶媒有效期短于主药的问题,说明不是厂家标注疏忽的个例,是生产厂家在溶媒和主药及外包装有效期标识上没有按照《药品组合包装与药品专用溶媒注册说明》中“所配溶媒的有效期不得短于药品的有效期”的要求进行管理。调研中还发现,在5 个批次右雷佐生(表3)中,有3 个批次外包装有效期标注主药,溶媒有效期等同于主药,1 个批次外包装标注主药,溶媒有效期长于主药,1 个批次外包装标注溶媒,溶媒有效期短于主药,提示该药品外包装有效期和内包装主药或溶媒有效期不一致,工作中针对该类药品,药师应对患者做好药品有效期的药学指导工作。对于附带溶媒药品,建立从生产企业到医药公司配送、医疗机构验收入库、发放使用等环节内外包装有效期全程化管理,并及时将医疗机构新引进该类药品纳入有效期管理。附带溶媒药品有效期标注的问题目前依然存在,该类药品内外包装有效期标注标准仍然没有统一,中国医学科学院血液病医院对该类药品逐品种进行持续管控,保证了中国医学科学院血液病医院应用的该类药品有效期合格,建议生产厂家、应用附带溶媒药品单位引起重视,持续将该类药品主药及溶媒纳入有效期管理,杜绝药品过期隐患。
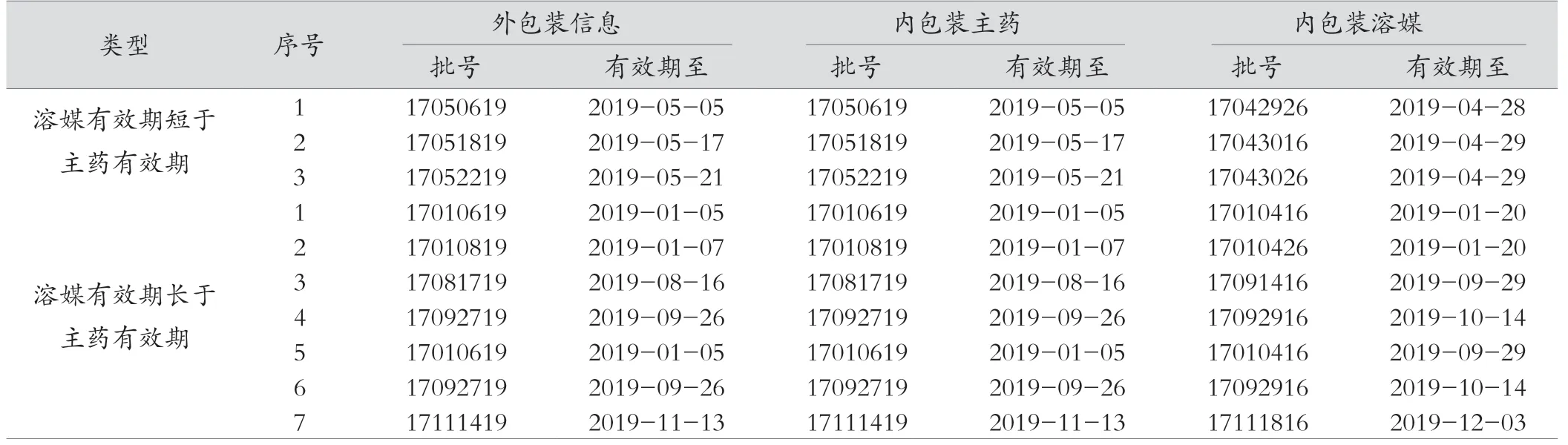
表2 10 批次注射用伏立康唑的有效期标注明细

表3 5 批次注射用右雷佐生的有效期标注明细

表4 管控措施实践后附带溶媒药品的变更情况
在临床应用中,附带专用溶媒的不可替代性、溶媒可能导致的不良反应、重复开具溶媒医嘱、溶媒和主药混淆使用是该类药物的关键风险点,需要药师高度重视,做好宣教指导并密切追踪监测,以保证临床安全用药。对于流转过程中溶媒破损的发生,如果主药贵重且溶媒为非专用溶媒如注射用水或0.9%氯化钠注射液,为避免主药浪费,可以考虑选择可替代的溶媒,但对于专用稀释剂,则禁止随意替代,主药需做退换或报损处理,以免发生用药风险。注射用丁二磺酸腺苷蛋氨酸为偏酸性药物,其附带专用溶媒由L-赖氨酸、氢氧化钠和注射用水组成,为偏碱性溶液,可中和丁二磺酸腺苷蛋氨酸的酸性,使输注溶液pH 值接近人体生理pH。如果不以专用溶媒溶解可能会使输注溶液pH 值过低,刺激血管甚至造成静脉炎等不良反应[10]。有文献报道[11]静脉滴注注射用丁二磺酸腺苷蛋氨酸时,以0.9%氯化钠注射液替代专用溶媒导致局部疼痛、红肿不良反应;另有报道[12]丁二磺酸腺苷蛋氨酸在未用专用溶剂稀释时,与头孢哌酮舒巴坦连续输注在输液管产生白色絮状沉淀,而正常配置时无沉淀发生。注射用右雷佐生附带的专用溶媒为0.167 mol/L 乳酸钠注射液,张亚坤等[13]考察了使用专用溶媒配置和非专用溶媒配置的稳定性,结果表明,使用专用溶媒的稳定性优于非专用溶媒,且专用溶媒起到调节pH 值的作用,可减轻输液时对患者的刺激性和潜在风险。因此,需加强静配药师和护士对于附带专用溶媒药品配置规范性的宣教,不得随意弃用药品附带专用溶媒,以避免溶媒使用不当造成的治疗风险。有些溶媒成分如含有苯甲醇、丙二醇的溶媒,可能会有发生不良反应的风险[14-15];注射用伏立康唑(四川美大康)的专用溶媒中含有乙醇,有报道[16-17]在临床使用中与头孢类药物合用有发生双硫仑反应的风险,需引起重视,并且须与不附带溶媒的同通用名药品加以区分。临床药师需提示护理人员在输注该类药物时警惕溶媒不良反应,加强不良反应主动监测。除此之外,对于附带溶媒药品还应注意重复开具溶媒和将溶媒与主药混淆等情况[18],药师需加强医嘱审核及与临床信息的沟通,以避免用药差错的发生。
综上所述,附带溶媒药品的专用溶媒大多难以替代,其主药和溶媒的内外包装有效期及相关信息标注情况不统一,是该类药品管理的高危风险点,应引起高度重视。除了建议药品监督管理部门进一步完善相关管理规定外,从生产企业、医药公司配送,到医院验收入库、药房发放至临床应用需要加强全程化的风险管理,才能达到有效降低该类药品管理风险的目标,保证医疗质量和患者安全用药。
