佛手益生菌软糖的制备及其体外消化耐受性分析
2022-07-29唐莹邹波余元善李璐徐玉娟肖更生吴继军
唐莹,邹波,余元善,李璐,徐玉娟,肖更生*,吴继军
(1.华中农业大学食品科学技术学院,湖北武汉 430000)
(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
随着我国健康战略的实施,人们对健康的需求日益强烈。传统糖果已无法满足人们对健康的需求,功能性糖果将是糖果发展的一个重要方向,将水果和益生菌应用到糖果中,可提高糖果的功能。大量研究表明,益生菌是一类对人体健康有益的微生物,具有维持肠道屏障完整性,改善因肠道微生物失衡引起的胃肠道功能紊乱、炎症、免疫力下降以及老年痴呆等[1,2]。目前,益生菌市场发展迅速,各类益生菌产品琳琅满目,层出不穷。但现有益生菌产品主要以冻干粉以及酸奶等发酵制品为主。糖果在加工过程中温度高,常用的干酪乳杆菌、双歧杆菌、植物乳杆菌、嗜热链球菌等乳酸菌无法存活。凝结芽孢杆菌(Bacillus coagulans)既能像乳酸菌和双歧杆菌一样,具有促消化、促排便、调节肠道菌群平衡、免疫调节等作用,又具有芽孢菌的抗逆性强、耐高温高压、较好的胃肠道耐受能力和易贮藏等优点[3-6]。2016 年,凝结芽孢杆菌被我国列入《可用于食品的菌种名单》,受到研究者和生产商的关注。
佛手富含多酚、多糖和黄酮类化合物等功效成分[7],众多研究表明佛手及其化合物具有抗寄生虫[8]、抗癌[9]、抗消化不良[10]、抗炎[11,12]、抗氧化[13,14]和预防脂肪肝等作用,在我国传统中草药中加入佛手干果作为佐剂,可用于治疗各种慢性疾病,如呼吸道感染、哮喘和高血压[15]。将佛手、益生菌和糖果相结合,可以兼具糖果的美味以及佛手和益生菌的功能。
本文通过单因素和响应面优化确定软糖的工艺参数,并探究软糖中凝结芽孢杆菌在胃肠道环境下的耐受能力,可为佛手益生菌软糖的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
佛手,购买于广东省广州市。
凝结芽孢杆菌菌粉(Bacillus coagulans),萨宾莎(南京)生物科技有限公司。
LB 肉汤培养基、LB 琼脂培养基,广东环凯微生物科技有限公司;胃白酶(酶活力3200 U/mg)、猪胰蛋白酶(酶活力4~6 U/mg)、猪胆盐,上海源叶生物科技有限公司;明胶,永信食品配料有限公司。
1.2 仪器与设备
立式蒸汽灭菌锅,上海博讯实业有限公司;HWS-26 型电热恒温水浴锅,上海一恒科学仪器公司;PB-10 pH 计,德国Sartorius 公司;超净工作台,苏净集团苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 佛手益生菌软糖的制备
软糖制作工艺流程图见图1。冷冻佛手室温下解冻,置于破壁料理机中,加入2 倍质量的纯水打浆,于高压灭菌锅中100 ℃灭菌4 min 备用;明胶用1 倍质量的纯水溶胀1~2 h,70 ℃水浴溶解,备用。将果葡糖浆与蔗糖1:1 混合,加热完全融化,加入明胶溶液,搅拌均匀,调节温度,加入佛手浆和凝结芽孢杆菌菌粉,搅拌,在超净工作台上趁热注入软糖模具内,放置3~4 h 后得到软糖样品。
1.3.2 单因素实验
按原料总质量为100%计,以明胶50%,混合糖浆30%,凝结芽孢杆菌菌粉为总质量的0.2%,选取佛手浆添加量、调和时间、调和温度三个因素进行单因素实验。
1.3.2.1 佛手浆添加量
在调和温度为70 ℃,调和时间为6 min 的条件下,探究不同佛手浆添加量(10%、12.5%、15%、17.5%、20%)对软糖活菌数、质构和感官评定的影响。
1.3.2.2 调和温度
在调和时间为6 min,佛手浆添加量为15%的条件下,探究不同调和温度(60、70、80、90 ℃)对软糖活菌数、质构和感官评定的影响。
1.3.2.3 调和时间
在调和温度为70 ℃、佛手浆添加量为15%的条件下,探究不同调和时间(2、4、6、8、10 min)对软糖活菌数、质构和感官评定的影响。
1.3.3 响应面优化
在单因素的基础上,分别以软糖的凝结芽孢杆菌数,硬度、弹性、咀嚼性和胶着性,感官评定为指标,选取佛手浆添加量(12.5%)、调和温度(70 ℃)、调和时间(4 min)进行响应面设计,见表1。

表1 响应面试验设计Table 1 Response surface test design
1.3.4 凝结芽孢杆菌菌落数的测定
活菌总数测定:采用倾注法,将样品用0.9%生理盐水逐级稀释到10-5、10-6,分别取1 mL 稀释液于平板上,倾注培养基,凝固后置于37 ℃恒温培养48 h后观察计数[16],活菌数以log CFU/g 表示。
1.3.5 质构分析
将软糖用于TPA 质构分析,测定软糖的硬度、弹性、胶着性和咀嚼性四个质构参数。测试条件如下:采用P10 圆柱型探头,参考,样品高度为1 cm,测前速率为1 mm/s,测试及测后速率均为0.5 mm/s,压缩形变率为50%,测试重复次数为2 次。每组样品3 个平行,取平均值,保留2 位小数[17]。
1.3.6 感官评价
筛选10 名食品专业人员作为感官评价员,组成评定小组,按照GB/T 16860-1997 的方法进行感官评价。
1.3.7 模拟体外消化体系
模拟胃肠消化试验参考Zhuang 等[18]和Jiao 等[19]的方法。
1.3.7.1 模拟胃液消化试验
配置PBS 缓冲液(pH 6.8),装瓶到锥形中用稀盐酸分别调节pH 到1.0、1.5、2.0、2.5、3.0、3.5。121 ℃灭菌21 min 后,加入10 g/L 的胃蛋白酶,溶解后用0.22 μm 微孔滤膜过滤除菌。将软糖与生理盐水1:1 用捣碎机捣碎成浆后,以10%(g/g)的添加量添加至人工胃液中,置于37 ℃ 100 r/min,恒温摇床进行消化,于0、1、2、3 h 后取样检测凝结芽孢杆菌活菌数。
1.3.7.2 模拟肠液消化试验
制备PBS 缓冲溶液,用NaOH 调节pH 至7.5。121 ℃高压灭菌15 min 后添加10.0 g/L 胰蛋白酶,充分溶解,用无菌0.22 μm 微孔滤膜过滤除菌。将软糖浆以10%(g/g)的添加量加至人工肠液中,放置37 ℃、100 r/min,恒温摇床进行消化,于0、1、2、3、4 h后取样检测凝结芽孢杆菌活菌数。
1.3.7.3 模拟胆盐消化试验
取LB 肉汤培养基,分别以0、1、2、3、4 g/L 添加至LB 肉汤培养基中,121 ℃灭菌。将软糖浆以10%(g/g)的添加量加至模拟胆液中,放置37 ℃、100 r/min,恒温摇床进行消化,于0、24 h 后取样检测凝结芽孢杆菌活菌数。
1.3.7.4 模拟胃肠道体系试验
配置pH 为3.0 的人工胃液,配置加有3 g/L 胆盐的人工肠液,用无菌0.22 μm 微孔滤膜过滤除菌。将软糖浆以10%(g/g)的添加量添加至人工胃液中,放置37 ℃、100 r/min 恒温摇床消化2 h。然后,从上述已消化2 h 的人工含菌胃液取1 mL,加入到已加如、入3 g/L 胆盐的人工肠液中,在37 ℃、100 r/min 的恒温摇床中继续培养。在第0、2、4、6、8、10 h 时间点进行取样,检测凝结芽孢杆菌菌数。
1.4 数据处理
使用Origin 2017、Design 11 软件对数据进行统计分析,并采用SPSS 17.0 软件的ANOVA 方法对结果进行单因素方差分析,p<0.05 表示样品间具有显著性差异。
2 结果与分析
2.1 单因素实验结果
2.1.1 佛手浆添加量对软糖质构和感官品质的影响
佛手浆添加量对感官品质的影响见图2a,当添加量为10%时,佛手香味较淡,且带有明胶的腥味;佛手浆添加量为15%及以上时,软糖呈现出佛手的苦味;当佛手浆添加量为12.5%时,软糖香甜可口,佛手香味浓郁,感官品质最佳;由图2b 可知,软糖的活菌数随着佛手浆添加量的增加而增加,可能是佛手浆中的果胶、多糖等些物质对凝结芽孢杆菌有一定的保护作用;由图2c 和2d 可知,佛手浆含量对软糖质构的影响,软糖的硬度、咀嚼性、胶着性随着佛手浆添加量的增大而增大,而其弹性随着佛手浆含量的增加而降低。
2.1.2 调和温度对软糖质构和感官品质的影响
由图3 可知,调和温度为70 ℃时软糖的口感最佳。凝结芽孢杆菌数随着调和温度的增加而逐渐减少,温度过高不仅会影响益生菌的存活率,还会破坏明胶的三维网状结构,导致软糖的硬度、弹性、咀嚼性降低,影响软糖的感官评价。
2.1.3 调和时间对软糖质构和感官品质的影响
由图4 可以看出,调和4 min 时,软糖感官品质最好;活菌数则随着调和时间的延长,存活率逐渐下降;同时调和时间的延长也会对明胶网状结构造成一定的破坏,导致软糖的硬度、弹性、咀嚼性降低,影响软糖的品质。
2.2 响应面实验结果与分析
2.2.1 响应面试验结果
根据单因素试验结果,选择佛手浆添加量(A)、调和温度(B)、调和时间(C)为因变量,感官评分(Y)为响应值,设计三因素三水平的响应面试验,得到的响应面试验结果见表3。
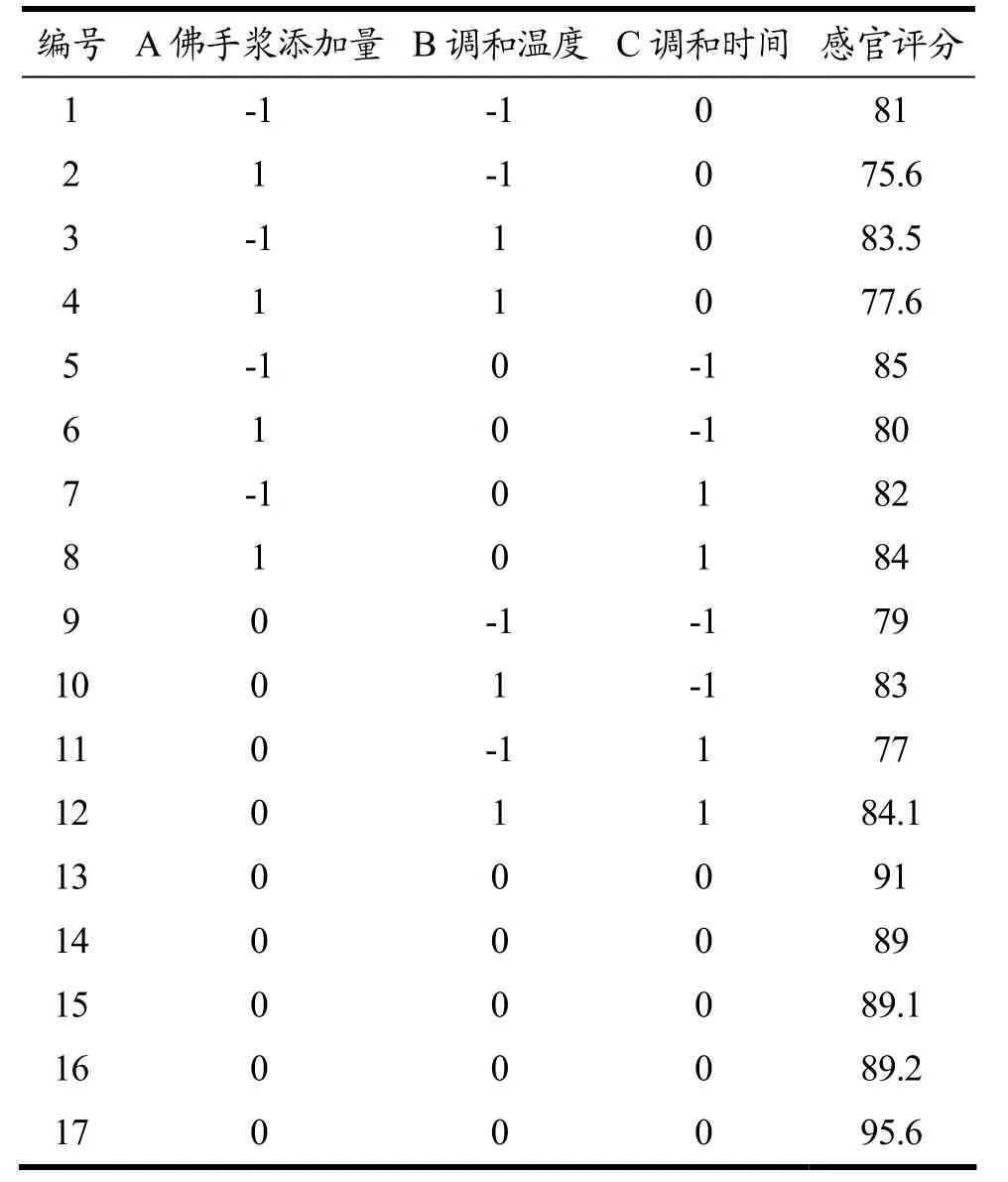
表3 响应面试验设计及结果Table 3 Response surface test design and results
对模型显著性分析见表4。回归方差分析显著性检验表明,该回归模型F=7.26,p<0.05,显示模型显著回归,同时,该回归模型的总决定系数R2=0.9032,可以看出该模型的拟合程度较为准确。可以利用该模型对软糖的感官评分进行分析和优化。
由表4 可知,佛手浆添加量、调和温度、调和时间对感官品质的都有极显著的影响。同时,除AB 项之外的各个因素的交互作用对感官评分都有非常显著的影响。失拟项p=0.3152>0.05 模型不显著,表示模型成立,模型预测值与实际值拟合程度高。A、B、C三因素的交互作用对感官评分的影响是显著的,对软糖感官评价的影响为佛手浆添加量>调和温度>调和时间,即A>B>C,与方差分析结果相同。通过回归方程并结合3D 曲面图分析得到益生菌软糖的最佳工艺条件为佛手浆添加量12%、调和温度70 ℃、调和时间4 min,该工艺条件下佛手益生菌软糖的活菌数为7.6 log CFU/g,感官评分为89.9。
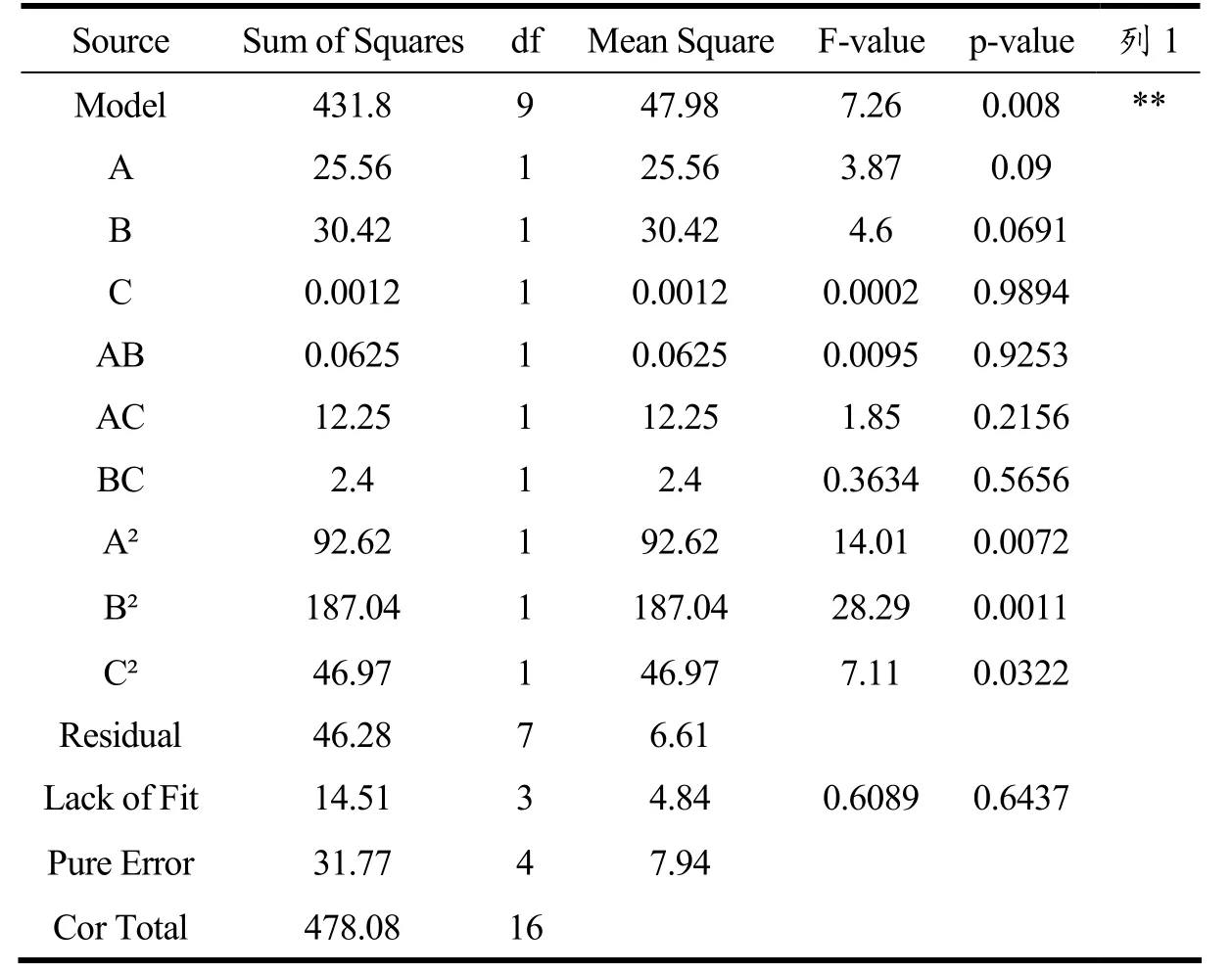
表4 方差分析结果Table 4 Results of variance analysis
2.2.2 益生菌软糖中凝结芽孢杆菌的体外消化耐受能力分析
在通过胃肠道的过程中存活率是益生菌能够使宿主受益的重要标准[20],因此肠道益生菌须有较高的胃肠耐受能力,如在较低pH 的胃液、较高浓度的胆盐液及较长时间的肠液中能否有较好的存活率,是判断该益生菌能否成为肠道优势菌的重要标准[21]。
凝结芽孢杆菌在不同pH 值胃液中的存活率对益生菌软糖能否产生益生效果具有重要意义。食物摄入后,在人体胃液中停留时间为1~3 h[22],且pH 值会上升,人空腹时的胃液pH 值可达1.0[23],因此,选取胃液pH 1.0~3.5,消化时间为3 h 的条件进行试验。由图5a 可知,软糖中凝结芽孢杆菌的存活率与胃液pH 呈正相关,软糖中的凝结芽孢杆菌在不同pH 值的胃液环境中的存活率不相同,其中在pH 1.0 消化3 h 后,菌群数由7.28 log CFU/g 下降到3.86 log CFU/g,但是在pH 1.5~3.5 的环境中,消化3 h 后,凝结芽孢杆菌菌群数仍较高,均达6.01 log CFU/g 以上。关小莺等[24]对干酪乳杆菌发酵荔枝汁在pH 1.5的胃液进行模拟消化2 h 后,存活率不到50%,于金慧等[25]对鲍芹根际乳酸菌进行胃酸耐受性研究,发现其在pH 1.5 不能存活。以上结果表明,凝结芽孢杆菌相比于乳酸菌和其他肠道益生菌,具有更好的胃酸和胃蛋白酶耐受能力。
佛手益生菌软糖在肠液中消化4 h 后,凝结芽孢杆菌的菌群数仅下降0.27 log CFU/g,鞠葛金悦等[26]发现植物乳杆菌和发酵乳杆菌肠液消化4 h 后菌群数分别下降1.05 log CFU/g 和1.06 log CFU/g,表明与植物乳杆菌和发酵乳杆菌相比,凝结芽孢杆菌具有较高的肠道耐受能力。
凝结芽孢杆菌在不同胆盐浓度培养基培养24 h后,测得存活率见图5c,其活菌数与胆盐浓度呈负相关,胆盐浓度越高,活菌数越低,凝结芽孢杆菌在4 g/L浓度的胆盐条件下菌群数仅下降1.13 log CFU/g,表明凝结芽孢杆菌具有较好的胆盐耐受能力。金迅等[27]和王金果等[28]对凝结芽孢杆菌进行体外消化,凝结芽孢杆菌在0.3%胆盐液中的均达80%以上,与本文研究结果一致。郭芸等[29]发现当胆盐浓度达到0.25%时,所有乳酸菌菌株均不能生长。
消化一小时后小肠中的胆盐浓度约为0.3%[20],因此胃肠消化试验中取3 g/L 的浓度、胃液pH 3.0 进行试验。凝结芽孢杆菌在胃肠消化体系中消化12 h 后仍有较高的菌群数,从7.34 log CFU/g 仅下降到7.06 log CFU/g,凝结芽孢杆菌数在从胃液体系转移至肠液体系中,有显著性降低,在肠液中的存活率与消化时间没有明显变化,消化10 h 后,仍可较好的适应胃肠道环境,表明凝结芽孢杆菌有较好的胃肠道耐受能力。
3 结论
本实验以佛手益生菌软糖为研究对象,采用单因素结合响应面优化,探究佛手浆添加量、调和温度、调和时间等因素对软糖感官、质构和活菌数的影响,确定软糖的工艺条件为:佛手浆添加量12%、调和温度70 ℃、调和时间4 min,此时软糖活菌数7.6 log CFU/g,具有佛手的清香,感官评价最好。同时,探究了软糖中凝结芽孢杆菌的胃肠道耐受能力,发现其对pH 1.5 以上的人工胃液,肠液及胆盐具有较好的耐受性。以上研究可为佛手益生菌软糖的开发提供理论依据。
