粉葛与葛根多糖对脂多糖诱导RAW264.7 细胞的抗炎作用
2022-07-29张壮李琼黄丽萍崔玉顺刘荣华冯育林欧阳辉朱卫丰杨世林
张壮,李琼,黄丽萍,崔玉顺,刘荣华,冯育林*,欧阳辉*,朱卫丰,杨世林
(1.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西南昌 330006)
(2.江西中医药大学药学院,江西南昌 330004)
(3.江西中医药大学现代中药制剂教育部重点实验室,江西南昌 330004)
葛根属豆科,学名Pueraria lobata(Willd.)Ohwi,入药常用其干燥根,有丰富的食用以及药用价值,为我国传统的药食两用植物[1]。国内现有葛根品种多样化,葛根的正品为1977~2000 版《中国药典》记录的Pueraria lobata(Willd.)Ohwi 和甘葛藤P.thomsonii Benth.的干燥块根。随着近年来药理研究的不断发展,粉葛被单独列为一个品种,野葛为正品葛根。有研究表明,葛根具有抗糖尿病[2]、降血压[3]、抗氧化[4]、抗骨质疏松[5]和调节免疫系统的作用[6]。
对葛根生物活性的深入探索表明,葛根多糖具有抗氧化、免疫调节、降血糖的作用[7,8]。宋淑珍等[9]对不同纯度葛根多糖进行了生物活性比较,结果表明不同提取过程会影响葛根多糖的抗氧化能力及其生物活性。蔡春沉等[10]对葛根多糖对2 型糖尿病大鼠的治疗作用及机制进行了研究,发现葛根多糖可以有效改善2 型糖尿病大鼠的相关生化指标,具有降血糖和降血脂作用,具有一定的抗氧化能力。杨长友[11]采用平板打洞法研究了葛根多糖的抑菌活性,结果表明葛根多糖对供试菌种有明显的抑制作用,其中对枯草芽孢杆菌抑制作用最强。崔恒祥等[12]使用阴离子交换和凝胶渗透色谱法从野葛根水提取物中分离出一种水溶性葡聚糖并分析其化学结构,证明该多糖能显著抑制过氧化氢所致的PC12 细胞损伤。Kim 等[13]发现葛根多糖通过TLR4 膜受体传导信号诱导小鼠脊髓中树突细胞(DC 细胞)成熟。
巨噬细胞是参与炎症反应启动的重要炎症细胞,通过分泌大量促炎介质和促炎细胞因子,在众多炎症疾病的发病过程中发挥关键作用。巨噬细胞表面的模式识别受体可以识别并与多糖结合,经各种信号传导通路将信号传入细胞内,使细胞内产生一系列的信号级联反应,从而调控免疫相关基因的表达。植物多糖对巨噬细胞的免疫调节作用主要通过改变其形态、吞噬活性、细胞因子表达量等来实现。现代免疫学认为,天然活性物质具有代替抗生素来提高机体免疫应答的潜能。脂多糖在诱导炎症反应和导致各种炎症疾病中发挥着重要作用,是革兰氏阴性菌细胞壁的化合物[14]。本文从对粉葛、葛根粗多糖以及粉葛均一多糖研究较少的抗炎活性入手,以小鼠RAW264.7 巨噬细胞为研究对象,以探究其抗炎活性的不同及其可能的机制。首先测定了三种不同多糖对RAW264.7 细胞的毒性,后面通过脂多糖(LPS)诱导炎症,在三种不同多糖作用后检测炎症因子NO、IL-6 和TNF-α释放的变化,根据其活性的不同最后对葛根粗多糖发挥抗炎作用的机制进行了探究,为葛根在药用开发领域奠定理论基础。
1 材料与方法
1.1 原料
1.1.1 细胞、药物与试剂
RAW264.7 细胞,ATCC 细胞库;粉葛粗多糖(FGC)、葛根粗多糖(GGC)、粉葛均一多糖(FGJ),江西中医药大学课题组自制;胎牛血清,Gibco 公司;DMEM、PBS,北京索莱宝科技有限公司;脂多糖,美国Sigma 公司;BCA 蛋白定量试剂盒,上海雅酶生物医药科技有限公司;ELISA 试剂盒,北京四正柏生物科技有限公司;iNOS、COX-2,Proteintech 公司、p-p65、p65、IκBα、p-IκBα、β-actin 抗体,美国CST公司;逆转录试剂盒、Syber Green,翌圣生物科技股份有限公司;AnnexinV-FITC/PI 细胞凋亡检测试剂盒,大连美仑生物技术有限公司。
1.1.2 主要仪器设备
SW-CJ-1FD 超净工作台,苏州安泰空气技术有限公司;JW-3401CO2 培养箱,江西省立康科技有限公司;TS2 显微镜,Nikon 公司;HH-2 数显恒温水浴锅,上海力辰邦西仪器科技有限公司;HC-3018R 低温高速离心机,安徽中科中佳科学仪器有限公司;TD5Z 离心机,北京市华瑞科学器材有限公司;HX-20G2 恒温金属浴,上海沪析实业有限公司;Bio-Rad 蛋白电泳仪和转膜仪、Bio-Rad 高灵敏度化学发光成像仪,伯乐生命医学产品有限公司;Prism 7500 荧光定量PCR 仪,美国ABI公司;NanoDrop 微量分光光度计,Thermo Fisher 科技公司;InfiniteM200PRO 酶标仪,瑞士TECAN 公司;Gallios 流式细胞仪,美国Beckman 公司。
1.2 试验方法
1.2.1 粗多糖的制备
称取30.0 g 粉葛(或葛根)于1000 mL 三颈瓶中,加入600 mL 纯净水,在恒温电热套中进行回流提取,温度升至100 ℃开始计时,提取时间为120 min,120 min 后倒出提取液,加入600 mL 纯净水,进行第二次的提取,将两次提取液合并,用旋转蒸发仪加压浓缩至挂壁,冷却至室温加入1:2 体积比的95%乙醇进行醇沉,静置过夜,过滤后将沉淀用纯净水复溶,离心后上清液进行干燥,记录粗多糖质量,粉葛粗多糖含量经苯酚-硫酸法测定为76.35%,野葛粗多糖含量经苯酚-硫酸法测定为70.97%。
1.2.2 粉葛均一多糖的制备称取适量粉葛粗多糖用蒸馏水充分溶解后,用HP-20 大孔树脂柱进行脱色除蛋白,吸附12 h 后,用蒸馏水洗脱至多糖全部流出(苯酚-硫酸法监测),冷冻干燥即得脱色和除蛋白后的粗多糖。称取纯化后的粉葛粗多糖3 g,加适量蒸馏水使其充分溶解,离心取上清后上样到葡聚糖凝胶G-200 中,用超纯水洗脱至没有颜色,取中间段进行含量测定,得到含量为94.64%。
1.2.3 细胞培养
在37 ℃、5% CO2的培养箱中培养RAW264.7 细胞。细胞密度达到80%时,传代细胞。之后取处于对数生长期的细胞用于后续实验。
1.2.4 FGC、GGC 以及FGJ 的细胞毒性检测
收集细胞沉淀,稀释细胞使密度为 1×105cells/mL,各取100 μL 细胞悬液加入96 孔板中过夜使其完全贴壁。分为对照组、加药组。加药组分别加入FGC、GGC 以及FGJ(10、20、40 μg/mL)预处理24 h,每组重复6 孔。弃上清,每孔加100 μL 10% CCK8,37 ℃孵育2 h,酶标仪在450 nm 处检测其OD 值。求得细胞存活率。
存活率/%=(OD给药-OD空白)/(OD对照-OD空白)
1.2.5 FGC、GGC 以及FGJ 对NO 释放的影响
收集细胞沉淀,稀释细胞使密度为 4.0×105cells/mL,各取500 μL 细胞悬液加入24 孔板中过夜使其完全贴壁。分为对照组、模型组、加药组。加药组分别加入FGC、GGC 以及FGJ(10、20、40 μg/mL)预给药4 h,加入LPS(1 μg/mL)孵育24 h。最后,每组各吸取50 μL 上清转移至96 孔板中,然后每孔加入50 μL 的Griess 试剂A 和B,酶标仪于540 nm 处检测其OD 值。
1.2.6 FGC、GGC 以及FGJ 对TNF-α、IL-6炎症因子释放的影响
将1.2.3 中各组细胞剩余上清液稀释2 倍,通过ELISA 试剂盒检测FGC、GGC 以及FGJ 对TNF-α、IL-6 产生量的影响。
1.2.7 GGC 对iNOS/COX-2 蛋白表达的影响
收集细胞沉淀,稀释细胞使密度为 4.0×105cells/mL,各取2 mL 细胞悬液加入6 孔板中过夜使其完全贴壁。分为对照组、模型组、加药组。加药组加入GGC(10、20、40 μg/mL)预给药4 h,然后加入LPS(1 μg/mL)孵育24 h,吸净上清,裂解细胞后分离得到总蛋白,用BCA 试剂盒测定各组蛋白浓度,通过标准曲线计算蛋白上样量用于后续实验。通过Western blotting 法对iNOS、COX-2、β-actin 进行检测。
1.2.8 GGC 对核转录因子-κB(NF-κB)通路的影响
按1.2.5 方法接种细胞。加药组加入GGC(10、20、40 μg/mL)预给药4 h,然后加入LPS(1 μg/mL)孵育2 h,吸净上清,裂解细胞后分离得到总蛋白,用BCA 试剂盒测定各组蛋白浓度,通过标准曲线计算蛋白上样量用于后续实验。通过Western blotting 法对p65、p-p65、IκBα、p-IκBα、β-actin 进行检测。
1.2.9 GGC 对IL-6、TNF-α的mRNA 表达的影响
按1.2.5 方法接种细胞。加药组加入GGC(10、20、40 μg/mL)预给药4 h,然后加入LPS(1 μg/mL)孵育24 h,吸净上清,裂解细胞后用Trizol 提取得到RNA,紫外分光检测RNA 浓度用于后续实验。按反转录试剂盒说明得到cDNA。最后扩增cDNA。引物序列如表1 所示。
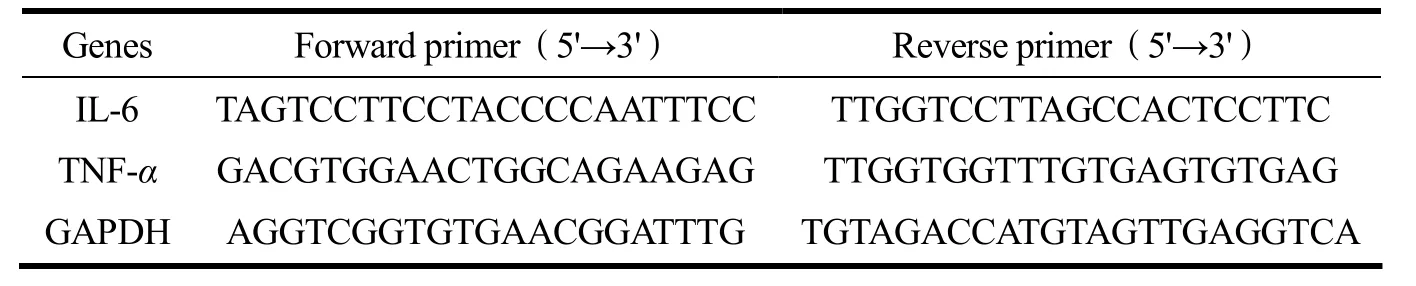
表1 引物序列表Table 1 Sequences of primers
1.2.10 GGC 对ROS 产生的影响
收集细胞沉淀,稀释细胞使密度为3×105cells/mL,各取2 mL 细胞悬液加入6 孔板中过夜使其完全贴壁。分为对照组、模型组、加药组。加药组加入GGC(10、20、400 μg/mL)预给药4 h,加LPS(1 μg/mL)孵育24 h。24 h 后,用探针DCFH2-DA(1 μg/mL)孵育40 min。吸净上清,各孔用冷的PBS 清洗2 遍,各孔加入100 μL胰蛋白酶消化2 min,之后用500 μL 完全培养基停止消化,收集细胞,通过流式细胞仪检测ROS 含量。
1.2.11 GGC 对Nrf2、HO-1 蛋白表达的影响
按1.2.5 方法接种细胞。加药组加入GGC(10、20、40 μg/mL)预处理4 h,然后加入LPS(1 μg/mL)孵育24 h,吸净上清,裂解细胞后分离得到总蛋白,用BCA 试剂盒测定各组蛋白浓度,通过标准曲线计算蛋白上样量用于后续实验。通过Western blotting 法对Nrf2、HO-1 进行检测。
1.3 统计学分析
数据通过GraphPad Prism 8.0 进行统计学分析,组间比较通过单因素方差分析的方法进行,p<0.05 认为有显著性差异,p>0.05 则无显著性差异。
2 结果与讨论
2.1 FGC、GGC 以及FGJ 对RAW264.7 细胞活性的影响
使用CCK8 试剂盒检测FGC、GGC 以及FGJ 对细胞活力的作用效果,各组分别加入浓度为10、20、40 μg/mL 的FGC、GGC 以及FGJ 作用24 h(图1),检测该浓度范围内的细胞存活率,结果显示各组细胞的存活率均与对照组基本一致,对细胞没有明显的毒性作用,且表现出一定的促增殖作用。各组之间没有显著性差异(p>0.05)。说明该浓度范围内不会大幅度改变细胞的增殖,也说明后续实验不会因细胞增殖受到影响。
2.2 FGC、GGC 以及FGJ 对LPS 诱导的RAW264.7 释放NO 的影响
NO 是多种生物功能的重要中介物[15],在炎症细胞模型中,可以通过NO 释放量减少来判断炎症反应是否得到改善[16]。由图2 可知,模型组NO 产生量与对照组相比均有大幅的提升(p<0.0001),已成功诱导炎症模型;在FGC 实验组内,在浓度为40 μg/mL 时与模型组相比出现显著性差异(p<0.05),其余两组无显著性差异(p>0.05)。在FGJ 实验组内,随着多糖含量的增加,各浓度下NO 的释放量均显著降低,但当FGJ 浓度升高时,NO 的释放量呈上升趋势,无浓度依赖性。只有在GGC 实验组内,随着浓度的增加,各浓度下NO 的释放量与模型组相比均显著减少,抑制率分别为15.55%、26.45%、38.46%,说明GGC 具有明显的降低NO 分泌的作用。
2.3 FGC、GGC 以及FGJ 对LPS 诱导的RAW264.7 细胞TNF-α、IL-6 炎症因子释放的影响
IL-6 作为一种重要的炎症介质,可以通过其促炎作用诱发各种炎症反应[17,18]。从图3 中可知,模型组与对照组的 IL-6 产生量相比存在显著性差异(p<0.0001),已成功构建炎症模型;在FGC、FGJ实验组内,加药组IL-6 的分泌量与模型组相比均无显著性差异(p>0.05),表明对IL-6 的分泌无抑制效果。而在GGC 实验组内,随着多糖浓度的增加,各浓度下IL-6 的释放量均显著减少,抑制率分别为23.78%、39.00%、55.87%,说明GGC 具有明显的降低IL-6 分泌的作用。
在与炎症相关的多种疾病中,TNF-α水平过高能引发巨噬细胞浸润、释放多种炎症因子、引起氧化应激[19]。从图4 中可以看出,各实验组内LPS 诱导RAW264.7 细胞分泌TNF-α的结果与诱导分泌IL-6 的结果一致,均只在GGC 实验组内,随着多糖浓度的增加,各浓度下NO 的释放量与模型组相比均显著减少,抑制率分别为28.44%、46.69%、52.90%,说明GGC 具有明显的降低TNF-α分泌的作用。
本文中所用粉葛与葛根粗多糖针对其特征本课题组已发表一项专利[20],证明多糖的质量百分含量在70%以上,小分子化合物的质量百分含量为0.0005%~2.0%,剩余为淀粉、水分、灰分等物质。且本研究已表明粉葛粗多糖无抗炎活性,因此认为葛根粗多糖中作为主要成分的多糖在发挥抗炎作用,其发挥作用的机制将继续深入研究。
2.4 GGC 对LPS 诱导的RAW264.7 细胞iNOS、COX-2 蛋白表达的影响
iNOS 在受到炎症刺激时,会产生过量的NO 与超氧阴离子,超氧阴离子与NO 反应会产生有害的氧化剂损伤机体,导致各种炎症发生[21]。COX 有COX-1、COX-2、COX-3 共3 种,其中COX-2 为诱导酶,是可以催化炎症介质的关键酶[22]。从图5 中可知,在LPS作用后,显著提高了iNOS、COX-2 蛋白的表达量,已成功诱导炎症模型。与模型组比较,不同浓度GGC抑制iNOS、COX-2 的表达,对COX-2 蛋白的抑制率分别为43.50%、77.46%、95.05%,对iNOS 蛋白的抑制率分别为44.37%、28.68%、29.28%,与2.2 的研究结果基本一致。说明GGC 能够降低iNOS、COX-2蛋白的表达。
2.5 GGC 对LPS 诱导的RAW264.7 细胞中NF-κB 信号通路的影响
转录因子NF-κB 是调节参与不同炎症反应过程的多种基因的关键因子之一,它通过一系列炎症细胞因子和趋化因子的mRNA 表达控制最终免疫反应[23],从图6 中知,LPS 作用后,显著提高p-p65、p-IκBα蛋白的表达量,不同浓度的GGC 对p-p65 蛋白的抑制率分别为31.22%、62.67%、27.18%,对p-IκBα蛋白的抑制率分别为11.98%、16.37%、28.45%。说明GGC能降低NF-κB 信号通路磷酸化蛋白的水平,而且能够抑制IκBα的降解,证明GGC 是通过作用于NF-κB 信号通路来发挥抗炎的作用。
2.6 GGC 对LPS 诱导的RAW264.7 细胞中IL-6、TNF-α的mRNA 表达的影响
如图7 所示,与模型组相比,细胞中TNF-α、IL-6 mRNA 的表达呈降低趋势(p<0.01),各浓度下NO 的释放量与模型组相比均显著减少,IL-6 抑制率分别为39.37%、52.60%、57.70%,TNF-α抑制率分别为72.94%、73.65%、81.68%。与2.3 的研究结果一致,说明GGC 具有明显的降低IL-6、TNF-α的mRNA 表达的作用。
2.7 GGC 对LPS 诱导的RAW264.7细胞Nrf2、HO-1 蛋白表达的影响
HO-1 是Nrf2 下游基因,氧化应激状态下Nrf2 被激活进入核后将启动HO-1 转录表达而催化降解血红素、一氧化碳等,抑制氧化应激损伤[24]。Keap1-Nrf2 -ARE可以分为两部分,一部分在细胞质,一部分在细胞核。通常情况下Keap1 与Nrf2 在细胞质中结合,这时是处于未激活状态,如果一直未激活,Nrf2 会被降解;如果受到某种刺激,Keap1-Nrf2 的结合就不稳定,Nrf2 被释放出来,被转移到细胞核,并与ARE 结合,激活下游基因的转录,进而翻译出一系列相关蛋白,发挥生理功能。氧化应激是炎症反应的一个组成部分,体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,这些中间产物如白三烯(LT)、血栓素A2(TXA2)等都是促炎介质。从图8 中可知,1 μg/mL 的LPS 作用后,Nrf2、HO-1 蛋白表达量减少,已构建炎症模型。与模型组比较,GGC 促进Nrf2、HO-1 蛋白的表达,说明GGC 通过Nrf2/HO-1 通路发挥抗炎作用。
2.8 GGC 对LPS 诱导的RAW264.7 细胞释放ROS 的影响
Nrf2 是一种转录因子,能协调大量细胞保护基因的基础和应激诱导激活,它可以调节下游的抗氧化还原酶等蛋白的活性来调节机体内ROS 的失衡,防止ROS 在机体内累积,抑制机体氧化应激[25]。从图9 中可知,通过流式细胞分析,对照组ROS 的释放量低,用1 μg/mL 的LPS 作用后,ROS 释放量显著提高,已构建炎症模型。GGC 均可抑制ROS 的增加,抑制率分别为37.29%、41.05%、54.09%,说明GGC 能够减少细胞内ROS 的产生,与2.7 的研究结果基本一致,说明GGC 有明显的抗炎作用。
多糖的抗炎作用作为其多种药理活性之一,众多学者已经通过体外和体内实验对多糖的抗炎效果进行了评价。体外炎症主要采用LPS 诱导的RAW264.7 细胞建立模型,动物实验大部分集中于溃疡性结肠炎模型。研究表明,多糖可以从抗氧化应激、调节细胞因子分泌、调控中性粒细胞、改善肠道菌群和肠黏膜屏障等方面发挥抗炎作用。
正北芪多糖[26]可显著提高UC 小鼠结肠组织的抗氧化能力,升高模型小鼠体内SOD 活力,降低NOS、MDA 和NO 水平,缓解UC 的炎症;枸杞多糖[27]可显著降低细胞上清液中TNF-α、IL-1β和IL-6 的含量;黄芪多糖[28]可通过改善巨噬细胞形态,恢复巨噬细胞增殖能力,从而改善肠黏膜的损伤及抑制肠道炎症反应;木枣多糖[29]通过增加小鼠粪便中SCFAs 的浓度以及双歧杆菌、拟杆菌、乳酸杆菌等益生菌菌群的数量来发挥抗炎抑菌的作用。
本文通过研究葛根多糖下调NF-κB 中相关蛋白的磷酸化水平与上调Nrf2/HO-1 蛋白的表达量,调控炎症因子基因转录,降低促炎因子分泌以及降低蛋白iNOS 和COX-2 的表达量从而发挥治疗炎症的作用,与之前的研究结果相互印证。但是,多糖的抗炎机制往往是通过多途径、多靶点等方式来实现,与机体免疫调节和肠道菌群方面密不可分。因此,进一步研究揭示葛根多糖在治疗溃疡性结肠炎结肠炎及调节肠道菌群方面的作用机制具有十分重要的意义。
3 结论
3.1 本研究以LPS所诱导的RAW264.7炎症细胞模型来研究粉葛粗多糖(FGC)、葛根粗多糖(GGC)以及粉葛均一多糖(FGJ)对细胞炎症反应的作用。由结果可知,FGC、FGJ不能抑制模型组中NO及TNF-α、IL-6 的产生,而GGC 具有与之相反的效果,在浓度为10~40 μg/mL 的浓度范围内,可以有效的抑制炎症的发生。从作用机制来看,GGC 能够有效的抑制iNOS和COX-2 的表达,且能降低NF-кB 磷酸化蛋白的表达水平,提高Nrf2、HO-1 蛋白的表达水平,降低ROS的产生,并对TNF-α、IL-6 的mRNA 表达有抑制作用。
3.2 本文在前期完成了对粉葛均一多糖与粉葛粗多糖的抗炎活性研究,发现纯化后的多糖并未表现出更好的抗炎活性,因此首先对葛根粗多糖的活性进行研究,证明其有抗炎活性后下一步将对其进行纯化并研究其活性及作用机制。
