基于高通量测序探究东北粳稻储藏期间真菌群落的演替
2022-07-29李欣蔚
李欣蔚
(辽宁省农科院粮食科学研究所,辽宁沈阳 110032)
水稻是我国主要粮食作物。在我国每年都会有大量的稻谷进入仓库储藏[1]。稻谷一般储备轮换年限是3年[2]。在储藏阶段,当储藏条件(环境温度、环境湿度)达到适合真菌生长的条件时,真菌便会利用稻谷中的碳源大量生长繁殖,而真菌的不断繁殖又会使得环境温度升高,真菌产生的真菌毒素[3],食用后威胁人类健康[4]。稻谷在储藏过程中脂肪酸值的变化最为敏感,因此可以通过测定脂肪酸值来判断稻谷的脂质陈化程度[5]。
传统的平板分离法需要对样品进行微生物的分离、纯化、接种再培养分析,其中可培养的微生物只占总微生物的不到10%。因此对于稻谷中的真菌群落结构及多样性的探究,传统的平板分离法不能够实现[6,7]。而以样品中提取的全部微生物DNA 为研究对象的高通量测序技术可以提供更加可靠的技术支持[8]。高通量测序技术采用大量构建宏基因文库,利用分子生物学信息比对手段,研究样品中宏基因组中所包含的全部微生物信息,如微生物的遗传组成以及微生物的菌群结构、群落功能等,因此可以全面反映微生物群落组成情况及多样性。目前已广泛应用于海洋[9,10]、肠道[11,12]、土壤[13,14]、粮食作物[15]、食品饮料[16,17],甚至动物表皮[18]等不同生态类型的微生物群落结构剖析,在农业、食品、医疗等领域发挥着重要作用[19]。
稻谷脂质的陈化和霉菌的生长是造成储藏稻谷品质劣变的重要因素,往往发生在新收获稻谷储藏前期[20]。因此,本研究将以东北新收获早粳稻为研究对象,选取稻谷水分在14.50%~15.50%的稻谷HW 和水分含量在13.50%~14.50%稻谷样品LW,杂质≤0.30%,模拟实仓储藏条件进行模拟储藏,跟踪18 个月的储藏期进行定期取样检测。采用高通量测序技术分析不同初始水分含量的稻谷在模拟实仓储藏条件下,不同储藏时期稻谷真菌群落的演替变化。为储藏期间特定霉菌的防霉体系建立提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
以东北早粳稻稻谷作为研究对象,对新收获的高水分早粳稻进行自然晾干,通过水分测定仪测定,选取稻谷水分在14.50%~15.50%的稻谷HW 和水分含量在13.50%~14.50%稻谷样品LW,杂质≤0.30%,进入模拟仓进行模拟储藏,跟踪18 个月的储藏期进行定期取样检测。
模拟仓长宽均为1.10 m,高1.80 m,利用通风方式,将储藏条件调节为实仓储藏条件(温度17 ℃~25℃,相对环境湿度Relative Humidity,RH:45%RH~75% RH),粮面高度为1.20 m。按照实仓条件进行模拟储藏,储藏温度、湿度及取样时间如表1(储藏条件为即时计数)。按照表中条件各取样150.00 g,称取50.00 g 于无菌均质袋中作为3 个平行样品,于实验室中4 ℃保存。

表1 取样表Table 1 The table of samples
1.1.2 仪器和设备
PH-240(A)鼓风干燥箱,JXFM110 型锤式旋风磨。
1.1.3 试验试剂
无水乙醇、酚酞指示剂、0.025 mol/L 的氢氧化钾标准滴定液。
1.2 试验方法
1.2.1 水分的测定
参照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》第一法直接干燥法测定样品水分含量。
1.2.2 脂肪酸值的测定
参照GB/T 15684-2015《谷物碾磨制品脂肪酸值的测定》测定样品脂肪酸值。
1.2.3 样品基因组DNA 提取及PCR 扩增
采用Miseq-PE250 测序平台,利用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库。将合格的各上机测序文库梯度稀释后,根据所需测序量按相应比例混合,并经NaOH 变性为单链进行上机测序。
1.2.4 数据分析
使用MiSeq 测序仪进行双端测序,利用QIIME2 dada2 分析软件、Vsearch 软件进行序列去噪和OTU聚类,利用QIIME2、R 语言ggplot2 包进行Alpha 多样性、Beta 多样性分析以及分类学组成分析,利用R脚本、VenDiagram 包、plotrix 包制作OTU 韦恩图和PCA 主成分分析,利用R 脚本、pheatmap 包绘制聚类热图。
2 结果与分析
2.1 样品水分、脂肪酸值变化情况
如图1,两组稻谷水分含量在储藏第一、第二储藏期均有所下降,直至第三储藏期保持平稳。其中,高水分稻谷HW 水分含量由15.50%降低至15.09%;低水分稻谷LW 水分含量由14.21%降低至13.59%,低水分稻谷LW 下降幅度更大(14.21%降至13.59%)。
两组稻谷脂肪酸值的变化趋势呈现差异。其中,高水分稻谷HW 脂肪酸值在第一储藏期有所上升,由初始状态13.61 mg KOH/100 g 升高至16.27 mg KOH/100 g,在第二储藏期升高幅度有所减少,由16.20 mg KOH/100 g 升高至16.72 mg KOH/100 g,在第三储藏期脂肪酸值趋于稳定16.66 mg KOH/100 g。而低水分稻谷组LW 在第一储藏期脂肪酸值保持稳定趋势(13.61~13.73 mg KOH/100 g),在第二储藏期升幅剧烈(13.73~16.41 mg KOH/100 g),并在第三储藏期趋于稳定(16.27 mg KOH/100 g)。由此可见,两组水分的稻谷的水分、脂肪酸值的变化均在第三储藏期趋于稳定,这意味着两组稻谷中真菌群落所处的微生态环境趋于稳定。因此选取原始状态下的两种水分稻谷(HW、LW),第一储藏期和第二储藏期结束后的稻谷(HWS1、HWS2、LWS1、LWS2)进行宏基因组的提取和ITS 区的测序,进而对其真菌群落的演替进行分析。
2.2 样本数据统计
采用Illumina 平台对群落DNA 片段进行双端(Paired-end)测序。18 份稻谷样品所产生的有效序列数量通过分组求平均值,如表2 所示,其中HW 样品获得了较多的原始序列量179179 和高质量序列量150293。18份样品共有799295条有效序列长度为226,有412472 条有效序列长度为259,如图2。

表2 稻谷的测序数据Table 2 High-throughput sequencing data of samples
样品的丰度等级曲线是将样本中的OTU 按其丰度大小沿横坐标依次排列,并以各自的丰度值为纵坐标,从而反映各样本中OTU 丰度的分布规律。如图3,LW 曲线跨度最小,折线最陡峭,说明低水分稻谷进入储藏前OTU 数较少,且均匀度较低。而样品HWS1,HWS2 跨度最大,折线平缓,说明高水分稻谷进入储藏后OTU 数量开始增多,且群落组成的均匀度较高,群落中的物种开始生长繁殖。这说明,原始水分含量和储藏时间有助于稻谷真菌群落丰富度和均匀度的增长。
2.3 稻谷中真菌的分类单元统计
利用自编perl 脚本分析软件,通过对抽平后的ASV/OTU 进行统计,可以获得每个样本中的微生物群落在各分类水平的具体组成,可以计算不同样本在各分类水平所含有的分类单元数目。依据序列物种分类学注释的结果以及选择的样品,统计这些样本的物种注释结果中门、纲、目、科、属、种六个分类水平各自含有的分类单元的数量。如图4,不同的分类水平由不同颜色标识,柱子高度对应分类单元数量。两种水分稻谷在门的水平下的分类单元数量随着储藏时间的延长均有所增加。
2.4 稻谷中真菌群落多样性指数性分析
为了能够较为全面的评估样品中真菌菌群的Alpha 多样性,本实验以Chao1[21]和Observed species指数表征样品真菌菌群丰富度,以Shannon[22]和Simpson[23]指数表征多样性,以Pielou’s evenness[24]指数表征均匀度,以Good’s coverage[25]指数表征覆盖度。如图5 箱线图中,18 份稻谷样本的Coverage 指数均达到0.99,说明测序结果的覆盖度符合要求。
Chao1,Simpson 指数,高水分组稻谷先下降,后上升,多样性呈现先降低后升高的趋势,HWS2>HW>HWS1;而低水分组稻谷多样性呈现逐渐上升的趋势,LW<LWS1<LWS2。这说明与低水分稻谷相比,高水分稻谷进入储藏前已携带种类较多的真菌(HW>LW),而进入储藏以后这部分真菌受到储藏条件的限制而大量死亡,因此多样性指数开始下降(HWS1<HW)。由于稻谷本身水分偏高,这为储藏真菌的生长繁殖提供了适宜环境,因此随着储藏时间的延长高水分稻谷的真菌多样性指数开始升高(HWS2>HW>HWS1)。而低水分稻谷由于自身水分偏低,进入储藏前携带的真菌种类较少,进入储藏后储藏真菌开始大量繁殖,因此随着储藏时间的延长,多样性指数呈现逐渐上升的趋势(LW<LWS1<LWS2)。由此可见,稻谷本身的水分含量越高越有利于真菌的生存。
2.5 稻谷中真菌在不同分类水平下的组成差异分析
如图6,两种水分稻谷在不同储藏时期的真菌群落在门的水平上分类为5 个菌门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、羊肚菌门(Mortierellomyco)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)。其中子囊菌门(Basidiomycota)真菌在高水分稻谷(HW)中,随着储藏时间的延长,其数量呈现先增加后减少的趋势(HW,53.20%;HW1,74.60%;HW3,55.80%)。而在低水分稻谷(LW)中,随着储藏时间的延长,其数量表现为持续增加的趋势(HW,44.60%;HW1,73.90%;HW2,85.40%)。担子菌门(Basidiomycota)真菌在高水分稻谷(HW)中随储藏时间的延长数量持续增加(HW,11.20%<HWS1,2.40%<HWS2,39.80%);而在低水分稻谷(LW)中随储藏时间的延长数量先增加后减少(LW,3.20%<LWS1,12.20%>LWS2,8.60%)。
两种水分稻谷在不同储藏时期的真菌群落在种的水平上进行分类统计,如图7,选取相对丰度较高的10 个物种绘制成表,如表 3。其中稻瘟病菌(Magnaporthe_grisea)、金黄色蝶形担孢酵母(Papiliotrema_aurea)、弯孢菌(Curvularia_inaequalis)、黑孢霉(Neosetophoma_samararum)、汉纳酵母菌(Hannaella_sinensis)在高水分稻谷HW 样品中的相对丰度随着储藏时间的延长逐渐上升(HW<HWS1<HWS2);黑粉菌(Filobasidium_magnum)、稻瘟病菌(Magnaporthe_grisea)、Hannaella_zeae的相对丰度随着储藏时间的延长呈现先升高后降低的趋势(HW<HWS1>HWS2);Papiliotrema_fuscus的相对丰度则是随着储藏时间的延长先降低后上升(HW>HWS1<HWS2);弯孢菌(Curvularia_inaequalis)经历第一次储藏期后相对丰度降为0,可以认为该物种在高水分稻谷中几乎消失。在低水分稻谷中,弯孢菌(Curvularia_inaequalis)、汉纳酵母菌(Hannaella_sinensis)、Hannaella_zeae在最初取样时的相对丰度为0,而在经历两个储藏期后相对丰度有所上升(LW<LWS1<LWS2);黑孢霉(Neosetophoma_samararum)、黑粉菌(Filobasidium_magnum)、Mycosphaerella_tassiana、弯孢菌(Curvularia_inaequalis)的相对丰度随着储藏时间的延长持续降低(LW>LWS1>LWS2);稻瘟病菌(Magnaporthe_grisea)、Papiliotrema_fuscus、金黄色蝶形担孢酵母(Papiliotrema_aurea)的相对丰度先上升后降低(LW<LWS1>LWS2)。其中,稻瘟病菌(Magnaporthe_grisea)、金黄色蝶形担孢酵母(Papiliotrema_aurea)、弯孢菌(Curvularia_inaequalis)、黑孢霉(Neosetophoma_samararum)、汉纳酵母菌(Hannaella_sinensis)在高水分稻谷中占有较大比例,且随着储藏期的延长,其丰度持续上升,这与徐园程[26]在20 ℃,43% RH 储藏条件下稻谷的主要菌种是黑孢霉(Neosetophoma_samararum)、弯孢菌(Curvularia_inaequalis)的结果一致。其中黑孢霉(Neosetophoma_samararum)、弯孢菌(Curvularia_inaequalis)会引起一种症状与稻瘟病相似的新型叶斑病,其病原尚无鉴定报道,会严重影响水稻产量及品质[27]。因此控制稻谷进入储藏前的水分含量来减少病原真菌的产生[28],才能从源头上保证稻谷品质的品质安全。而与此不同的是,有学者通过对安徽省国属粮库中籼稻样品进行优势菌种的分析发现,曲霉菌属是储藏期稻谷的优势菌属之一[29]。微生物的群落变化是微生物本身与其所处环境(稻谷品质、环境温湿度)相互作用的结果,不同环境中的同种微生物或者同一环境中的不同微生物生长和代谢均存在着差异[30]。因此可以推测,稻谷的品种以及产地可能是影响储藏期间优势菌种的原因之一。值得注意的是,两种水分的稻谷在第二储藏期结束时也存在共有的优势菌种,如弯孢菌(Curvularia_inaequalis)、汉纳酵母菌(Hannaella_sinensis)。其中弯孢菌(Curvularia_inaequalis)为过渡真菌,意味着随后会向储藏真菌演替[31]。
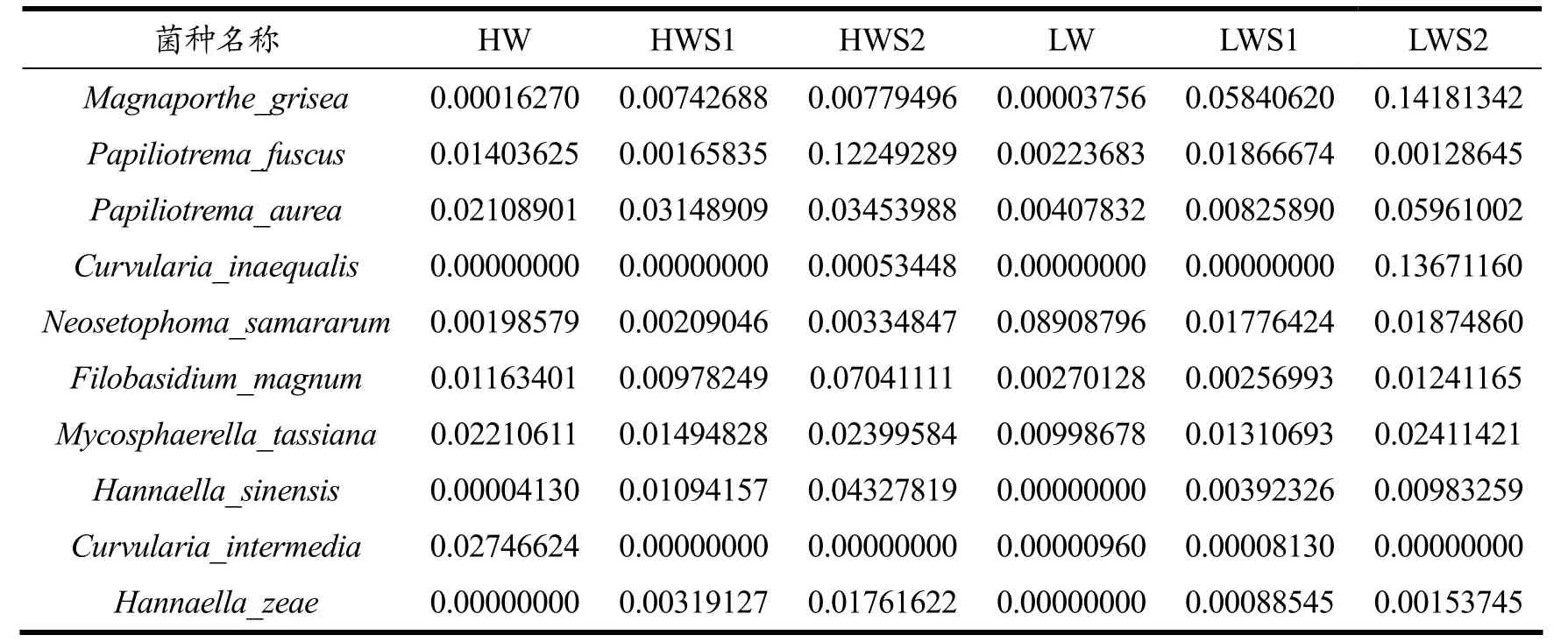
表3 各优势菌种在样品中所占丰度Table 3 Abundances of dominant species in the samples
2.6 稻谷中真菌的物种组成及丰度热图
为了进一步比较样本间的物种组成差异,实现对各样本的物种丰度分布趋势的展示,可以使用热图进行物种组成分析,默认使用平均丰度前20 位的属的丰度数据绘制热图。如图8。在高水分稻谷HW 中,随着储藏时间的延长,线黑粉酵母菌属(Filobasidium)、曲霉菌属(Aspergillus)、白布勒担孢酵母菌属(Bulleromyces)、节担菌属(Wallemia)、隐球菌属(Cryptococcus)、Papiliotrema、汉纳酵母菌属(Hannaella)、Sporobolomyces、Symmetrospora的相对丰度增加,菌属Didymella、Kondoa的相对丰度降低;在低水分稻谷LW 中,随着储藏时间的延长,菌属Neosetophoma、Didymella的相对丰度降低,到第二储藏期时相对丰度降为0;菌属Magnaporthe、Curvularia、Coniothyrium、Neosetophoma的相对丰度增加。同时,在储藏初期,高水分稻谷(HW)和低水分稻谷(LW)中真菌的群落组成具有相似性,其优势菌属均为Neosetophoma、Didymella。到了第二储藏期,高水分稻谷(HWS2)和低水分稻谷(LWS2)中真菌的群落组成在属的水平上发生变化,优势菌属发生了明显的演替,有研究表明这是由于储藏过程中稻谷的代谢产物累积后产生了相互抑制的作用[32,33]。
2.7 不同水分稻谷真菌群落差异分析
通过Ven 图进行群落分析,可以探究不同样本间共有物种和独有物种,如图9。通过高水分稻谷(HW)和低水分稻谷(LW)进行对比发现,HW 与LW 共有的OTU 数量为71 个,HW 具有的特性OTU 数量较多为97个。随着储藏时间的延长,通过HWS2与LWS2对比发现,两组样品共有的OTU 数量增加至114,两组样品各自具有的特性OTU 增加至137 和145。在高水分稻谷HW 储藏阶段,三个储藏期的样品具有的共同OTU 数量为68 个,储藏的时间越长,样品具有的特性OTU 数量越多(HW<HWS1<HWS2);在低水分稻谷LW 储藏阶段,三个储藏期的样品具有的共同OTU 数量为49 个,随着储藏时间的延长,样品具有的特性OTU 数量越多(LW<LWS1<LWS2)。由此可见,在进入储藏前高水分稻谷的真菌群落丰富度高于低水分稻谷,而随着储藏的进行,高水分稻谷的真菌群落丰富度依然高于低水分稻谷。而尽管是低水分稻谷,在储藏阶段其真菌群落物种丰富度也在增加。通过高通量测序技术可以获取到很多真菌种类及其丰度方面的信息,但也只有一部分真菌会在储藏条件下进一步生长发育并且需要在一定条件下对稻谷产生不良影响[34]。
2.8 Beta 多样性分析
依据Yurkov[35]的方法对两种水分的稻谷进行PCA 分析(Principal Component Analysis)。如图10,图中不同水分含量、不同储藏期的稻谷中真菌群落距离越近,则表示群落相似度越高。其中,高水分稻谷和低水分稻谷在第一储藏期(HWS1 和LWS1)位置相对较近,说明这两种状态下的稻谷样品中真菌群落多样性差异较小;低水分稻谷在原始状态和第一储藏期(LW 和LWS1)的位置相对较近,说明低水分稻谷在第一储藏期内的真菌群落多样性变化较小;而低水分稻谷在第二储藏期(LWS2)与低水分稻谷其他储藏期的样品位置较为分散,说明其真菌群落多样性差异较大。而高水分稻谷(HW、HWS1、HWS2)在三个储藏状态下位置间均相对分散,说明稻谷样品直接真菌群落物种多样性差异较大。由此可见,低水分稻谷在第一储藏期之前的真菌群落多样性变化较小,进入第二储藏期后真菌群落多样性增加;而高水分稻谷在每个储藏期的真菌群落多样性均有所增加,真菌群落发生明显演替。
3 结论
本实验通过测定不同初始水分含量的稻谷在不同储藏期的水分、脂肪酸值的变化趋势,确定了将第一、第二以及原始样品作为高通量测序的研究对象来分析稻谷中真菌群落的演替变化。采用Illumina 平台对18份稻谷样品的DNA 片段进行双端测序后发现,高水分稻谷的多样性先降低后升高;而低水分稻谷的多样性持续升高。由此可见,水分仍是从储藏源头抑制真菌活动的关键因素。通过对OTU 进行物种分类,结果表明,两种水分的稻谷随着储藏时间的延长,其真菌群落经历了不同的演替变化,高水分稻谷在每个储藏期,真菌群落都发生了明显演替。到第二储藏期时,稻瘟病菌(Magnaporthe_grisea)、金黄色蝶形担孢酵母(Papiliotrema_aurea)、弯孢菌(Curvularia_inaequalis)、黑孢霉(Neosetophoma_samararum)、汉纳酵母菌(Hannaella_sinensis)成为了高水分稻谷中的优势菌种。而低水分稻谷在第一储藏期内,真菌群落并没有发生明显的演替变化,但是真菌群落的组成和丰度持续增加,而在第二储藏期结束后真菌群落才发生演替,到第二储藏期时,弯孢菌(Curvularia_inaequalis)、汉纳酵母菌(Hannaella_sinensis)、Hannaella_zeae成为了优势菌种。因为活跃的真菌活动会影响粮堆温度甚至是储藏温度,因此在储藏条件不受人工干预时,两种水分的稻谷都会发生由田间真菌向储藏真菌的演替。为了有效抑制演替现象的发生,在储藏前期应及时采取空调控温或通风措施来抑制微生物活动导致的持续高温,以此来保证储粮安全。
