腹部脂肪CT检测在新诊断多发性骨髓瘤中的预后价值分析
2022-07-27王宇彤程晓光陆敏秋程克斌
高 珊,王宇彤,程晓光,褚 彬,陆敏秋,程克斌,鲍 立*
(1.北京积水潭医院 血液科,北京100096;2.北京积水潭医院 影像科,北京100096)
多发性骨髓瘤(MM) 是一种恶性单克隆浆细胞疾病,在血液系统恶性肿瘤的发病率中排名第二[1-2]。尽管如此,MM发病确切的病因和机制仍未完全阐明。肥胖已被确定为包括MM在内的许多癌症发展的危险因素[3]。肥胖与MM之间关联的潜在机制尚不完全清楚,但可能涉及糖代谢受损[4]和脂肪因子的不适当分泌,包括脂联素减少和瘦素上调[5]。流行病学研究表明,通过体重指数(BMI)和腰围评估的腹部肥胖与MM发病更相关[6]。1项关于20个前瞻性研究的汇总分析发现,较高的成人BMI与MM死亡率升高有关[6]。其他研究报道称,与正常体重MM患者(BMI 18.5-24.9 kg/m2)相比,低体重MM患者(BMI<18.5 kg/m2)死亡率增加,超重患者(BMI>25 kg/m2)死亡率降低[7]。这些自相矛盾的结果可能是与疾病相关的体重减轻导致的,因为BMI是主要受体重影响的肥胖替代指标[8]。我们推测无法描述腹部脂肪含量的BMI不适合评估MM的预后,而腹部脂肪组织的定量指标适用于评估肥胖与MM之间的关联。
计算机断层扫描(CT) 可以通过测量内脏脂肪面积(VFA) 和皮下脂肪面积(SFA) 来对腹内脂肪含量进行准确评估,并且通常用于MM的诊断和疗效的评估[9]。包括胃肠道癌[10-11]、肾细胞癌[12]和黑色素瘤[13]在内的实体瘤临床研究表明,内脏脂肪增加与治疗反应差、无进展生存期(PFS)和总体生存(OS)缩短有关。很少有研究调查腹部脂肪含量对治疗反应和生存结果的预测作用[14,15]。Takeoka等人的研究表明,皮下脂肪组织指数(SAI) 降低与MM患者的不良生存相关[14]。Janathan等人研究发现腹部和骨盆的 VFA 与治疗结果之间存在相互关联[15]。尽管如此,脂肪含量和MM之间的确切关系仍未完全阐明。目前仍没有研究比较过MM患者和健康人之间腹部脂肪含量的差异。
在这项研究中,我们首次比较了MM患者和BMI匹配的健康人的腹部脂肪含量。我们同时分析CT评估的VFA和SFA与MM基线特征和预后因素,包括NDMM患者的疾病分期、不良细胞遗传学和治疗反应。
1 资料与方法
1.1 临床资料
回顾性分析36例2015年10月至2017年3月北京积水潭医院血液科依据IMWG诊断标准确诊的NDMM患者资料[16-17]。这些患者在化疗前或复发时行腹部和盆腔CT检查。我们随访这些患者从确诊到本研究结束,除非有患者死亡或退出。这些NDMM患者的中位随访时间为677天(26-981天)。对于每个NDMM病例,从我院影像科支持的数据库中随机选择2名匹配的健康人。该数据库中包含的受试者是自2014年6月以来北京积水潭医院骨科正在研究的脊柱退变情况的参与者。这些对照病例使用年龄、性别、身高、体重和BMI的标准进行匹配。本研究经我院伦理委员会审核同意。
1.2 检查和疗效评价
患者行血常规、生化(乳酸脱氢酶、钙、肌酐)、免疫球蛋白、β2微球蛋白和骨髓流式细胞学等检查,同时通过CD38+纯化浆细胞的荧光原位杂交(FISH)检查进行骨髓细胞遗传学检测,包括17p缺失、t(4;14)、t(14;16)、t(11;14)、1q21>3倍扩增。患者行含蛋白酶体抑制剂的方案化疗,并在自体造血干细胞移植前4个周期化疗后评估疗效。诱导治疗后至少达到部分反应(PR) 的患者被认为有治疗有反应[18]。
1.3 腹部脂肪定量检测
所有模拟扫描均在仰卧位使用符合全腹部定量计算机断层扫描(QCT) 的五个体模(Mindways Software Inc.,America) 的 CT 扫描仪获得。禁食一夜后,所有研究均在 80 层 CT 扫描仪(东芝医疗系统公司,东京,日本)上进行。经过一般校准,仪器参数设置如下:120 kV,250 mA,40 cm FOV,120 cm床高,1 mm切片厚度,512×512矩阵。扫描通常从最后一个胸椎(T12) 延伸到骶骨(S1) 和六层 T12/L1、L1/L2、L2/L3、L3/L4、L4/L5 和 L5/S1 椎体界面用作解剖标记.分别得到各层级的内脏脂肪面积(VFA)和总脂肪面积(TFA),皮下脂肪面积(SFA)的计算公式为:SFA=TFA-VFA[19]。这些测量和分析由对患者信息不可见的影像科医生进行。
1.4 酶联免疫吸附试验(ELISA) 检测血浆中的脂联素
收集25名NDMM患者的血样以检测总脂联素的基线水平。来自17名健康人的血浆样本用作正常对照,这些样本是从其余的常规血液测试中收集的。根据制造商的方案,使用人ELISA试剂盒(Abcam Inc.Burlingame,CA)测量脂联素。在采集血后4小时内,将EDTA抗凝血液以1 000xg离心15分钟。将分离的血浆在4℃下以10 000xg再次离心10分钟以获得去血小板血浆,然后将其等分并储存在-80℃冰箱直至测试。一式两份分析所有样品。可检测到大于25 pg/ml的脂联素浓度。使用酶标仪(Bio-Rad,Berkeley,CA,USA)在450 nm处测量颜色强度,并使用CurveExpert 1.4分析所得数据。进行Elisa检测的人员对样本的临床背景不知情。
1.5 统计分析
体重指数(BMI) 定义为以公斤为单位的个体体重除以以米为单位的身高平方(kg/m2)。计算VFA/SFA的比值以显示腹部脂肪的分布。为连续变量报告中值和范围,为分类变量报告比例。Shapiro-Wilk检验用于估计参数分布的正态性。然后用双边t检验分析具有正态分布的变量。脂肪面积的值均不服从正态分布。NDMM和健康人的比较通过Mann-Whitney U非参数检验进行。为了分析基线特征和腹部脂肪室之间的关联,对性别、DS分期、不良细胞遗传学和化疗反应进行了Mann-Whitney U非参数检验。采用Spearman检验分析脂肪面积与年龄、身高、体重、BMI、BM分期、LDH等连续量的相关性。所有程序均使用统计软件包(SPSS 16.0,SPSS,Inc.,Chicago,IL)进行,P<0.05 被认为是有显著性意义。
2 结果
2.1 NDMM患者的腹部脂肪测定
NDMM患者的TFA(L4/L5、L5/S1)、VFA(L4/L5、L5/S1)和SFA(T12/L1、L1/L2、L2/L3、L4/L5、L5/S1)高于健康人。脂肪含量数值如表1所示。我们将脂肪分布表示为 VFA/SFA,发现NDMM和健康人之间没有显着差异。

表1 MM患者和健康人的基本资料及脂肪分布表
2.2 MM患者基线资料与脂肪含量测定的关系
MM患者的基线资料见表2。未发现腹部脂肪含量参数与基线特征(DS 分期、单克隆蛋白、LDH、血红蛋白、肌酐、尿钙轻链和 β2 微球蛋白)的既定因素之间存在相关性。通过流式细胞术测量的骨髓(BM)浆细胞,发现与SFA呈相互关系(L2/L3,P=0.018,r=-0.398),而与VFA/SFA 呈正相关(T12/L1,P=0.047,r=0.338;L2/L3,P=0.039,r=0.351),如图1所示。

表2 MM患者的基线资料
2.3 患者高危细胞遗传学与脂肪含量关系
观察到不良细胞遗传学与腹部VFA呈正相关。高危遗传学异常1q21扩增与L4-L5中更多的VFA相关(P=0.044),如表3所示。脂肪组织参数和其他不良细胞遗传学分析,包括 Del 17p13(n=11/36),Del 13q14(n=10/36),T(14;16)(4/36),T(4;14)(7/36)和T(14/11)(n=4/36),显示无显著相关性。

表3 对存在基线细胞遗传学异常具有统计学意义的脂肪组织值的平均值
2.4 疗效
21名患者完成了8个周期的化疗,其中有7名患者达到了VGPR及以上疗效,9名患者评效PR。总体治疗反应(ORR) 定义为 PR及以上疗效(n=16)。表4总结了腹部脂肪含量和治疗反应的分析。ORR与L4/L5(P=0.025)和L5/S1(P=0.044) 的 SFA 呈负相关。因此,有治疗反应患者的 L4/L5(169.97 cm2)和 L5/S1(185.91 cm2)中位SFA低于无治疗反应者(分别为 262.19 cm2和300.09 cm2)。VFA/SFA(L4/L5)的比例对治疗反应的影响差别也有统计学意义(P=0.002)。

图1 BM 和 SFA 中浆细胞百分比的相关性(L2-L3)(r=-0.398,P<0.05)(A),VFA/SFA(T12-L1)(r=0.338,P<0.05)(B),VFA/SFA(L2-L3)(r=0.335,P<0.05)(C)。
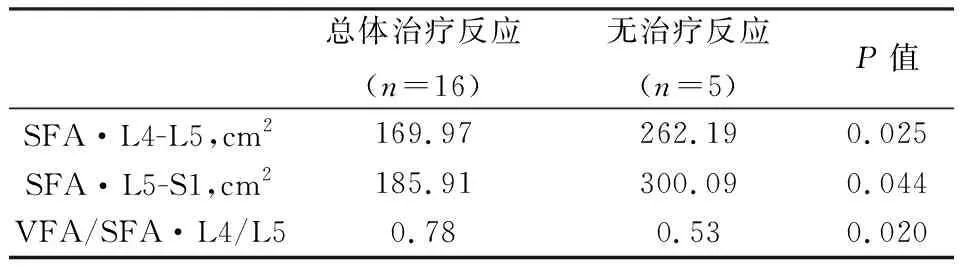
表4 对8个化疗周期后的总体反应具有统计学意义的脂肪组织值的平均值
2.5 血浆中脂联素水平
NDMM和健康人的血浆脂联素水平由Elisa方法进行测量。如图2所示,NDMM组的血浆脂联素水平显著低于健康人组(1 147.40 pg/ml与2 077.10 pg/ml,P=0.00067)。

图2 NDMM患者和健康人的血浆脂联素水平
3 讨论
通过目前的研究,我们证实与BMI匹配的健康人相比,NDMM患者的两个椎间盘(L4/L5、L5/S1)的TFA和VFA更高,而血浆中的脂联素水平较低。同时我们观察到过高的SFA(L2/L3) 和低比例的VFA/SFA(T12/L1 和 L2/L3) 与低水平的骨髓浆细胞相关。此外,VFA(L4/L5)与高危细胞遗传学异常1q21扩增相关,而L4/L5和L5/S1的SFA更多与较差的治疗反应显著相关,提示是NDMM的不良预后因素。
这项研究首次比较了NDMM患者和健康人之间使用CT扫描评估的脂肪含量。基于我们影像科健康人腹部脂肪含量的数据库,我们发现NDMM患者与BMI匹配的健康人群相比,腹部脂肪尤其是SFA更高。导致NDMM患者脂肪含量过高的一个潜在原因是肥胖者患癌症的风险更高[3]。前瞻性研究的荟萃分析报道,在超重或肥胖的受试者中,MM的风险在统计学上显著升高[20]。在MM确诊前骨骼肌的减少和脂肪组织的增加同时发生[21],也可能导致NDMM患者的TFA、VFA和SFA过多。我们研究中的患者通常体重正常,但他们通常存在隐匿的脂肪过多。诊断CT成像通过测量SFA和VFA提供了对腹内脂肪量的评估。
皮下脂肪组织过多(L2/L3)和VFA/SFA比率低(T12/L1和L2/L3)的患者与BM浆细胞水平低相关(图2)。由于储存能量是皮下脂肪组织的主要功能,低体积的SFA反映了骨髓瘤细胞引起的严重能量耗竭,表明该疾病已进入晚期[22]。癌症患者的脂肪萎缩可能是由脂肪氧化、脂肪生成减少、脂质沉积和脂肪生成受损以及白色脂肪组织褐变引起的。肿瘤和宿主细胞产生的炎症细胞因子,包括白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β),可能直接促进脂肪分解[23]。对实体瘤患者的CT图像分析显示,患者的内脏脂肪减少超过皮下脂肪[24]。
除了观察到的脂肪含量与肿瘤负荷之间的联系外,我们还观察到过多的SFA与较差的治疗反应之间存在相关性。Gonzalez C等报道了核因子-κB p65(NF-κBp65)及其促炎靶基因(IL-1β、IL-6、INF-γ、TNF-α、MCP-1)在恶病质癌症患者的皮下脂肪组织中表达[25]。先前的研究表明,IL-6R表达增多与MM患者对沙利度胺的反应不佳有关[26]。蛋白酶体抑制剂硼替佐米通过抑制NF-κB诱导的信号通路来治疗MM[27]。炎性细胞因子与硼替佐米治疗反应之间的关系仍未阐明。由于入组患者数量较少,我们对接受硼替佐米和沙利度胺治疗的MM患者进行了分析。需要基于化疗方案的亚组分析和对各种因素的多变量分析来阐明皮下脂肪对MM患者治疗反应的直接影响。
在我们分析的所有高危细胞遗传学异常中,1q21扩增与VFA(L4-L5)呈正相关,而Maximilian等报道的是t(4;14)和1q21扩增的患者VFA更低[15]。在我们研究中MM患者与健康人相比内脏脂肪组织过多(L4/L5和L5/S1),这表明VFA可能与疾病相关。此外,Joyc等人通过FDG-PET/CT检测脂肪代谢活动,NDMM患者与MGUS患者相比内脏组织代谢活动更高[28]。
总之,我们的研究探讨了NDMM和健康人之间腹部脂肪分布的差异,皮下脂肪含量与肿瘤负荷和不良治疗反应相关,而内脏脂肪与高风险细胞遗传学相关。CT检测腹部脂肪含量可能具有预后意义,仍需要更多的临床数据来验证。
