致病性大肠杆菌所致犊牛腹泻的病原分析及治疗
2022-07-25梁艳艳侯铭源田梦悦马玉忠
梁艳艳,李 可,贾 丽,侯铭源,田梦悦,张 婷,马玉忠
(河北农业大学 动物医学院,河北 保定 071001)
近年来,犊牛腹泻的发病率呈明显上升趋势。引起犊牛腹泻的病因很多,其中大肠杆菌所致的腹泻多发,常引起犊牛的消化不良、腹泻、脱水,重者引起死亡。该病的发生给养牛业造成巨大的经济损失[1]。目前,治疗犊牛腹泻大肠杆菌病主要以抗生素为主,但抗生素的不合理使用导致大肠杆菌耐药性的产生,给该病的防治造成了一定困难[2]。为了有效预防和控制犊牛腹泻大肠杆菌病,本试验采集保定市某牛场36头腹泻犊牛的新鲜粪样,通过病原体分离鉴定及分离株的致病性和耐药性检测,并对其进行治疗试验,旨在为犊牛大肠杆菌性腹泻的治疗提供依据。
1 材料与方法
1.1 样品采自保定市某牛场36头40~50日龄腹泻犊牛的新鲜粪样。
1.2 主要试剂麦康凯琼脂、伊红美蓝琼脂、普通琼脂、普通肉汤等培养基,细菌生化微量反应管,药敏片均购自杭州滨和微生物试剂有限公司。DL2000 DNA Marker购自中科瑞泰科技公司。2×Taq Master Mix购自康为世纪生物公司。新霉素可溶性粉购自天津天农大生物科技公司,白头翁散购自河南普旺生物工程公司。
1.3 细菌分离培养将无菌采取的粪样用三线法接种于普通琼脂培养基上,37℃培养24 h后,挑取菌落,革兰染色,镜检。
1.4 分离菌培养特性挑选单个疑似大肠杆菌菌落,接种于麦康凯琼脂培养基上,37℃培养24 h;挑取单个红色菌落接种到伊红美蓝培养基上,再次培养后,染色镜检。
1.5 分离菌生化试验将25株分离菌进行生化鉴定,观察并记录试验结果。
1.6 分离菌16S rDNA PCR鉴定设计并合成大肠杆菌16S rDNA 通用引物(表1)。提取分离株基因组DNA作为模板。PCR反应体系:上、下游引物各1 μL,模板DNA 2 μL,2×Taq Master Mix 12.5 μL,ddH2O 8.5 μL;PCR扩增条件:95℃ 5 min,94℃ 30 s,57℃ 30 s,72℃ 1 min,共30个循环,最后72℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,观察结果。将PCR产物送生工生物工程(上海)股份有限公司测序,结果与GenBank已知序列比对分析,确定菌种信息。

表1 引物信息
1.7 分离菌株小鼠致病性试验SPF级BALB/c小鼠,体质量(20 ± 2)g,由河北医科大学实验动物中心提供。选取156只健康小鼠,随机分成26组,每组6只。第1组为对照组,其余为试验组。将菌液浓度调至1×108CFU/mL,取1 mL菌液装入1.5 mL 离心管,12 000 r/min离心2 min。弃上清,用1 mL灭菌生理盐水悬浮。试验组每只小鼠腹腔注射相应菌液0.2 mL,对照组注射等量生理盐水,观察记录小鼠的临床症状和病死情况。剖检病死小鼠,观察器官病变,并采集心脏、肝脏、脾脏、肺脏、肾脏进行细菌的分离鉴定。
1.8 分离株的血清型鉴定对鉴定为致病性大肠杆菌的菌株,培养处理制成凝集抗原,采用玻片凝集试验进行血清型鉴定。
1.9 分离菌药敏试验取200 μL菌液均匀涂布到普通琼脂培养基上,贴药敏片,37℃培养24 h,测量抑菌圈直径。参照CLSI的标准进行判定。
1.10 耐药基因检测根据GenBank数据设计11种耐药基因引物(表2),由生工生物工程(上海)股份有限公司合成。以待测基因为模板进行PCR扩增,产物进行1.0%琼脂糖凝胶电泳,观察结果。

表2 大肠杆菌耐药基因引物信息
1.11 治疗试验随机将患病犊牛分为4组:A组为最敏感抗生素组,B组为中药组,C组为最敏感抗生素+中药组,D组为患病组;另选健康犊牛设为E组,作为对照组。治疗期间均正常饲喂,并观察效果。
2 结果
2.1 细菌分离培养及染色镜检共获得25株疑似大肠杆菌的菌株。这些菌株在普通琼脂培养基上呈圆形、灰白色、半透明状(图1),在麦康凯培养基上为表面光滑的红色圆形菌落(图2),在伊红美蓝培养基上为紫黑色带金属光泽的圆形大菌落(图3)。挑取单个菌落进行革兰染色,镜下可见两端钝圆的粉红色短杆菌(图4)。
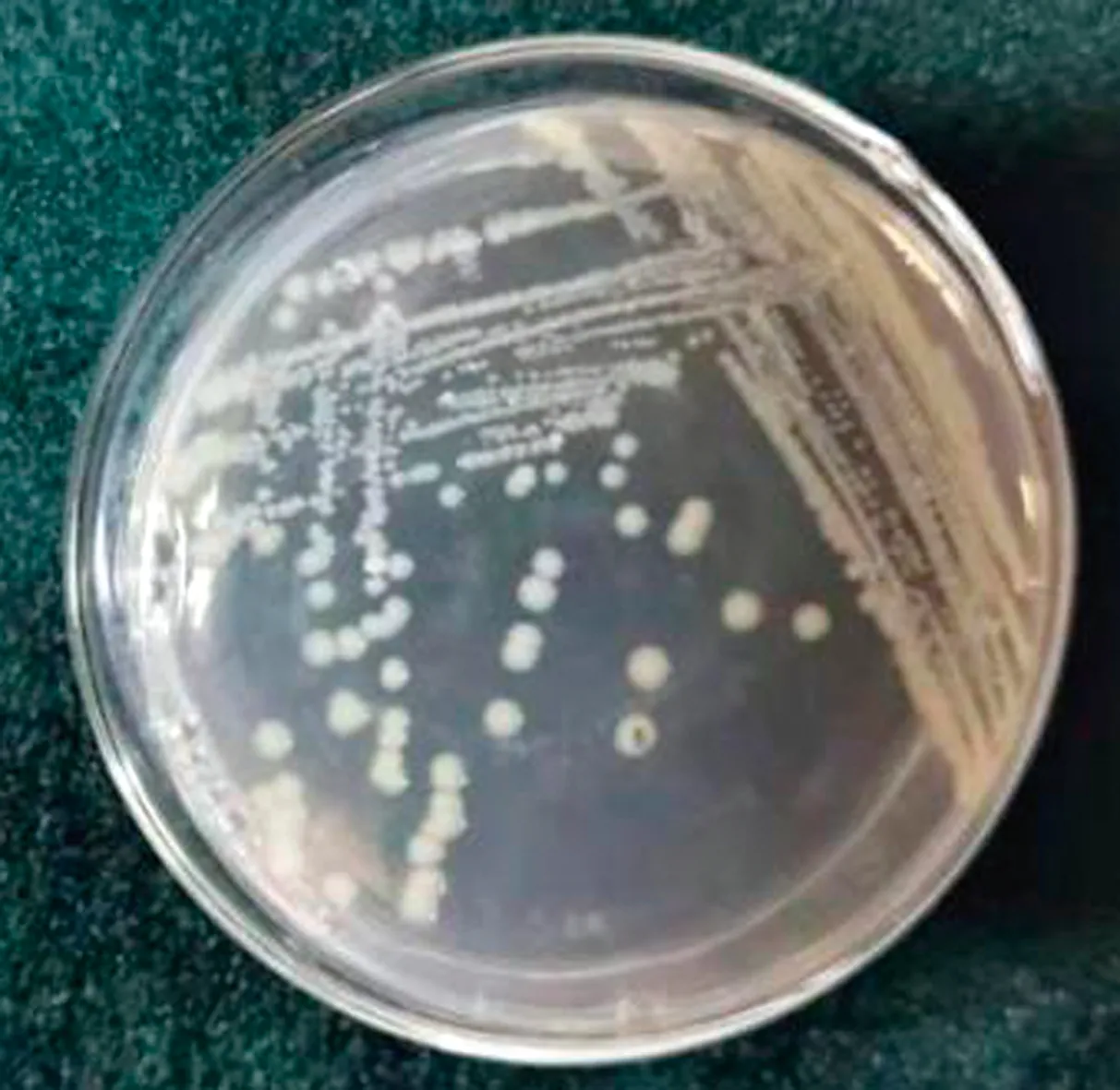
图1 普通琼脂平板上菌落形态 图2 麦康凯琼脂平板上菌落形态

图3 伊红美蓝琼脂平板上菌落形态 图4 分离菌的形态观察(1 000×)
2.2 生化鉴定生化鉴定结果表明,25株分离株符合《伯杰氏手册》的大肠杆菌生化鉴定标准。硫化氢、苯丙氨酸、葡萄糖酸盐、枸橼酸盐、尿素反应均为阴性,蛋白胨水、半固体、赖氨酸、鸟氨酸、棉子糖、山梨醇、侧金盏花醇、木糖反应均为阳性。
2.3 16S rDNA PCR鉴定经PCR扩增及凝胶电泳,得到1 400 bp左右的目的条带(图5)。测序结果经BLAST在线比对,25株分离菌与大肠杆菌的同源性高于99%,确定为大肠杆菌。

M.DL2000 DNA Marker;1~13.被检菌株
2.4 小鼠致病性试验接种大肠杆菌后,各试验组小鼠出现了精神萎靡、食欲不振、被毛杂乱、腹泻、抽搐等症状。一段时间后,22个试验组的小鼠全部死亡,致死率为88%(22/25)。剖检死亡小鼠(图6),可见肠壁变薄,肠道黏膜出血,肠内产气,实质脏器充血淤血。取小鼠心脏、肝脏、脾脏、肺脏、肾脏等组织进行涂片染色镜检,可见革兰阴性短小杆菌。挑取病变组织接种于伊红美蓝培养基上,37℃培养18 h,可见典型的大肠杆菌菌落生长。
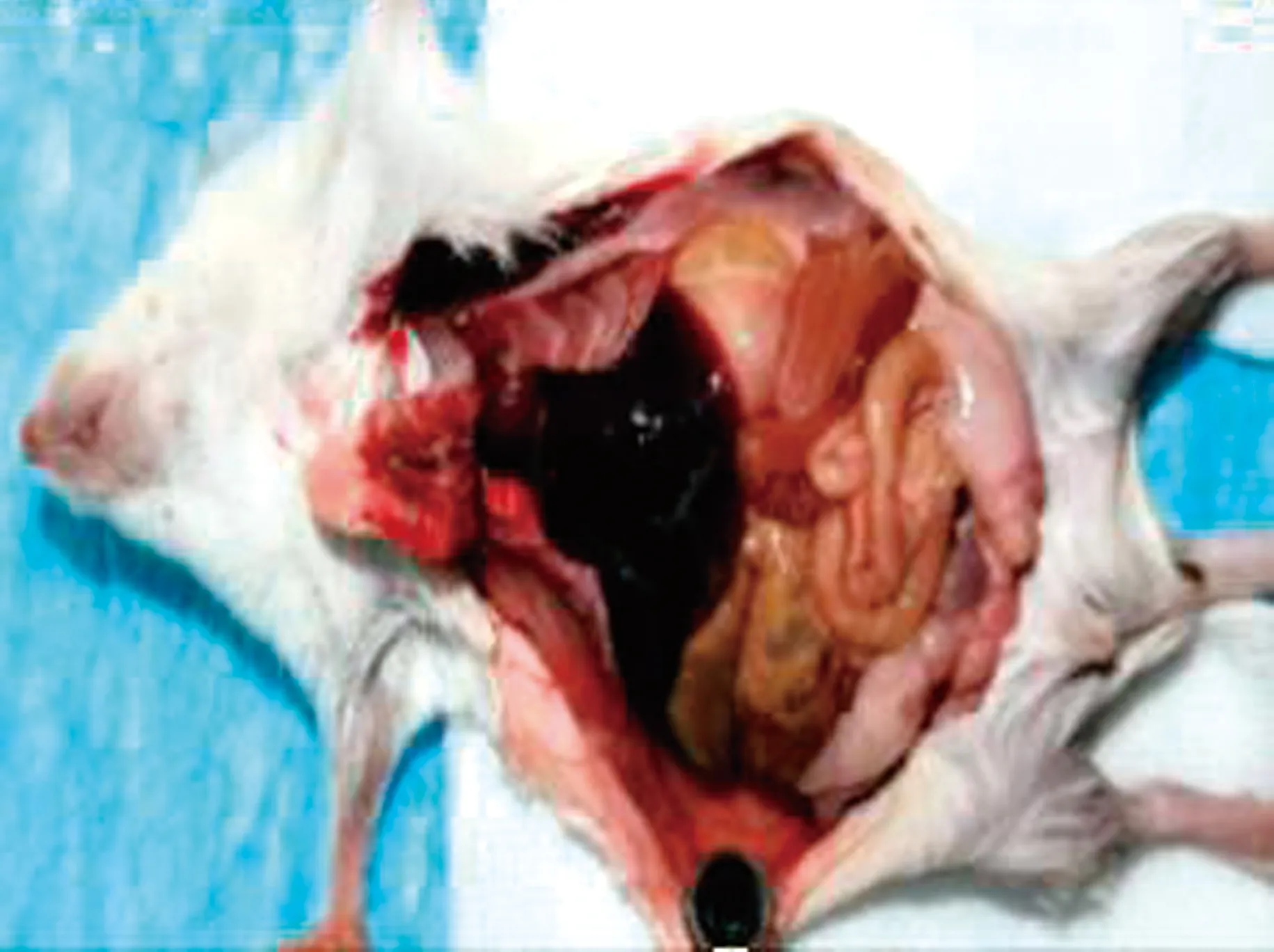
图6 小鼠剖检病变
2.5 O血清型的鉴定通过玻片凝集试验,在25株致病性大肠杆菌分离株中定型了15株,共覆盖了6种血清型,分别为O152、O157、O167、O100、O19和O39,其中O157和O152为优势血清型,分别占定型血清的30%和26%;10株未能定型(表3)。

表3 致病性大肠杆菌的血清型鉴定
2.6 药敏试验药敏试验表明(表4),25株分离菌对强力霉素、复方新诺明的耐药率最高(88%);对氨苄西林、链霉素、环丙沙星的耐药率分别为76% (19/25),72% (18/25),56% (14/25)。对新霉素敏感率高达80% (20/25),对多黏菌素B、头孢曲松的敏感率分别为64% (16/25),60% (15/25)。

表4 25株分离菌的药物敏感性
2.7 耐药基因检测对25株分离菌的耐药基因检测表明,大环内酯类ermB基因(图7)和四环素类tetB基因的检出率最高(100%),β-内酰胺类blaTEM、氨基糖苷类aaC2、aaC4和喹诺酮类qnrB等基因的检出率分别为72%,64%,68%,60%,未检测到四环素类tetA和磺胺类sul2基因(表5)。
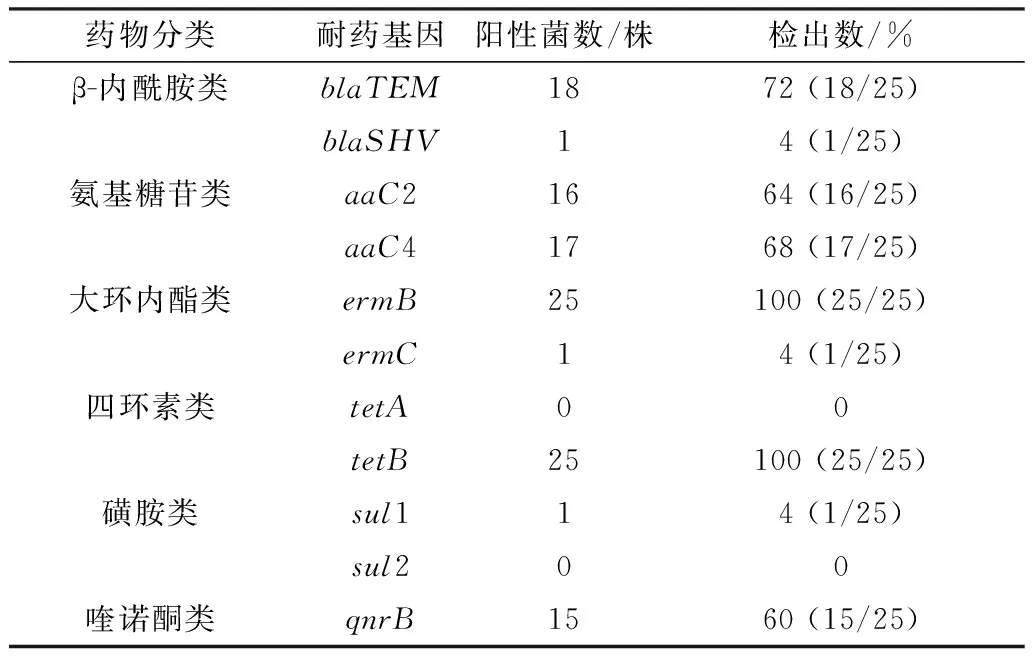
表5 11种耐药基因检出率

M.DL2000 DNA Marker;1~13.被检菌株
2.8 治疗试验最敏感抗生素为新霉素,故将新霉素用于治疗试验,中药选用白头翁散。25头大肠杆菌性腹泻犊牛分为4组:A组(新霉素治疗组,6头),6.5%新霉素可溶性粉剂,0.1 g/kg体质量,灌服,每天2次,连用5 d;B组(白头翁散治疗组,6头),白头翁散,0.1 g/kg体质量,灌服,每天2次,连用5 d;C组(新霉素+白头翁散治疗组,6头),6.5%新霉素可溶性粉0.1 g/kg体质量+白头翁散0.1 g/kg体质量,灌服,每天2次,连用5 d;D组(患病组,7头),不予治疗。E组(对照组),6头40~50日龄的健康犊牛。
从表6结果显示,C组治愈率最高(100%),5 d后痊愈;A、B组治愈率分别为83.3%和66.7%。B、D组的病死率分别为16.7%和28.6%。相比于单纯使用抗生素或中药,中药和抗生素联合应用的治疗效果最佳。
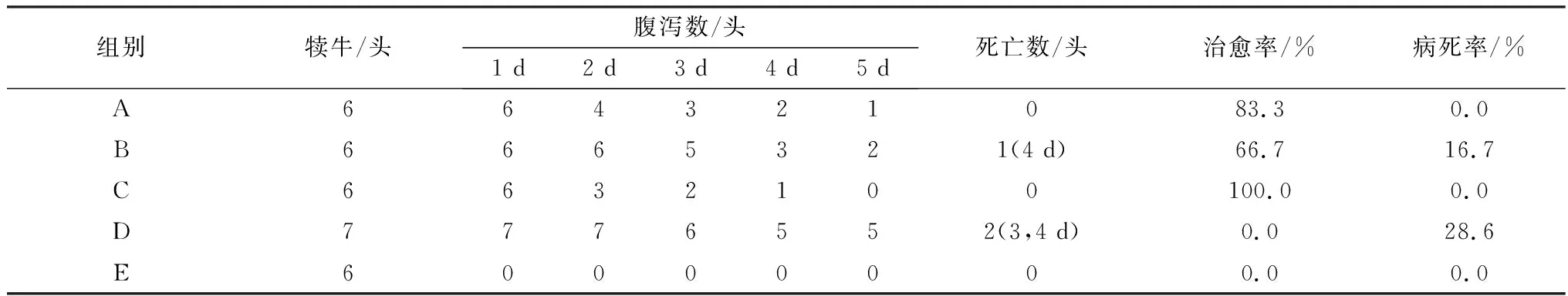
表6 抗生素与中药组方对犊牛腹泻大肠杆菌病的治疗效果
3 讨论
犊牛腹泻大肠杆菌病世界范围内广泛流行,造成了巨大的经济损失[3]。目前,国内、外治疗该病多以抗生素为主,但由此导致的耐药性问题日趋严重[4]。耐药性的产生不仅对临床治疗有很大影响,也给动物食品安全带来潜在风险,对养殖业的可持续发展带来极大危害[5]。致病性大肠杆菌是犊牛腹泻病不可忽视的重要病原[5-7]。不同地区致犊牛腹泻大肠杆菌的分离率不同。京津地区致犊牛腹泻大肠杆菌的分离率为61.7%[8],新疆地区的分离率为88%[9]。本试验中,犊牛腹泻大肠杆菌的分离率为69.4%,与以上两地区相比,分离率均在60%以上,说明这种疾病是犊牛多发病,在养殖生产中应予以高度重视。刘少昆[8]研究表明,37株大肠杆菌分离株中,有32株致小鼠死亡,致死率约为86%。高睿[10]研究表明,28株大肠杆菌分离株中,有22株使小鼠死亡,致死率约为79%,本试验分离的大肠杆菌对小鼠致死率为88%,与研究报道[8,10]结果相近。据报道,导致犊牛腹泻的大肠杆菌常见血清型为 O1、O2、O14、O15、O35、O75、O78、O86、O101、O137等,本试验共定型了O152、O157、O167、O100、O19和O39 6种血清型,其中O157和O152为优势血清型。此结果不同于郝彦龙等[11]报道的新疆地区的优势血清型,也与王姣姣等[12]报道的吉林省部分地区的优势血清型不同。这表明牛源大肠杆菌的血清型由于地域的不同存在着差异。
本试验中,25株分离菌对新霉素的敏感性最高,可以作为该地区防治该病的首选药物。吴同垒等[13]报道,河北省秦皇岛地区犊牛腹泻大肠杆菌携带的耐药基因主要是喹诺酮类的gyrB、oqxA、gyrA基因,检出率均在80%以上,四环素类tetC基因、氨基糖苷类aadA1、aac2 基因和磺胺类sul1基因检出率均超过了60%。张陆等[14]报道,黑龙江省哈尔滨地区犊牛源腹泻大肠杆菌耐药基因blaTEM、aadA1、tetA、tetB的检出率分别为84.6%,73.3%,69.2%,38.5%。而本研究中,此次分离的大肠杆菌全部携带ermB基因和tetB基因,对blaTEM、aaC2、aaC4、qnrB这4种耐药基因的检出率也比较高,分别为72%,64%,68%,60%。以上说明不同地区分离株的耐药基因存在明显差异,这可能与各地区用药习惯不同或者各地区致病性大肠杆菌的流行株不同有关。据报道,多数耐药基因与耐药表型是基本相符的[15]。分离株的药物敏感性试验与耐药基因检测结果进行对比,发现个别耐药基因与耐药表型存在符合率较低的现象,如未检测到四环素类tetA基因和磺胺类sul2基因,但药物敏感性试验中磺胺类复方新诺明和四环素类强力霉素的耐药性较高,这可能是四环素类耐药基因和磺胺类耐药基因有多种tet(A-M)和sul(1-3),存在其他耐药基因导致分离株对某些四环素或磺胺类药物耐药情况的产生[16];也可能是某些耐药基因与编码大肠杆菌的酶有关,进而影响药物的作用靶位[17],使大肠杆菌对一些抗生素产生潜在耐药性。由于大肠杆菌耐药机制较复杂,很多耐药基因未检测或耐药机制未被发现,具体原因还需进一步研究[18]。
治疗试验中,虽然选择的中药具有一定的清热解毒、抗菌消炎、凉血止痢的作用,可能中药的药效较缓和,导致单纯使用中药疗效不佳,有一定死亡率。单纯使用抗生素会造成胃肠内环境的损伤,所以疗效也不是特别理想。中药和抗生素联合使用,具有协同作用,克服了两者的缺点,所以取得了很好的治疗效果。
综上所述,针对河北省保定地区犊牛腹泻大肠杆菌病进行治疗时,建议各养殖场定期对致病性大肠杆菌首先进行药物敏感性监测,选择高敏的抗生素和中药进行联合治疗,使该病得到及时有效的控制。
