地鳖肽提取物对H2O2刺激C2C12细胞肌调节因子基因表达的影响
2022-07-25陈靖阳徐小艾
陈靖阳,徐小艾,王 婉,黄 山,沈 红,3*
(1.北京农学院 动物科学技术学院/动物类国家级实验教学示范中心,北京 102206;2.北京大学 口腔医学院 口腔医疗器械检验中心,北京 100081;3.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206)
骨骼肌卫星细胞(skeletal muscle satellite cells,SMSCs)是肌细胞膜和基膜之间的具有增殖和分化能力的干细胞,对于出生后动物骨骼肌的生长、再生修复和维持具有重要意义[1]。SMSCs在成年动物体内一般为静息状态,而在动物发育过程中肌肉组织受到一定刺激时细胞呈现活化状态,SMSCs分化成肌细胞,肌细胞融合成肌管最后形成成熟的肌纤维[2],达到肌纤维修复损伤[3-4]。在SMSCs细胞增殖分化融合过程中,参与肌纤维生长发育调控的生肌调节因子主要有生肌调节因子(myogenic regulatory factors,MRFs)基因家族、Pax(Paired box)基因家族和肌肉生成抑制因子基因(myostatin,MSTN)[5]。研究表明,过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator activated receptor γ coactivator 1α, PGC-1α)属于共激活转录因子家族成员,参与调控机体的能量代谢、骨骼肌生理等诸多骨骼肌相关生理过程[6]。机体受氧化应激刺激时产生大量活性氧(reactive oxygen species,ROS),超出机体抗氧化系统的清除能力,造成细胞及组织的损伤[7],影响骨骼肌的发育及损伤的修复。中药典籍中记载地鳖(Eupofyphagasinensis,ES)具有活血散瘀、接筋续骨、散结止痛等功效[8]。朴美子等[9]研究认为地鳖(ES peptide,ESP)能抑制小鼠体内脂质过氧化,清除自由基,激活抗氧化酶表达,具有明显的抗氧化作用。本研究以H2O2刺激C2C12细胞为模型,研究ESP对氧化应激状态下C2C12细胞增殖分化融合以及肌调节因子基因表达的影响,为开发ESP作为抗氧化剂应用于畜禽安全健康养殖提供依据。
1 材料与方法
1.1 实验材料胎牛血清(FBS)、0.25%胰蛋白酶购自Gibco公司,高糖DMEM培养基购自Sigma公司,肌细胞生成素(MyoG)抗体、羊抗鼠FITC-IgG购自武汉博士德生物科技有限公司,HiFi-MmlV cDNA第1链合成试剂盒购自江苏康为世纪生物科技有限公司,TB Green®Premix Ex TaqTM购自TaKaRa公司,所用引物由生工生物工程(上海)股份有限公司合成,马血清(HS)购自北京索莱宝生物科技有限公司公司;ESP参照文献[10]方法,由本实验室采用酶解及超滤法制备,通过层析法及Tricine-SDS-PAGE验证纯化得相对分子质量小于10 kDa的小肽;小鼠成肌细胞C2C12购自国家实验室细胞资源共享平台,由本实验室保存。
1.2 细胞培养及试验分组
1.2.1药物浓度选择 在培养基中加入适当浓度的H2O2可建立氧化应激模型,叔丁基对苯二酚(TBHQ)是抗氧化信号通路的强效诱导剂,可缓解细胞的氧化应激状态,利用400 μmol/L H2O2刺激8 h并给予1 μmol/L TBHQ可成功建立氧化应激及阳性对照C2C12细胞模型[11-14]。前期研究结果表明,给予H2O2刺激的细胞200 mg/L ESP可显著缓解细胞的氧化损伤,发挥对氧化应激细胞的保护作用[14-15]。
1.2.2细胞增殖培养 C2C12细胞于培养基(DMEM+10% FBS)中,培养细胞至85%左右,收集细胞并分组,即对照组、模型组(H2O2)、ESP组(H2O2+ESP)及阳性药物组(H2O2+TBHQ),ESP组细胞培养基添加ESP 200 mg/L,阳性药物组细胞培养基添加TBHQ 1 μmol/L,除对照组外所有组细胞在试验结束前8 h 培养基添加H2O2400 μmol/L处理细胞。
1.2.3细胞分化培养 C2C12细胞于培养基(DMEM+10% FBS)中,培养细胞至85%左右,收集细胞并分组,分组情况同1.2.1,将培养基换为分化培养基(DMEM+2% HS),试验结束前向培养基中添加ESP、H2O2等药物处理。
1.3 荧光定量PCR检测肌调节因子基因表达细胞分组培养,吸弃培养基并用PBS润洗细胞,TRIzol 法提取收集细胞总RNA,按照HiFi-MMLV cDNA Kit说明书操作进行反转录得第1链产物cDNA,查阅GenBank并设计相关引物(表1),具体按照TB Green®Premix Ex TaqTM说明书操作,采用20 μL体系:预变性95℃ 30 s,变性95℃ 5 s,退火/延伸54~59℃ 20 s,共40个循环。采用Step One Software v2.3软件分析数据,以GAPDH为内参,采用2-ΔΔCt法计算基因相对表达量。

表1 目的基因扩增引物信息
1.4 姬姆萨染色细胞及显微镜观察细胞分组处理, 4%多聚甲醛4℃固定细胞20 min,PBS漂洗,加姬姆萨染液30 min,弃去染色液,PBS漂洗后置于显微镜下观察细胞形态、拍照。按照公式计算肌管融合率(%)= 肌管细胞核数/总细胞核数×100% 。
1.5 免疫荧光检测MyoG蛋白表达细胞分组处理,4%多聚甲醛固定细胞30 min,PBS润洗,0.3% Triton X-100处理15 min,PBS漂洗,10%山羊血清封闭细胞1 h后加入MyoG一抗,4℃孵育过夜, PBST润洗,加FITC标记的二抗于37℃孵育1 h,PBST润洗后加DAPI复染细胞核5 min,PBST润洗后取出玻片并封片,显微镜观察、拍照。
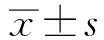
2 结果
2.1 ESP对H2O2刺激增殖C2C12细胞肌调节因子基因表达的影响采用RT-qPCR检测肌调节因子mRNA表达,结果如图1所示。与对照组相比,模型组C2C12细胞表达Pax7、Myf5和MyoD水平显著下调 (P<0.01);ESP组细胞内Pax7、Myf5和MyoDmRNA水平显著高于H2O2组(P<0.01),结果表明ESP能缓解H2O2对细胞增殖调节因子(Pax7、Myf5、MyoD)基因表达的抑制作用。
与对照组比较,** P<0.01;与模型组比较,+P<0.05,++ P<0.01
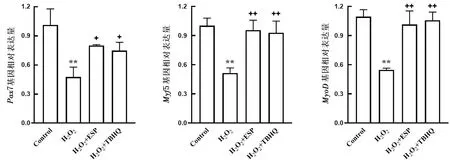
2.2 ESP对H2O2刺激分化C2C12细胞肌调节因子基因表达的影响RT-qPCR分析分化过程中肌调节因子(MyoD、Myf6、MyoG)mRNA表达水平,发现C2C12细胞增殖阶段(1~3 d)MyoDmRNA表达水平逐渐升高,进入细胞分化初期后逐渐下降,ESP组和阳性药物组细胞内MyoDmRNA水平明显高于H2O2组和对照组(P<0.01);随着细胞分化细胞内MyoGmRNA表达逐渐升高,在分化末期(5 d)达到峰值,H2O2组较对照组MyoGmRNA水平显著降低(P<0.01),但ESP组和阳性药物组MyoGmRNA水平均显著高于 H2O2组(P<0.01);Myf6 mRNA水平在细胞分化中期(5~7 d)逐渐升高,H2O2组Myf6 mRNA水平显著低于对照组 (P<0.01),ESP组和阳性药物组Myf6 mRNA水平显著高于H2O2组(P<0.01),结果表明,ESP可以提高细胞分化阶段肌分化调节因子(MyoD、MyoG、Myf6)mRNA表达水平(图2)。
与对照组比较,*P<0.05,** P<0.01;与模型组比较,+P<0.05,++ P<0.01
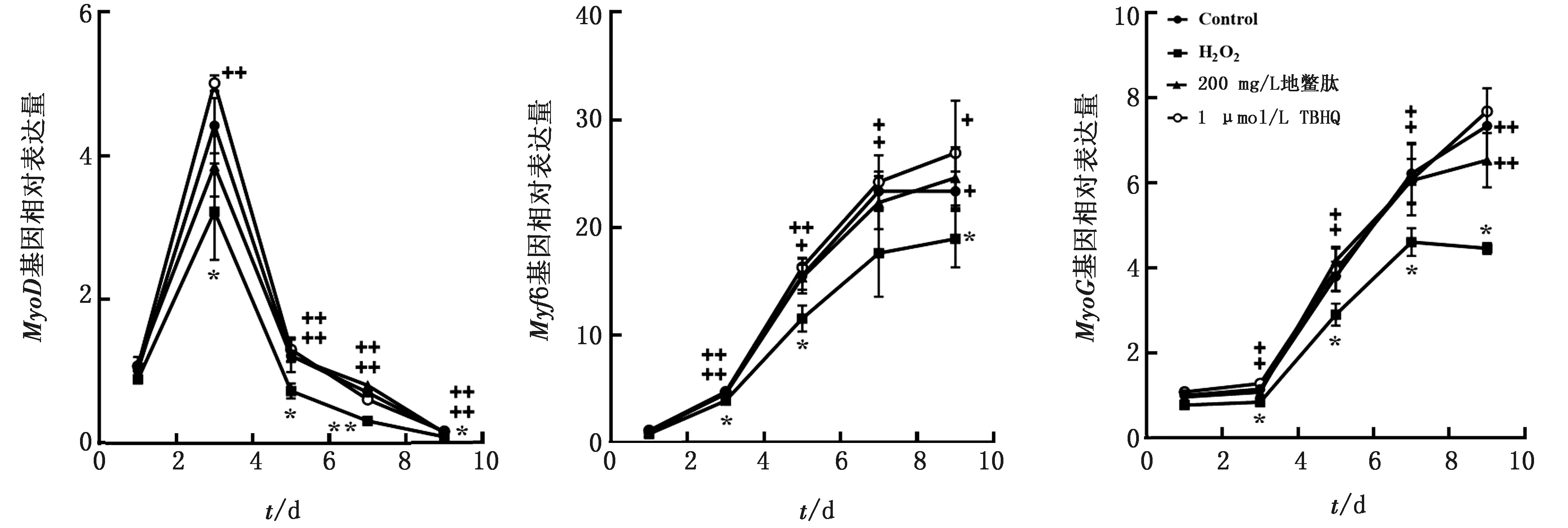
2.3 ESP对H2O2刺激分化C2C12细胞MyoG蛋白表达的影响MyoG为成肌调节因子家族的主要成员,是评价成肌分化状态以及肌管形成的重要指标。结果显示,在9 d时,对照组可见大量细胞表达MyoG蛋白且排列整齐有粗大多核肌管产生,约55% 阳性细胞表达MyoG,模型组表达MyoG蛋白细胞数明显减少且低于对照组,细胞多核肌管减少以及肌管细小,ESP组和阳性药物组表达MyoG蛋白细胞数提高到约50%,高于模型组,细胞多核肌管粗大,肌管数量增多(图3)。
A..表达MyoG细胞荧光图;B.表达MyoG细胞百分率;与对照组比较,** P<0.01;与模型比较,++ P<0.01
2.4 ESP对H2O2刺激分化C2C12细胞诱导分化形态的影响采用姬姆萨染色诱导分化的细胞,显微镜下可见C2C12细胞从典型成纤维状细胞逐渐分化融合成多核肌管。在9 d时显微镜观察ESP对细胞形态影响,结果对照组细胞可见大量粗大的多核肌管,且肌管排列整齐,肌管融合率细胞数在40%左右;与对照组相比,H2O2组细胞聚集成团,排列稀疏杂乱,仅有少量细小肌管形成,肌管融合细胞数降至约35%;与H2O2组相比,ESP和阳性药物组细胞聚集成团现象减少,粗大的多核肌管形成增多,细胞形态接近对照组,肌管融合细胞数增加至40%左右 (图4)。
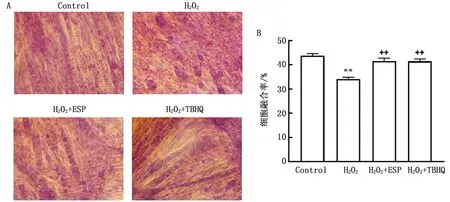
A..姬姆萨染色的细胞;B.细胞分化融合率;与对照组比较,** P<0.01;与模型组比较,++ P<0.01
3 讨论
肌肉组织是一种终末分化结构,自身不能形成新的骨骼肌纤维,肌肉的再生主要是由SMSCs来完成[16]。C2C12 细胞是小鼠骨骼肌卫星细胞经过永生化得来的细胞株[17],其具有良好的分化能力,成为研究肌细胞分化模型。有研究表明,2% HS可诱导C2C12细胞体外分化为成熟的肌细胞,7~9 d细胞分化达到终末阶段然后细胞逐渐凋亡[18]。SMSCs在骨骼肌受到直接创伤(如剧烈的体力活动、撕裂伤)或间接原因(如神经功能障碍或先天性遗传缺陷)后通过增殖和分化及融合形成新的肌管达到肌纤维修复及再生[19-20],肌纤维修复和再生过程受众多肌调节因子调控[5,21],如MRFs、Pax基因等,而肌调节因子的表达则受上游PGC-1α调控[22]。MRFs基因家族蛋白转录因子主要有MyoD、Myf6、MyoG和Myf5等,这些生肌调节因子主要调控骨骼肌正常生长发育、肌细胞增殖、成肌细胞转化以及肌纤维的形成[5,23]。Pax基因对肌细胞分化、更新、凋亡也起重要的调控作用[24]。Pax是一类高度保守的基因,其调控SMSCs的激活和迁移,SMSCs增殖过程中Pax7处于高表达状态,但随着骨骼肌分化Pax7表达下调[25]。在SMSCs肌源性分化过程中Pax7通过调节MyoD的表达实现诱导SMSCs的增殖和分化[26],Myf5和MyoD参与SMSCs的定型及其在SMSCs分化前表达,是SMSCs增殖的标志[27-28]。MyoD和Myf5是骨骼肌分化过程中最早表达的基因,它们几乎同步表达并共同激活骨骼肌的分化,SMSCs分化进入成肌状态时MyoD或Myf5基因表达上调[29],但骨骼肌细胞分化开始时MyoD表达量较低,此时MyoG与MHC表达量较高[30]。细胞内过量ROS可引起氧化应激的发生,导致肌细胞蛋白质降解、增加细胞死亡率、肌肉组织丧失功能等,影响骨骼肌的功能及再生能力,也导致诸多肌肉疾病[31]。本试验发现氧化应激状态下C2C12细胞增殖过程初期增殖因子Pax7、Myf5、MyoD基因表达显著下调,而ESP可以显著上调氧化应激SMSCs内各增殖因子的基因表达水平,表明ESP可通过参与调节增殖因子的基因表达增强氧化应激状态SMSCs的增殖能力。
MyoG是骨骼肌分化的早期标志物,在肌细胞融合形成肌纤维的过程中起着中心调节作用[32]。细胞分化初期MyoD高表达,随着细胞分化其表达逐渐下降,但随着SMSCs细胞分化至终末阶段,MyoG表达逐渐提高并促进肌管形成,增加分化细胞肌球蛋白重链(MyHC)等蛋白表达[33-34],此时MyoGmRNA表达逐渐升高直至细胞融合阶段,在细胞分化末期及融合过程中Myf6表达增加。随着MyoG基因表达量逐渐提高,SMSCs相互融合形成多核肌管,其中Myf6辅助MyoG在SMSCs的融合阶段发挥作用[33]。MyoD在细胞分化初期表达且是细胞进入分化阶段的标志物,小鼠肌肉发生过程中如阻遏Myf5和MyoD表达,小鼠无法生成骨骼肌[26,35]。王媛妹[36]采用胰高血糖素肽-1类似物利拉鲁肽处理C2C12细胞,结果C2C12细胞分化过程中细胞分化调节因子MyoD和Myosin表达量提高,结果表明利拉鲁肽可促进体外肌源性骨骼肌细胞分化。PGC-1α参与调控肌分化调节因子如MyoD的表达[22],诸多肽类物质如海参肽、神经肽等可通过激活PGC-1α促进氧化应激状态下肌细胞的生长[37-38]。本试验中ESP处理氧化应激状态下分化过程中的SMSCs时,肌分化调节因子MyoD、MyoG及Myf6基因表达明显下调,而ESP可以显著促进氧化应激状态C2C12细胞增殖因子表达上调,提示ESP能缓解氧化应激状态细胞分化抑制状态,进一步通过形态学观察也发现ESP可以明显促进SMSCs分化过程中肌管的形成,表明ESP可以通过参与调节分化融合因子的基因表达促进氧化应激状态下SMSCs分化为成熟的肌管,其机制可能与PGC-1α的激活相关。
综上所述,体外诱导C2C12细胞分化肌细胞,在氧化应激状态C2C12细胞肌调节因子表达下调抑制SMSCs增殖分化及融合,而ESP通过上调肌调节因子(Pax7、Myf5、MyoD、MyoG、Myf6)基因表达促进SMSCs增殖分化融合成多核肌管,其机制可能与上游PGC-1α的激活相关,表明ESP有望开发成抗氧化剂应用于禽类养殖促进其生长发育。
