广西地区隐球菌感染的临床特征、菌种鉴定及体外抗真菌药物敏感性
2022-07-19郑冬燕曹存巍李秀楹郑艳青潘开素廖万清
郑冬燕 曹存巍李秀楹 郑艳青 潘开素廖万清
(1. 广西医科大学第一附属医院皮肤性病科,南宁 530021; 2. 广西卫生健康委员会广西真菌研究与真菌病防治重点实验室,南宁 530021; 3. 南宁市第四人民医院,南宁 530023); 4. 上海长征医院皮肤性病与真菌病研究所,上海 200003
隐球菌病是一种常见的机会性侵袭性真菌感染,主要分为新生隐球菌(血清型A、AD和D)和格特隐球菌(血清型B和C)[1]。新生隐球菌主要见于免疫功能低下患者,而格特隐球菌在健康人群中更为常见[2]。尽管随着高活性抗逆转录病毒疗法(highly active antiretroviral therapy,HAART)在治疗艾滋病领域的引入,隐球菌病的发病率有所下降,但免疫功能低下的个体仍然存在感染高风险和高死亡率[3-4]。新生隐球菌和格特隐球菌在基因上是相互关联的,然而,它们在地理分布、自然栖息地、宿主传染性和致病性方面存在差异[5]。新生隐球菌在全球分布,而格特隐球菌在北美和澳大利亚更为常见[6]。此外,格特隐球菌的治疗比新生隐球菌似乎更加困难[7]。中国是世界上人口最多的国家,拥有大片潮湿的热带和亚热带地区,植被丰富,这种气候有利于真菌的生长和传播。此外,在过去几十年中,中国免疫功能低下人群的数量逐年增加,导致隐球菌病等侵袭性真菌感染的发病率随之增加,这对公共卫生造成了沉重负担[8]。而且,由于临床表现的多样性,隐球菌病很容易被误诊,导致患者不能得到及时正确地治疗。因此,早期诊断、及时有效地治疗对本病的预后起着重要作用。
已有研究者对新生隐球菌和我国的格特隐球菌进行了大量研究[9-12]。然而,在我国广西,对致病性隐球菌种类及其对抗真菌治疗的敏感性的研究相对较少。广西位于亚热带地区,气候温暖湿润,隐球菌病常见,可能存在严重漏报的现象。并且随着新的抗真菌药物的引入,抗真菌药敏谱需要研究和更新。因此,本研究旨在对广西地区隐球菌感染的患者临床特征、菌种鉴定和体外药物敏感性进行详细分析。
1 材料和方法
1.1 资料来源
收集2014年5月至2018年5月来自南宁市第四人民医院、广西医科大学第一附属医院及广西壮族自治区人民医院的隐球菌属临床分离株及临床资料,剔除患者临床资料不足的菌株。
1.2 菌株的复苏和鉴定
将103株隐球菌在Sabouraud葡萄糖琼脂(SDA)培养基27℃下培养48~72 h后,转种于L-甘氨酸溴麝香草酚蓝(CGB)培养基上培养3~7 d,以此鉴别新生隐球菌和格特隐球菌[13]。为了确保菌株的生长和纯度,采用条纹划板法进行了三次连续纯化。
1.3 隐球菌蛋白的提取
将约5 mg菌体添加到含有300 μL蒸馏水的Ep管中混匀后加入900 μL无水乙醇,12 000 r/min离心2 min。弃上清液后,再次以12 000 r/min离心2 min,然后将Ep管置于室温下干燥。加入50 μL 70%甲酸和50 μL乙腈,以12 000 r/min的速度离心2 min。最后将上清液转移到新Ep管中使用。
1.4 基质辅助激光解吸电离飞行时间质谱鉴定
取1 μL上述备用的上清液滴加在质谱仪靶板的靶点上,再取1 μL基质溶液覆盖样品,基质溶液由50%乙腈-2.5%三氟乙酸中的α-氰基-4-羟基肉桂酸饱和溶液组成,并在分析前再次风干。对于每个样品,在自动采集模式下,产生了质量-电荷范围为2 200~22 000 Da的光谱,平均240次激光发射。当获得较差的光谱(1 000个任意单位以上的10个定义明确的峰少于10个)时,在蛋白质提取过程中通过额外的洗涤步骤重复分析,从而提高光谱质量。使用MALDI Biotyper 3.0数据库比较数据并记录质谱鉴定结果。根据使用手册,鉴定分值≥1.70表示识别正确;鉴定分值<1.70表示识别不正确或无法识别[14]。
1.5 DNA提取及分子鉴定
随机选择20株隐球菌提取DNA进行测序。将菌株于27℃ SDA培养基上培养5 d,按照江苏康威世纪生物科技有限公司Q19生产的真菌基因组DNA提取试剂盒的操作步骤进行DNA提取。使用引物ITS1:5’-TCCGTAGGTGAGTGCGG-3’;ITS4:5’- TCCTCCGCT1TATTGATATGC -3’对核糖体RNA(rRNA)内部转录间隔区(rITS)进行扩增。PCR 反应的条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,重复35个循环;72℃再延伸10 min;4℃保存。将PCR产物送至广州金科生物科技有限公司进行双向测序。将测序好的碱基序列上传至NCBI基因库数据库和CBS数据库进行比对。
1.6 抗真菌药敏试验
根据CLSI推荐的M27-A4方案进行体外抗真菌药敏试验。测定了氟康唑(FLC)、两性霉素B(AmB)、5-氟胞嘧啶(5-FC)、伊曲康唑(ITC)、伏立康唑(VOC)、泊沙康唑(POS)和艾沙康唑(ISA)的最小抑制浓度(MIC)值。使得FLC的最终药物浓度范围为0.125~64 μg/mL,AmB和5-FC的最终浓度范围为0.00156~8 μg/mL,ITC、VOC、POS和ISA的最终浓度范围分别为0.0020~1 μg/mL。在RPMI 1640培养基中,通过比浊仪将细胞浓度调整至1×103~5×103/mL。96孔板在37℃下孵育接种72 h后读取分析结果。使用近平滑念珠菌 ATCC22019菌悬液作为质控菌株。
1.7 体外抗真菌药敏结果
根据CLSI M27-A4文件,AmB的MIC定义为与无药物对照组对比,100%生长抑制所对应的最低药物浓度,而其他抗真菌药物的MIC定义为50%生长抑制的最低浓度(≥50%)。MIC50和MIC90分别为能够抑制50%和90%的菌株生长所对应的抗真菌药物浓度[15]。FLC的对隐球菌的折点如下:敏感(S)≤8 μg/mL,剂量依赖性耐药(SDD)16~32 μg/mL和耐药(R)≥64 μg/mL;5-FC则分别为:≤ 4 μg/mL(S)、8~16 μg/mL(SDD)和≥32 μg/mL(R);ITC为:≤0.125 μg/mL(S)、0.25~0.5 μg/mL(SDD)和≥1 μg/mL(R);VOR的MIC≤1 μg/mL为敏感[5,16-17]。由于目前对于隐球菌尚无POS、ISA和AmB的折点,因此参考了念珠菌属的数据[18-19]。已有研究显示,新生隐球菌grubii变种的ECVs(epidemi ological cut-off values)分别:FLC 为8.0 μg/mL,AmB为1.0 μg/mL,5-FC为4 μg/mL,ITC为0.125 μg/mL,VOR为1.0 μg/mL,POS为0.5 μg/mL,ISA为0.25 μg/mL。格特隐球菌为FLC 8 μg/mL,5-FC 4 μg/mL,AmB、ITC、VOR和POS均为0.5 μg/mL,ISA 0.25 μg/mL[20-22]。所有菌株药敏试验均在不同时间重复3次,以获得最佳结果。
1.8 统计分析
使用SPSS 17.0(美国伊利诺伊州芝加哥市SPSS公司)进行统计分析,其中P<0.05为差异具有统计学意义。
2 结 果
2.1 菌种和临床资料的收集
本研究共包括来自86名患者的103株菌株(见表1)。其中男性59名,女性27名。年龄分布范围为21~84岁。在86名患者中,14名为HIV阳性,72名为HIV阴性。有55人无基础疾病,21例次患有肝病,7例次患有糖尿病,4例次患有系统性红斑狼疮(SLE),1例次有免疫抑制治疗史,3例次患有肝癌,1例次患有类风湿性关节炎。所有86名患者来自我国广西壮族自治区的13个不同城市(见图1)。在103株菌株中,17株为系列菌株(即同时从同一患者的不同部位或在不同时间从同一部位培养出的菌株)。共有91株来自脑脊液标本,7株来自肺组织,3株来自肺泡灌洗,2株来自皮肤组织。
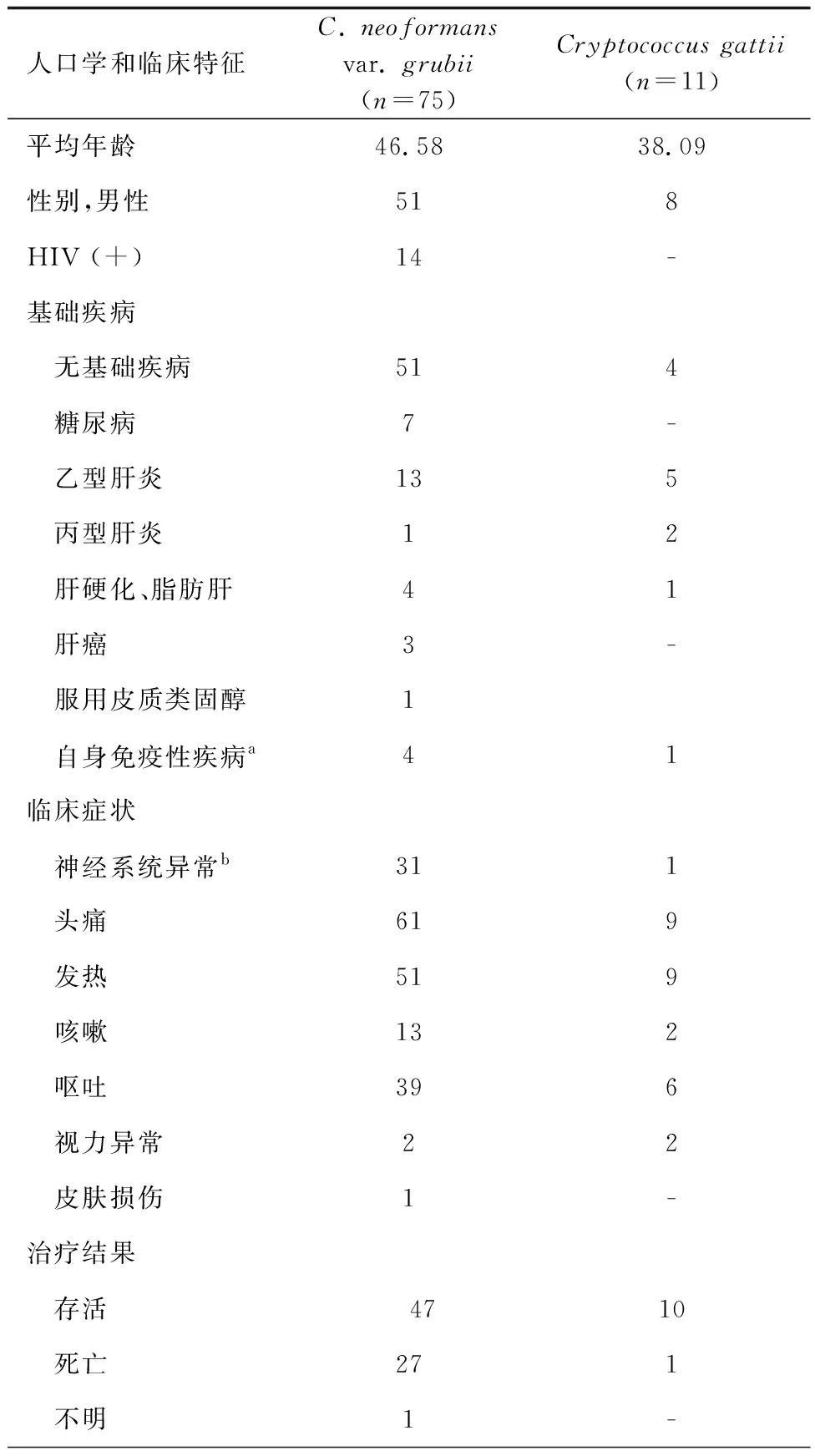
表1 86例隐球菌病患者的人口学和临床特征Tab.1 Demographic and clinical characteristics of 86 patients with cryptococcosis

(续表)
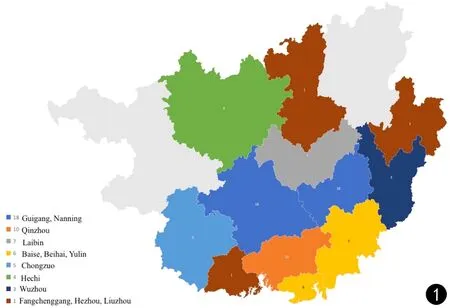
图1 广西隐球菌病患者的地理分布Fig.1 Geographical distribution of patients with cryptococcosis in Guangxi
2.2 菌株鉴定
结合CGB培养基、分子鉴定及MALDI-TOF MS技术鉴定结果,11株菌株被鉴定为格特隐球菌,92株经鉴定为新生隐球菌。在本课题组的前期研究中,使用多位点序列分型(MLST)技术对11株格特隐球菌及其基因型进行了详细分析,发现5个菌株被鉴定为VGI型,6个被鉴定为VGII型[23]。
2.3 体外药敏试验结果
所有菌株对7种抗真菌药物均敏感,MIC、MIC50和MIC90值如表2所示。92株新生隐球菌grubii变种对7种抗真菌药的MIC值分别如下:FLC 0.05~4 μg/mL,AmB 0.25~1 μg/mL,5-FC 0.0625~2 μg/mL,ITC 0.0625~0.25 μg/mL,VOR 0.0078~0.25 μg/mL,POS 0.0313~0.5 μg/mL,ISA 0.0020~0.125 μg/mL。所有92株新生隐球菌grubii变种对FLC、AmB、VOC、POS和ISA均敏感。其中91株(98.91%)对5-FC敏感,1株(1.09%)呈剂量依赖性敏感,85.87%(79/92)的菌株对ITC敏感,其余14.13%(13/92)菌株对ITC的呈剂量依赖性敏感。
格特隐球菌和新生隐球菌grubii变种类似,未发现耐药的菌株(见表 2)。 但值得注意的是,我们发现其中有一株格特隐球菌的MIC 值高于 FLC 的 ECVs。
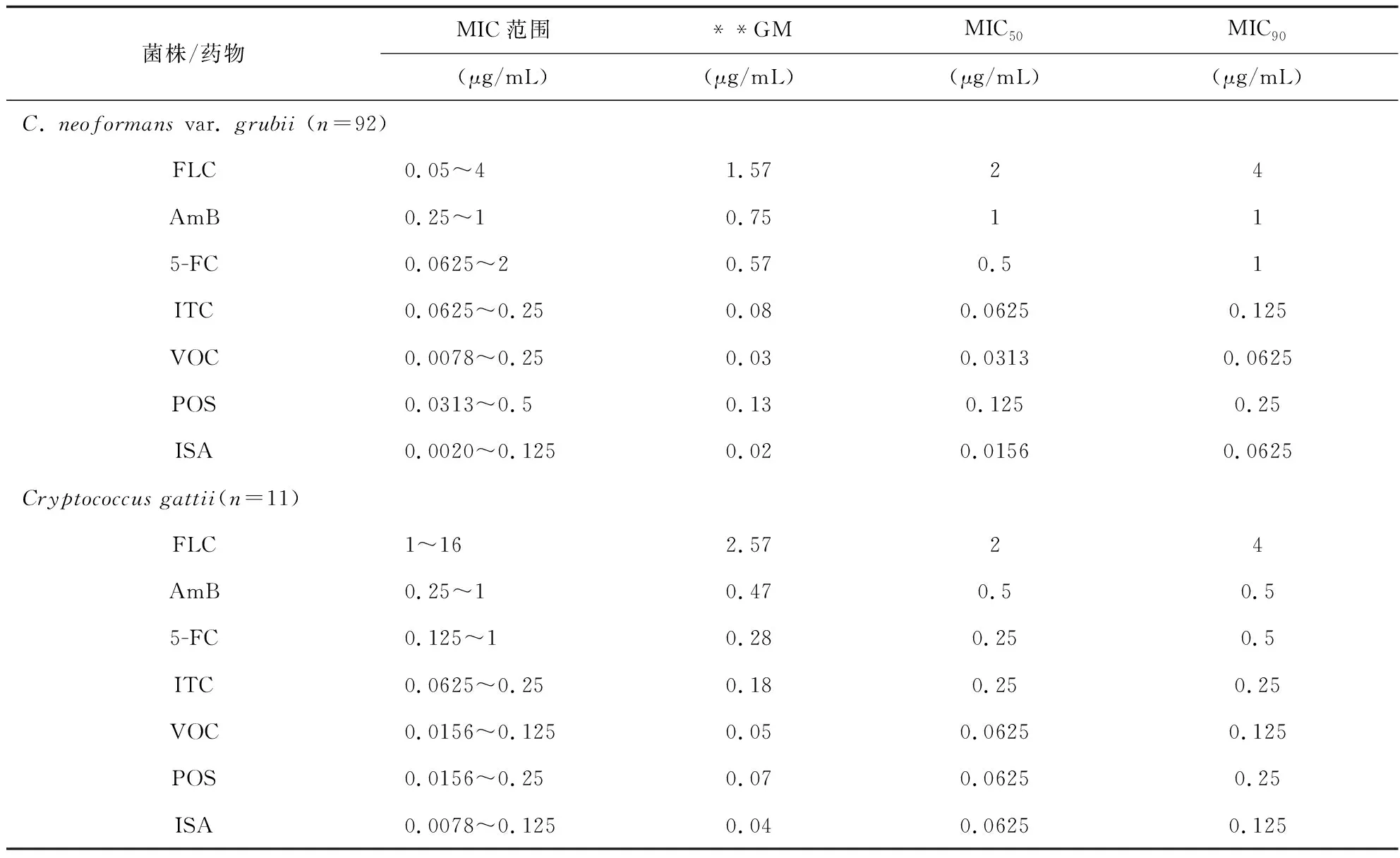
表2 抗真菌药物对103株隐球菌分离株的MIC范围、GM、MIC50和MIC90值
3 讨 论
本研究对广西地区隐球菌的流行病学、菌种鉴定和体外抗真菌药物敏感性进行了详细地分析。研究发现,在广西地区的大规模人口中,由新生隐球菌引起的隐球菌病的患病率高于格特隐球菌引起的隐球菌病,与国内既往报道一致[8,24-25]。在本研究的75例新生隐球菌患者中,HIV阳性患者占18.7%,68%患者无基础疾病,与中国其他地区的报道类似,但却与美国、非洲和欧洲报告的HIV相关隐球菌病病例相反[26-27]。研究还发现新生隐球菌grubii变种是广西的主要致病菌株[24]。
近年来,MALDI-TOF MS已成为微生物鉴定和诊断的快速、准确而且经济有效的新方法[28],可MIC50和MIC90:能够分别抑制50%和90%菌株生长的浓度;**GM:几何平均数;FLC,氟康唑;AmB, 两性霉素B;5-FC,5-氟胞嘧啶;ITC,伊曲康唑;VOC,伏立康唑;POS:泊沙康唑;ISA:艾沙康唑。
以取代一些传统的鉴定方法,从而提高临床的诊治水平。此外,MALDI-TOF MS可以鉴定致病真菌的种类来进一步预测耐药性[14]。既往研究表明MALDITOF MS可以100%将隐球菌准确鉴定到属的水平[29-30]。在本次研究中,我们的结果也显示MALDI-TOF MS方法与DNA测序的结果一致性为100%。
本次体外抗真菌药物敏感性结果发现:新生隐球菌和格特隐球菌对两性霉素B敏感(MIC 0.25~1 μg/mL)。这与Nascimento的报告相一致。然而,也有文献报道了因MIC值较大而导致临床治疗失败的例子[31]。
有研究发现,体外药敏试验FLC对新生隐球菌的MIC值较低[32]。然而,也有报道新生隐球菌有较高的MIC50和MIC90值(4~8 μg/mL和2~128 μg/mL)[15]。在本研究中,氟康唑的MIC50和MIC90值分别为2 μg/mL和4 μg/mL,均未发现耐药现象。文献报道氟康唑对格特隐球菌的 MIC 值很高(≥64 μg/mL)[32-33]。在与本研究相比,我们检测到的MIC值≤16 μg/mL。这一观察结果引起了人们对耐药性的关注,并表明 FLC 单独用于治疗时可能会失去其效力。
新的唑类药物(伏立康唑、泊沙康唑和艾沙康唑)对所有新生隐球菌及格特隐球菌均有较好的抗真菌活性,MIC均小于0.5 μg/mL,这与Pfaller等的报告一致。在本次研究中,伊曲康唑对大部分隐球菌表现出较高的活性,MIC≤0.25,与Herkert等[34]的报告相似甚至更低;然而,有13株新生隐球菌(14.13%)对伊曲康唑呈剂量依赖性。同样,来自塞尔维亚的新生隐球菌菌株也曾报道对伊曲康唑具有剂量依赖性敏感[35]。不过,由于伊曲康唑不易透过血脑屏障,所以在治疗隐球菌性脑膜炎时很少作为单一药物使用。
大量研究表明,5-FC 对新生隐球菌和格特隐球菌的MIC值≤64 μg/mL[35-36]。 在本研究中,除了一株新生隐球菌 (1.09%) 对 5-FC 呈剂量依赖性敏感,其余所有菌株都对5-FC敏感,MIC值≤2 μg/mL。
在本次研究中,新生隐球菌与格特隐球菌(格特隐球菌为VG Ⅰ型和VG Ⅱ型两种类型)对7种抗真菌药物的敏感性之间差异没有统计学意义。根据CLSI M27-A4标准,本研究中除了其中一株可能对 FLC 产生耐药的菌株,需要进行进一步研究以确认它是否为非野生型,其余大多数菌株都是野生型。
综上所述,隐球菌病是一种复杂的疾病,但由于隐球菌病的临床表现缺乏特异性,在诊断上极其容易误诊。新生隐球菌grubii变种是广西最优势的菌株。 MALDI-TOF MS是一种快速可靠的鉴定隐球菌属的方法。所有分离株均对常用抗真菌药物无耐药性,对新型三唑类药物高度敏感。抗真菌药敏试验有助于早期发现耐药菌株,对及时有效地治疗隐球菌病具有重要意义。
