微进化对阿萨希毛孢子菌感染宿主的影响
2022-07-19彭卓颖廖勇巴根杨鑫张骞宇杨蓉娅
彭卓颖 廖勇 巴根 杨鑫 张骞宇 杨蓉娅
(中国人民解放军总医院第七医学中心皮肤科,北京 100700)
微进化(microevolution)指的是种内或近缘物种之间的进化,当病原菌引起宿主组织损伤的同时,宿主也会对菌株的基因型及表型产生压力选择,病原菌可以通过微进化快速适应这种压力[1]。阿萨希毛孢子菌(T.asahii)属于机会性致病真菌,可定植于人体的皮肤、呼吸道黏膜和胃肠道等部位[2]。本课题组曾于2000年发现1名病史长达24年的慢性播散性毛孢子菌感染患者,并分离到阿萨希毛孢子菌原代菌株TO[3],该患者后期的抗真菌药物治疗效果不佳,皮损迁延不愈,14年后在其皮损处再次分离到菌株,经基因序列对比确认为阿萨希毛孢子菌,命名为TEVO。目前围绕病原真菌微进化与宿主免疫相互作用的研究多集中于体外实验[4-5],无法有效进行微进化与天然免疫识别等方面的研究。因此,本研究主要利用微进化前后的阿萨希毛孢子菌建立小鼠系统性感染模型,旨在明确微进化对菌株感染宿主能力以及机体免疫等方面的影响。
1 材料与方法
1.1 材料
实验菌株 微进化株TEVO来源于2014年患者复诊时的颈部皮损,现保存于中国人民解放军总医院第七医学中心皮肤科实验室,菌藏号:BM1403。阿萨希毛孢子菌原代株TO来源于2000年患者首诊时的面部皮损,冻存于中国科学院微生物研究所,菌藏号:AS2.2174。基因测序结果显示,阿萨希毛孢子菌TEVO和TO的rRNA大亚基D1/D2区域碱基序列与标准株(CBS2479)完全相同。
实验动物 Balb/c近交系雄性小鼠30只,周龄5周,平均体重为20 g,购于北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2016-0006)。
主要试剂 TaqMan©Gene Expression Master Mix购于Life technologiesTM,PCR引物与探针均合成于InvitrogenTM公司,(1,3)-Beta-D-Glucan Detection Reagent Kit购于GLUCATELL©,PE/Cy7 anti-mouse CD3 antibody、PE anti-mouse CD8a antibody、FITC anti-mouse CD4 antibody购于Biolegend,Cyclophosphamide购于MedChem Express。
1.2 方法
菌株复苏与菌落形态观察 将冻存于-80℃的TEVO和TO复温,取一定量菌液接种于10 mL YPD培养基中,置于35℃摇床中培养至产生大量孢子。分别取适量菌液接种到PDA固体培养基中,放于35℃孵箱中培养,每天观察菌落形态变化。
菌株光学形态与电镜形态观察 将PDA培养基中的菌落挑取适量,用无菌生理盐水配成1×108个/mL菌悬液,各取1 μL菌悬液用乳酸酚棉蓝染色,随后用光学显微镜进行观察。将挑取的TEVO和TO菌落用固定液固定4 h,用PBS溶液洗3次后浸泡于1%锇酸溶液,2 d后分别用50%、75%、95%和100%的乙醇各脱水10 min,然后在醋酸异戊酯中置换20 min,最后在扫描电镜下进行观察。
小鼠感染模型的构建 将小鼠进行随机分组,TEVO组、TO组与对照组各10只小鼠,每只小鼠腹腔注射200 mg/kg环磷酰胺,免疫抑制3 d后,实验组分别于小鼠尾静脉注射5×107CFU/mL对应菌悬液0.3 mL;对照组小鼠尾静脉注射0.3 mL生理盐水。分别于感染D3和D6将每组随机选取5只小鼠进行眼球取血与组织解剖。将所得血浆进行葡聚糖检测;将所获取的组织做成组织匀浆,一部分用SYBR Green荧光染料进行荧光定量PCR检测组织载量[6],另一部分进行MPO检测;其中脾脏留取部分新鲜组织进行研磨,将所得脾细胞进行流式检测分析。
统计学方法 利用GraphPad Prism 5软件进行图表制作及统计学分析,实验数据以均数±标准差表示,P<0.05则表明差异具有统计学意义。
2 结 果
2.1 TEVO与TO的形态差异比较
TEVO菌落为较干燥的乳白色圆形菌落,其菌落边缘较光滑,表面皱褶细小呈绒毛样(见图1A);TO菌落同样较干燥,呈乳白色圆形,但其边缘较毛糙,表面皱褶粗大呈脑回样(见图1B)。光镜和电镜下观察发现,TEVO菌株基本为孢子形态,仅可观察到少量菌丝(见图1C、E),而TO以菌丝形态为主,仅存在少量关节孢子(见图1D、F)。
2.2 感染小鼠脏器载量结果分析
本实验利用荧光定量PCR的方法检测感染小鼠各组织中TEVO和TO的相对基因表达量。内参基因选取的是GAPDH,最终通过△△Ct法对样本之间目的基因的表达差异进行比较分析。从图2中可以发现TEVO组小鼠各器官检测到的载量均低于TO组,其中肝脏和脾脏中两者的差异最显著;第6天所得脑组织中目的基因的相对表达量均高于第3天获取的脑组织,而在其余脏器中这种趋势则相反,其中心脏和肺两个组织中第6天所检测到的目的基因的相对表达量明显低于第3天。
2.3 小鼠血浆 (1,3)-β-D-葡聚糖检测
D3和D6解剖的健康对照组小鼠血浆(1,3)-β-D-葡聚糖浓度平均值均小于20 pg/mL,呈阴性。D3解剖的TEVO和TO组小鼠血浆(1,3)-β-D-葡聚糖浓度分别为(33.32±0.33)pg/mL和(37.99±1.37)pg/mL,从图3统计图中可看出两者具有统计学差异(P= 0.0424);D6解剖的小鼠血浆中葡聚糖浓度分别为(31.21±0.64)pg/mL和(34.43±0.71)pg/ml,TEVO组浓度同样低于TO组,差异同样具有统计学意义(P= 0.0415)。
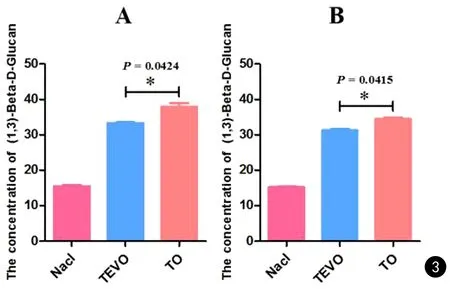
图3 小鼠血浆葡聚糖检测分析. A、B. D3和D6解剖小鼠所获取血清的葡聚糖检测结果,根据检测试剂盒推荐界值,浓度大于20 pg/mL为阳性,否则为阴性Fig.3 Detection the (1,3)-β-D-glucan of mice plasma. A、B. The glucan test results of mice serum obtained in D3 and D6 according to the recommended cut-off value of the test kit, when the concentration above 20 pg/mL is deemed to positive, otherwise it is negative
2.4 小鼠组织髓过氧化物酶(MPO)检测
将获取的不同组小鼠组织进行MPO检测,具体检测数据可见表1,观察表中数据可以发现在各组小鼠组织中脑部髓过氧化物酶的分泌均明显低于其它器官。从图4统计图中可以看出,D3和D6两次解剖所获取组织中TEVO组分泌的MPO均明显低于TO组相应的器官,而且D6检测到的MPO的量较D3均有不同程度的上升。

图4 小鼠各组织MPO检测分析。将D3和D6所解剖小鼠组织制成匀浆,其中脑组织制成10%匀浆,其余组织制成5%匀浆,然后利用MPO试剂盒对其进行相关检测Fig.4 The results of MPO in mice tissues. The mice tissues acquired in D3 and D6 were made into homogenate, the brains were made into 10% homogenate, and others were made into 5% homogenate, then use the MPO kit to test

表1 不同组小鼠各组织MPO检测结果(U/克组织湿重)
2.5 脾脏细胞流式细胞术结果分析
D3解剖的对照组小鼠脾脏细胞中CD4+T细胞所占比例为(33.35±1.34)%,而TEVO组与TO组则分别降至(19.20±0.42)%和(16.10±0.42)%;同样,对照组小鼠脾脏细胞中CD8+T细胞所占比例为(10.10±0.42)%,TEVO组与TO组分别降至(7.71±0.04)%和(6.60±0.16)%。
D6解剖的TEVO和TO的CD4+T细胞与CD8+T细胞与D3相比均有不同程度的上升,但仍均低于正常对照组(见图5)。

图5 小鼠脾脏细胞流式检测. A. 流式检测结果图,横坐标代表CD3抗体、纵坐标分别代表CD4或CD8抗体,第一象限结果代表CD3+CD4+T细胞或者CD3+CD8+T细胞; B. 各组小鼠脾脏流式结果统计图Fig.5 Analysing mice spleen cells by Flow cytometry. The abscissa in Fig.5A represent CD3 antibody and the ordinate represent CD4 or CD8 antibody, respectively. The first quadrant represent CD3+CD4+T cells or CD3+CD8+T cells. Fig.5B is the statistical graph of spleen cells
3 讨 论
病原真菌微进化研究的关键问题是寻找合适的研究模型。慢性感染过程中抗真菌药物的使用和宿主内环境等方面因素都为菌株的微进化提供了动力[5],而大多数真菌感染病例都是急性或亚急性发病,没有经过长期的宿主免疫和抗真菌药物的压力性选择,即使有慢性感染病例也因难以进行长期的跟踪随访,而未能获取微进化菌株。本课题组在同一慢性患者身上所获取的两株阿萨希毛孢子菌的时间间隔长达14年,是真菌微进化研究中无法替代的理想模型。本课题组既往研究发现微进化后的TEVO可通过改变胞外分泌酶谱、降低部分毒力以及增强耐药性等方式适应宿主内环境,这给菌株与宿主长期共存创造了良好的条件[7]。但T.asahii侵入机体后能否致病不仅与其毒力等因素有关,同样与机体自身的免疫防御状态有关,目前报道的播散性毛孢子菌病多是继发于白血病或恶性肿瘤等疾病[8]。
本研究发现在微进化过程中,T.asahii从以菌丝为主的生长形态转变为以孢子形态为主,这与白念珠菌形态特征的变化较相似[4,9]。菌丝和关节孢子是构成生物膜的主要结构,而生物膜不仅与T.asahii的毒力和耐药机制有关,还与宿主的免疫逃逸机制密切相关[10-11]。因此我们进一步研究了微进化前后菌株对宿主的感染能力以及宿主免疫系统对这两株菌的防御和杀伤作用之间的差异。
首先通过对小鼠组织匀浆进行荧光定量PCR检测发现,不同脏器中TEVO组目的基因的相对表达量均显著低于TO组,说明TEVO菌株感染的小鼠器官中的菌量明显低于TO组小鼠;而且TEVO组小鼠血浆(1,3)-β-D-葡聚糖的浓度同样低于TO组,其中(1,3)-β-D-葡聚糖是真菌细胞壁的主要成分,当真菌被巨噬细胞吞噬后会将其释放入血液循环,(1,3)-β-D-葡聚糖的浓度与感染真菌的数量呈正相关,也就是说其浓度越高说明感染的菌量越多[12]。以上两个实验结果可以充分说明微进化后的菌株TEVO对小鼠的侵袭力明显低于TO菌株。结合微进化前后菌株形态的变化考虑,当TO进化为TEVO之后,菌丝形成减少,使其生物膜的功能严重受损,最终造成TEVO对宿主的侵袭力降低。
随后本研究对微进化与宿主免疫之间的相互作用方面做了进一步探索,主要研究了固有免疫和适应性免疫两方面内容。在固有免疫方面发挥重要作用的是吞噬细胞,吞噬细胞的MPO氧化系统在宿主防御以及杀灭真菌方面起着十分重要的作用[13]。本实验中TEVO组小鼠各器官分泌的MPO均明显低于TO组,此结果说明当菌株感染小鼠后,小鼠机体对TEVO菌株的防御以及杀伤反应比对TO菌株的反应要弱很多。本课题组既往研究发现微进化菌株TEVO与原代株TO相比分泌蛋白酶的活性明显降低,而且不能分泌磷脂酶[7],其中蛋白酶主要是降解对维持机体生理功能有重要作用的蛋白,磷脂酶则会破坏细胞膜,导致脂质释放[14-16]。同样有观点认为新生隐球菌在人类感染过程中发生的微进化有利于菌株在宿主体内发生免疫逃逸,从而导致持续性的感染,这主要与菌株表型的变化有关[17]。因此考虑两株T.asahii菌株感染小鼠后,固有免疫反应的差异应该与菌株表型的变化密切相关,但具体机制有待进一步研究。
与固有免疫的研究结果不同,TEVO组和TO组小鼠脾脏中CD4+T细胞和CD8+T细胞与对照组相比均出现明显降低。由于对照组同样注射了环磷酰胺,因此排除了免疫抑制造成的影响;而且通过对实验结果进行统计发现,TEVO组的CD4+T细胞和CD8+T细胞均高于TO实验组,结合本研究中MPO的结果分析,脾脏中T细胞的降低可能是因为感染前期固有免疫细胞数量增加,造成T细胞所占比例出现降低,这也说明在T.asahii感染初期主要通过固有免疫对菌株发挥防御和杀伤作用。同样有研究表明,在阿萨希毛孢子菌感染小鼠初期调节性T细胞的比例并未发生明显变化,在感染后期调节性T细胞的比例才会逐渐增加[18]。调节性T细胞在发挥免疫抑制作用的同时也会减弱机体清除病原菌的能力,为T.asahii的存活提供了有利条件,这与其分泌的细胞因子IL-10和TGF-β1有一定关系[19-20]。因此在后续的适应性免疫研究中有必要延长菌株对小鼠的感染时间,并且进一步研究T细胞分型以及相关细胞因子在微进化菌株感染过程中的具体作用机制。
综上所述,微进化后的阿萨希毛孢子菌TEVO的形态发生较大变化,由以菌丝生长状态为主转变为以孢子状态为主,且TEVO菌株对小鼠的感染能力以及机体对TEVO的防御和杀灭作用均降低,这与微进化后菌株表型的变化密切相关。微进化带来的改变为TEVO的存活提供了有利条件,促使其与宿主形成长期共存状态。本研究结果为阿萨希毛孢子菌微进化的后续研究指明了方向,后期深入的分子学机制等方面的研究也将为临床治疗提供新思路。
