基于生物信息学分析胶质母细胞瘤中RUNX1基因的表达及临床意义*
2022-07-19陈亚伦
陈亚伦,宋 彦
(南阳市第二人民医院神经内科,河南 南阳 473012)
胶质母细胞瘤(GBM)也称为多形性成胶质细胞瘤,其生长迅速、侵袭性强,是成人最常见的恶性脑肿瘤。与其他固体肿瘤不同,GBM能够广泛地侵犯周围脑组织而很少发生转移[1]。目前,GBM的标准治疗包括外科手术切除和替莫唑胺联合放射治疗。但是,经过标准治疗的肿瘤患者,病情仍然会进一步发展,导致患者的中位生存期和无疾病进展期明显缩短,分别仅为16、7个月,其5年生存率不超过9.8%[2-4]。另外,GBM发生的分子机制仍然不是很清楚。因此,深入研究GBM恶性生长与侵袭的分子机制,对于研发新的治疗方法和药物,以及改善GBM患者的生存预后具有重要意义。
本研究通过对GBM相关的三组基因芯片数据进行分析,发现了关键的促癌基因 Runt相关转录因子1(RUNX1)。RUNX1是RUNX转录因子家族的成员,主要参与细胞的增殖和分化等过程[5]。已有研究表明,RUNX1在多种人类肿瘤中异常表达,比如乳腺癌、前列腺癌和肺癌等,在肿瘤的发生、发展中起着重要作用[6-8]。但是,RUNX1在GBM中的作用仍少有报道,因此,本研究通过生物信息数据库挖掘的方法,寻找GBM的潜在预后指标或分子标志物,并初步分析了RUNX1的表达与GBM发生的关系及作用机制,以期能够为GBM的治疗提供新的理论依据。
1 材料与方法
1.1材料来源 检索GEO数据库中GBM基因芯片。通过GEO数据库(https://www.ncbi.nlm.nih.gov/)进行检索和筛选[9],得到GBM相关的基因芯片GSE50161、GSE108476和GSE15824。它们均来源于相同的平台GPL570 ([HG-U133_Plus_2] Affymetrix Human Genome U133 Plus 2.0 Array)。GSE50161含34例肿瘤组织和13例正常组织。GSE108476含221例肿瘤组织和28例正常组织。GSE15824含12例肿瘤组织和2例正常组织。三组芯片共含有GBM组织样本267例和正常对照组织样本43例。
1.2方法
1.2.1筛选差异表达的基因和绘制文恩图 使用GEO数据库中的GEO2R工具进行分析,分为GBM组和正常对照组进行比较。下载并整理GEO2R的所有结果数据。两组间基因表达差异2倍以上(logFC>2或logFC<-2)且差异有统计学意义(P<0.05),认为是基因差异表达显著。使用文恩图在线分析软件(Venny2.1.0)分析三组芯片的上调和下调差异基因,同时取交集,筛选出共同的差异表达基因。
1.2.2GBM和正常组织中差异基因的表达及生存预后分析 通过TCGA数据库分析工具:GEPIA在线工具分析差异基因在GBM和正常组织中的表达、生存预后及相关性表达。基因表达谱交互分析(GEPIA)数据库是整合了TCGA 癌症大数据与 GTEx 正常组织大数据,利用生物信息学技术深入挖掘相关数据,并对基因表达谱数据进行动态分析的TCGA可视化工具[10]。通过检索目的差异基因,选择GBM组织进行分析,可获得目的基因的表达情况、生存预后及基因相关性分析。
1.2.3目的基因的转录因子分析 JASPAR数据库(http://jaspar.genereg.net/)是一种高质量,非冗余转录因子数据库,涵盖了源于已经实验证实的真核生物转录因子结合位点等信息[11]。通过分析RUNX1转录因子结合的序列特征及补体调节因子I(CFⅠ)基因的启动子序列特征,检测RUNX1与CFⅠ之间是否存在转录调控关系。
1.2.4单细胞测序数据分析 肿瘤免疫单细胞中心(TISCH)是一个专注于肿瘤微环境(TME)的scRNA-seq数据库(http://tisch.comp-genomics.org/home/),其对单细胞水平提供了详细的细胞类型注释,使不同癌症类型的TME得以探索[12]。通过TISCH数据库,选择GBM进行分析,在单细胞层面检测RUNX1在GBM微环境中的表达情况。
1.2.5蛋白相互作用网络分析 GeneMANIA (http://genemania.org/)是构建蛋白相互作用网络工具Cytoscape中的插件,具有预测基因的功能和构建相互作用网络的功能[13]。输入RUNX1基因,获得RUNX1的相互作用蛋白,并选择KEGG pathway输出其参与的信号通路。
1.2.6细胞培养 GBMU87MG细胞株采用含10%胎牛血清的高糖培养基(DMEM)进行培养,细胞培养箱的条件为温度37℃、5%浓度CO2。于细胞增殖对数期进行换液处理。
1.2.7荧光定量PCR实验(RT-qPCR) 根据说明书,使用Trizol试剂提取细胞的总RNA,分光光度计检测RNA的纯度和浓度,参照逆转录试剂盒,反转RNA为cDNA。然后进行实时RT-PCR扩增。每个样本设置3个复孔,扩增反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,共进行40个循环。计算反应c(t)值及目的基因的相对表达量。每次实验进行3次重复。引物序列如下:GAPDH上游5′-TGC CAC TCA GAA GAC TGT GG-3′,下游5′- TTC AGC TCT GGG ATG ACC TT;CTNNB1上游5′-GAA AAT GGT TGC CTT GCT-3′,下游5′-GAT GAG CTT GCT TTC TTG G-3′;MYC上游5′-GCC AGA GGA GGA ACG AG-3′,下游5′-GCT TGG ACG GAC AGG AT-3′;CD44上游5′- CAA GCC ACT CCA GGA CAA GG -3′,下游5′- ATC CAA GTG AGG GAC TAC AAC AG -3′。GAPDH为内参。
1.2.8siRNA转染干扰RUNX1的表达 在细胞生长汇合度达到40%左右时,进行siRNA的转染操作。使用无血清培养基分别预混siRNA和转染试剂Lipofectamine 2000,然后将siRNA和Lipofectamine 2000进行混匀,室温静置5 min后,加入细胞培养基中转染细胞,8 h后更换新鲜培养基,24 h后进行细胞RNA的提取和干扰效率检测。RUNX1 siRNA序列为:5′-CCA GGU UGC AAG AUU UAA UTT-3′。
1.2.9细胞增殖实验 收集处理后的细胞,计数细胞浓度,调整细胞悬液的浓度为每100微升500个细胞,每组细胞样品每天设置3个重复,96孔板中加入100 μL的细胞悬液,放于细胞孵育箱中培养。每天固定时间点进行检测,加入10 μL的CCK-8试剂,于细胞孵育箱中孵育2 h。于酶标仪中测量450 nm处的吸光度值(A),连续测量5 d并绘制细胞增殖曲线。
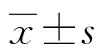
2 结 果
2.1分析并筛选GBM和正常脑组织中的差异基因 分析GEO数据库中GSE50161、GSE108476和GSE15824三组GBM相关的基因芯片数据,并下载相关的表达数据。选取差异倍数2倍以上,且差异有统计学意义(P<0.05)的基因为差异基因。通过GEO2R的在线分析工具,筛选得到三组基因芯片的差异基因。在GSE50161芯片中筛选得到差异基因共2 117个,上调的差异基因有876个,下调的有1 241个;在GSE108476芯片中共得到差异基因1 393个,上调的差异基因有445个,下调的有948个;在GSE15824芯片中发现差异基因共1 152个,上调的差异基因有564个,下调的有588个。通过维恩图工具(Venn)对三组芯片的差异基因取交集,结果得到共表达的差异基因20个,其中8个基因表达上调:TMEM39A、PXDN、PRRX1、RUNX1、TGIF2、CFⅠ、AJUBA和LAMA4;12个基因表达下调:SLC6A15、CLCN4、CHN2、OR2L1、ENPP2、RGS11、ANKS1B、KIAA1107、PDE1A、SPNS2、ATP8A1和ANKRD29。
2.2TCGA数据库分析差异基因在GBM中的表达 通过TCGA数据分析工具GEPIA,在163例GBM组织和207例正常对照组织中,分析上调的差异基因表达情况。结果发现,TMEM39A、PXDN、PRRX1、RUNX1、TGIF2、CFⅠ、AJUBA和LAMA4这8个基因在GBM组织中的表达明显高于正常组织,差异均有统计学意义(P<0.05)。见图1。
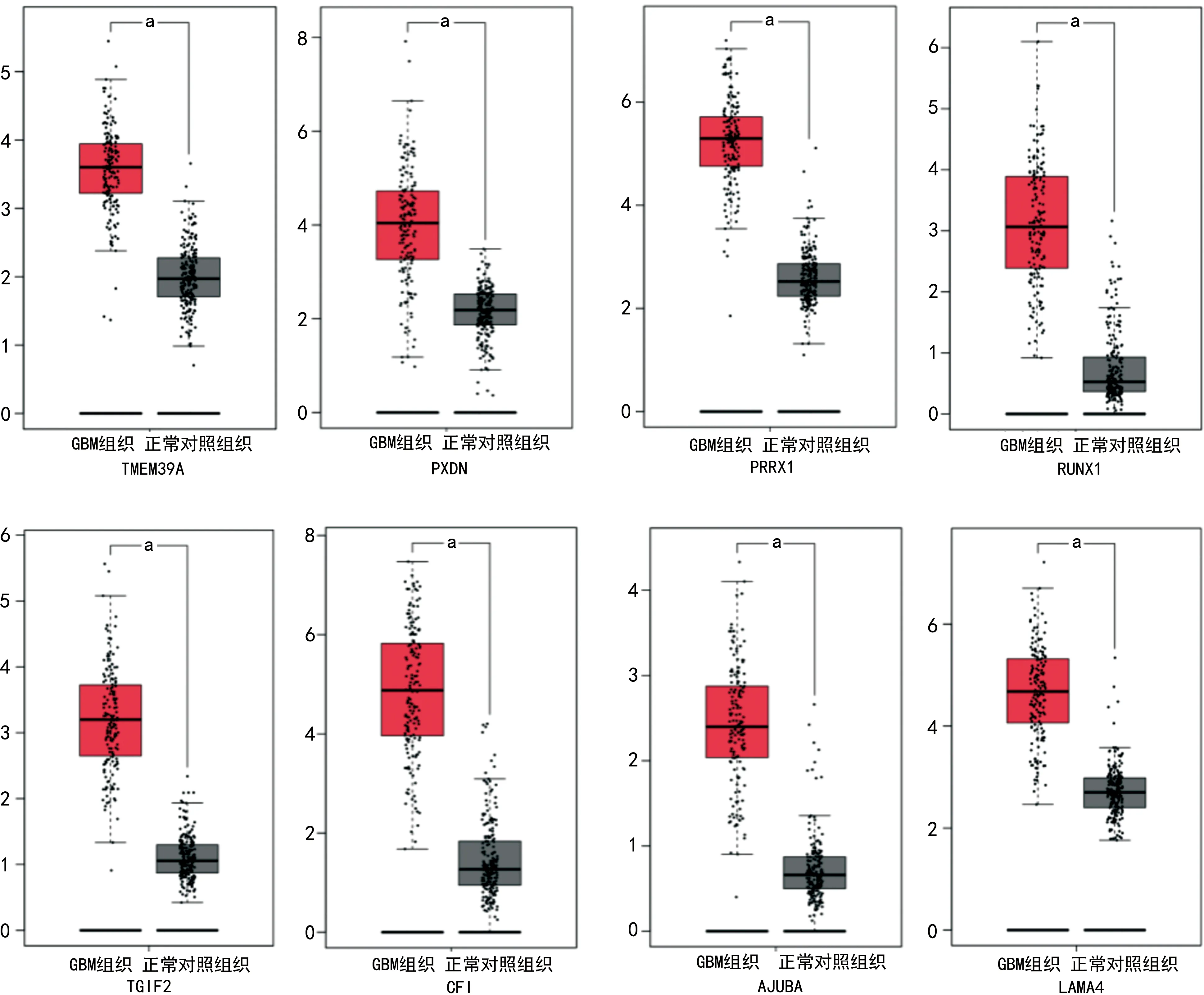
与正常对照组织比较,aP<0.05。
2.3基因RUNX1和CFⅠ表达对GBM患者临床预后的影响 通过GEPIA数据库进一步分析这些差异基因的表达与患者预后的关系,结果发现,8个上调的差异基因中,只有RUNXI和CFⅠ基因对肿瘤患者的生存预后有显著相关性[相关系数(r)=0.6,P<0.05],即RUNX1和CFⅠ高表达的肿瘤患者总生存期和无疾病进展期比低表达的患者明显缩短,差异均有统计学意义(P<0.05),见图2。这些结果提示RUNX1和CFⅠ高表达预示GBM患者的临床预后较差。
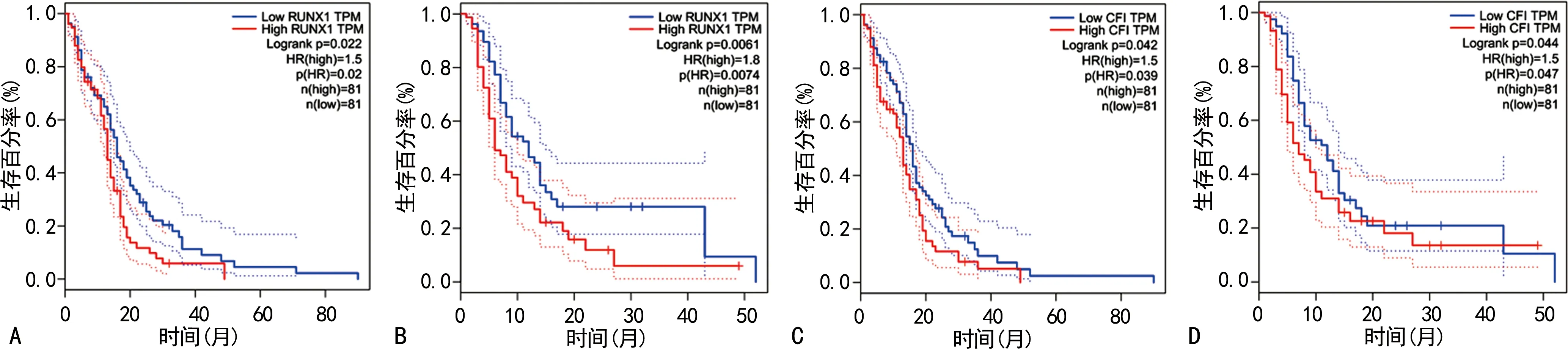
A.GBM患者总生存期(RUNX1基因);B.GBM患者无疾病进展期(RUNX1基因);C.GBM患者总生存期(CFⅠ基因);B.GBM患者无疾病进展期(CFⅠ基因)。
2.4RUNX1可能在转录水平上影响CFⅠ基因的表达 通过JASPAR转录因子分析数据库分析发现,CFⅠ基因中具有RUNX1结合的位点(图3A)。另外,通过分析TISCH单细胞测序数据库,可见RUNX1在免疫细胞及肿瘤细胞中均呈高表达(图3B)。这些结果表明,RUNX1可能通过转录调节CFⅠ的表达进而影响免疫反应,促进肿瘤的进展。

A.转录因子RUNX1结合的核苷酸位点,以及JASPAR结果显示CFⅠ基因中RUNX1可以结合的核酸位点;B.GSE131928,GSE141982和GSE84465的单细胞测序芯片中,RUNX在免疫细胞、肿瘤细胞、基质细胞中的表达水平。
2.5RUNX1参与调节的信号通路网络 通过GeneMANIA蛋白相互作用网络数据库及KEGG pathway进一步分析RUNX1参与调节的生物学过程。结果显示,RUNX1能够与细胞分裂蛋白激酶6(CDK6)、癌基因MYC、癌基因CBFB等20种蛋白存在相互作用,主要参与的生物学过程有:调节细胞的增殖和分化、DNA绑定、补体级联反应、细胞黏附和NOD样受体信号通路等。
2.6RUNX1调节Wnt信号通路促进GBM的增殖 鉴于RUNX1参与调节肿瘤细胞的增殖,以及上述相互作用网络分析得到了其相互作用的蛋白。本研究初步分析了其可能调控的增殖的相关信号通路。通过TCGA数据分析,发现RUNX1与Wnt信号通路的核心蛋白β-catenin具有明显的正相关性(r=0.21,P<0.05),且RUNX1与Wnt信号的下游靶基因CD44和MYC也具有显著的正相关性(r=0.43,P<0.05;r=0.22,P<0.05)。为了进一步验证RUNX1是否参与Wnt信号通路的调节,本研究在GBM细胞中敲低RUNX1,RT-qPCR结果显示RUNX1被干扰后,Wnt通路的下游分子β-catenin(基因名CTNNB1)及下游靶基因MYC和CD44 的mRNA水平也明显下调(图4A)。另外,通过CCK-8细胞增殖实验发现,RUNX1下调明显抑制了肿瘤细胞的增殖(图4B)。这些结果表明,RUNX1可能通过调节Wnt/β-catenin信号促进GBM的进展。
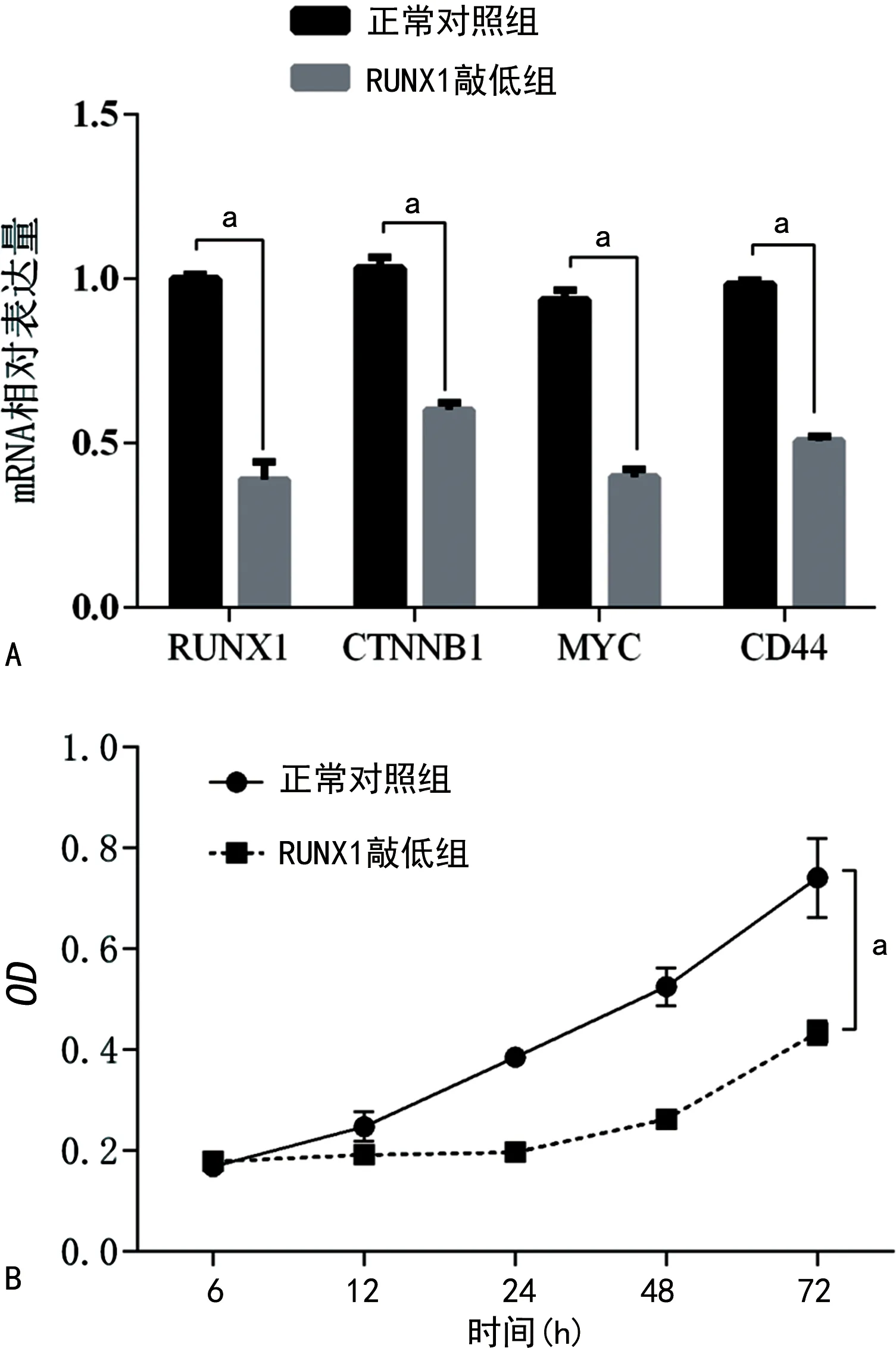
A.敲低RUNX1对CTNNB1、MYC和CD44的mRNA表达影响;B.CCK-8实验检测敲低RUNX1对细胞增殖的影响;与正常对照组比较,aP<0.05。
3 讨 论
GBM是胶质瘤中恶性程度最高的类型,尽管GBM的发病率约为3.19/10万人,但是由于其复杂的生物学特征和有限的治疗方法,致使其临床预后极差[14]。即使经过手术或者放射治疗,这种肿瘤仍会侵犯周围正常的脑组织,导致病情的进展或复发[15]。因此,亟须深入研究GBM的发病机制,这对于制定有效的治疗策略和改善患者预后具有非常重要的临床意义。在肿瘤的发生、发展过程中,基因表达上调发挥着促进肿瘤的作用,因此在临床上更有利于检测和诊断肿瘤。鉴于此,本研究主要分析GBM中上调的差异表达基因。
近年来,基因组分析和高通量测序技术的进展,使得学者们能够更全面和深入地理解GBM的发病机制,并鉴定潜在的GBM预后和治疗的新靶点。本研究通过对三组GBM基因芯片(包含267例肿瘤组织和43例正常脑组织)进行分析,发现在GBM中异常高表达的基因RUNX1和CFⅠ。RUNX1是一种十分重要的转录因子,其在细胞增殖、细胞分化和造血细胞的形成中具有重要的调控作用。其最早是在髓系白血病中被发现,发挥抑癌的作用[16]。但是,新的研究发现RUNX1也具有促进白血病细胞增殖的作用[17]。由此可见,RUNX1在不同类型的血液系统肿瘤中具有不同的功能。在不同的实体肿瘤中,RUNX1也表现出功能的组织异质性。例如,RUNX1在肝癌中的表达明显低于癌旁组织,且肝癌组织中RUNX1存在较高的突变,这提示RUNX1在肝癌的发生过程中起着抑癌的作用[18]。而在非小细胞肺癌中,有研究发现RUNX1在肺癌组织中呈高表达,且能够增强肿瘤细胞的化疗耐药[19]。另一基因CFⅠ是补体系统的重要调节因子,主要通过丝氨酸蛋白酶的功能裂解C4b和C3b,从而调剂补体系统的激活。当补体激活后,具有生物活性的肽C5a和C3a可诱导多种促炎症效应,从而促进肿瘤发生、发展[20]。已有研究表明,CFⅠ在多种人类肿瘤中具有重要作用,比如皮肤鳞状细胞癌、卵巢癌、胃癌和乳腺癌等[21-23]。在乳腺癌的研究中,发现CFⅠ在乳腺癌组织中显著高表达,且CFⅠ在肿瘤细胞、浸润的免疫细胞和成纤维细胞中均有表达。进一步分析发现,CFⅠ的高表达与肿瘤的大小和病理分级具有显著相关性,且其高表达与乳腺癌患者生存期和无疾病进展期的缩短呈正相关[24]。
CFⅠ基因编码的蛋白为补体因子Ⅰ,主要参与补体系统的级联反应和免疫反应[25]。而RUNX1是RUNX转录因子家族中非常重要的成员,其能够与许多增强子或启动子的核心元素结合,从而调节下游靶基因的转录和表达[26]。本研究通过TCGA数据库分析,发现RUNX1和CFⅠ在GBM中的表达均异常升高,且它们的高表达预示着GBM患者的不良预后。那么RUNX1作为转录因子是否可能调控CFⅠ的表达?考虑到RUNX1是一重要的转录因子,且RUNX1与CFⅠ的表达具有显著的相关性。通过转录因子的数据库分析发现,RUNX1能够与CFⅠ的启动子区域结合,表明RUNX1可能在转录水平调控CFⅠ的表达。另外,结合最新的单细胞测序数据分析,发现RUNX1在肿瘤细胞及免疫细胞中均呈高表达。据此,可以推测RUNX1在肿瘤细胞及免疫细胞中均发挥着重要的调控作用。考虑到CFⅠ主要参与免疫反应的调节,而RUNX1又能够调节CFⅠ的表达。由这些证据可以推测,RUNX1在免疫细胞中可能通过转录上调CFⅠ的表达,抑制补体系统的激活和免疫反应,从而有助于GBM的进展。而在肿瘤细胞中的具体作用机制,通过蛋白相互作用网络及KEGG Pathway分析,初步揭示了RUNX1调节GBM增殖的潜在分子机制。癌基因MYC是一种涉及细胞增殖和分化的关键因子,受到Wnt/β-catenin信号通路的调控[27]。本研究发现,RUNX1可能通过调节Wnt/β-catenin信号,上调β-catenin的表达及促进癌基因MYC和CD44的表达,进而促进肿瘤细胞的增殖。Wnt/β-catenin信号在调节干细胞的多能性、器官发生及肿瘤发生过程中具有重要的作用。当Wnt信号激活时,升高的β-catenin进入细胞核,与细胞核内T细胞因子/淋巴增强因子(LEF/TCF)转录因子结合,调节下游靶基因c-MYC、CD44、MMP7等的表达,从而参与细胞增殖、侵袭和肿瘤进程的调节[28-29]。
综上所述,本研究通过挖掘高通量的生物信息数据,发现了GBM中具有潜在临床预后价值的标志物RUNX1和CFⅠ,并初步探索了RUNX1发挥作用的可能机制,即RUNX1在免疫细胞中可能通过转录调节上调CFⅠ的表达,抑制补体反应,从而使肿瘤细胞逃脱免疫监视;另一方面,RUNX1在肿瘤细胞中可能通过激活Wnt/β-catenin信号促进肿瘤的恶性增殖和侵袭。这些研究结果为深入理解GBM的发生机制提供了更全面的认识,也为GBM的治疗措施提供新的理论参考。但本研究也存在一定的不足,比如细胞及动物实验方面的证据不够充足。在后续的研究中,应进一步深入基础和临床的研究,以充分阐明RUNX1在GBM中的作用和分子机制。
