胃癌、结直肠癌患者凝血和纤溶标志物水平变化
2022-07-16陈文欣薛赢俊邵华卿胡晓波
陈文欣,薛赢俊,李 贞,杨 洁,邵华卿,胡晓波
(1.上海中医药大学附属龙华医院检验科,上海 200023;2.上海市临床检验中心,上海 200126)
胃肠道肿瘤是最常见的恶性肿瘤,发病率和死亡率均较高,患者出现症状就医时,疾病已进入中、晚期[1]。肿瘤生长可激活凝血过程并产生促凝物质,促凝物质又会诱发炎症反应,进一步刺激肿瘤细胞产生促凝物质。有研究发现,肺、胰腺、胃肠道、妇科恶性肿瘤患者更易出现高凝状态,其凝血及纤溶标志物水平升高与患者生存期呈负相关[2]。本研究拟分析胃癌、结直肠癌患者血管内皮损伤及凝血、纤溶系统变化,为减少此类患者血栓事件发生提供参考。
1 材料和方法
1.1 研究对象
选取2019年3—6月上海中医药大学附属龙华医院胃癌患者129例(胃癌组),其中男95例、女34例,年龄38~80岁;结直肠癌患者118例(结直肠癌组),其中男68例、女50例,年龄25~88岁。根据有无转移将患者分为转移组和未转移组,129例胃癌患者中,发生转移67例,118例结直肠癌患者中,发生转移53例。另选取同期上海中医药大学附属龙华医院健康体检者77名(健康对照组),其中男40名、女37名,年龄40~94岁。本研究经过上海中医药大学附属龙华医院伦理委员会审核通过。
排除标准:(1)年龄<18岁;(2)6个月内发生静脉或动脉血栓;(3)正在进行抗凝治疗、化疗或败血症患者;(4)有其他部位原发性肿瘤。所有研究对象近期均无感染性疾病、手术及外伤史 。
1.2 样本采集
采集所有研究对象静脉血,枸橼酸钠抗凝,1 500×g离心15 min,分离血浆,保存于-80 ℃冰箱待检。
1.3 仪器和试剂
采用HISCL-800全自动化学发光免疫分析仪(日本Sysmex公司)及配套试剂(化学发光酶免疫法)检测血栓调节蛋白(thrombomodulin,TM)、凝血酶-抗凝血酶复合物(thrombinantithrombin complex,TAT)、纤溶酶-α2抗纤溶酶复合物(plasmin-alpha2-plasmin inhibitor complex,PIC)、组织型纤溶酶原激活剂-纤溶酶原激活物抑制剂-1复合物(tissue plasminogen activator-plasminogen activator inhibitor-1 complex,t-PAI-C)。采用CS-5100自动血凝分析仪(日本Sysmex公司)及配套试剂检测凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、 D-二聚体(D-dimer,DD)、纤维蛋白(原)降解产物 [fibrin (fibrinogen)degradation product,FDP]、纤维蛋白原(fibrinogen,Fib)、抗凝血酶(antithrombin,AT)、凝血酶时间(thrombin time,TT)。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析。呈偏态分布的数据采用中位数(M)[四分位数(P25,P75)]表示,组间比较采用单因素方差分析。以P<0.01为差异有统计学意义。
2 结果
2.1 胃癌组、结直肠癌组、健康对照组各项指标比较
胃癌组TM、TAT、PIC、FDP、Fib、DD高于健康对照组(P<0.01),AT、PT、APTT低于健康对照组(P<0.01);结直肠癌组TAT、PIC、t-PAI-C、FDP、Fib、DD高于健康对照组(P<0.01),AT、APTT、PT低于健康对照组(P<0.01)。见表1。
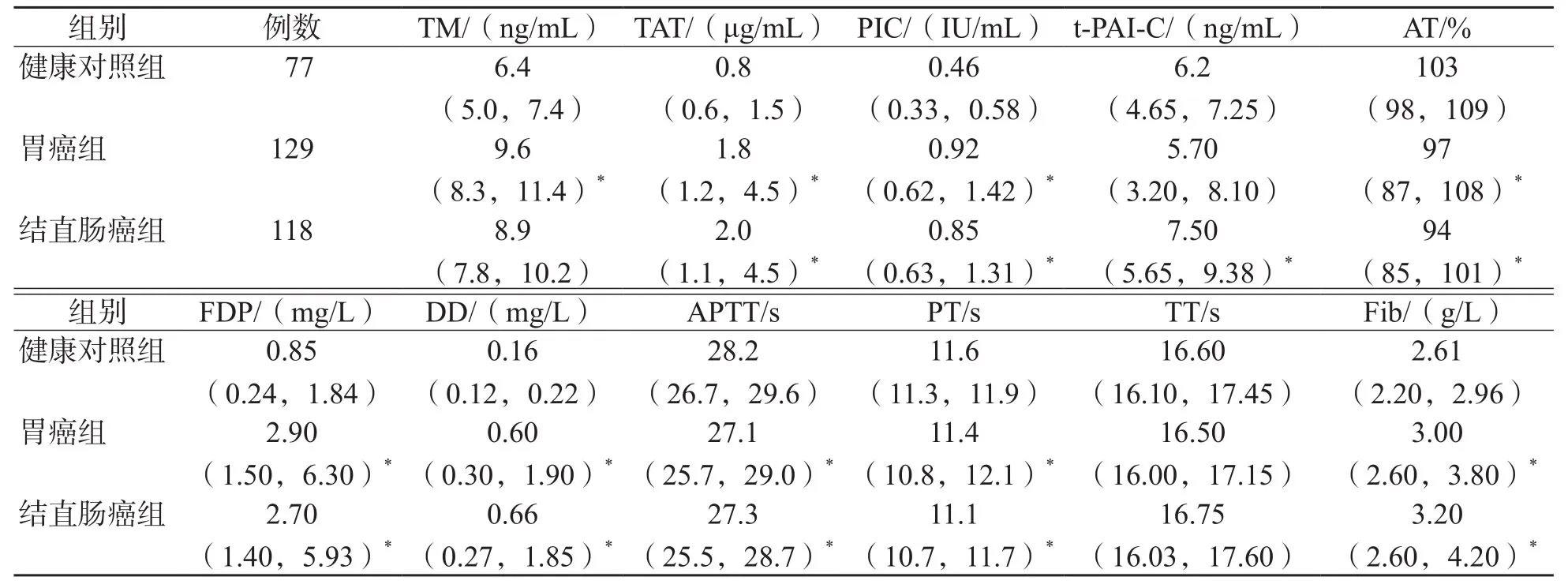
表1 胃癌组、结直肠癌组、健康对照组各项指标比较
2.2 转移组和未转移组各项指标比较
胃癌患者中,转移组TM、TAT、PIC、AT、DD、FDP、Fib高于未转移组(P<0.01),APTT低于未转移组(P<0.01),见表2;结直肠癌患者中,转移组TAT、PIC、t-PAI-C、FDP、Fib、DD高于未转移组(P<0.01),见表3。
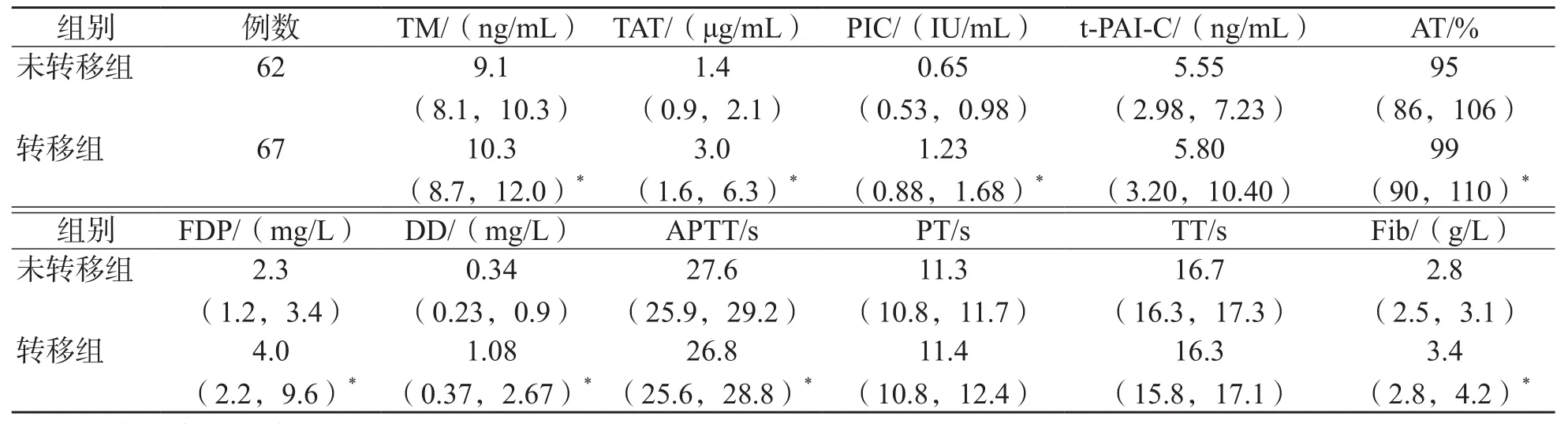
表2 胃癌患者转移组与非转移组各项指标比较
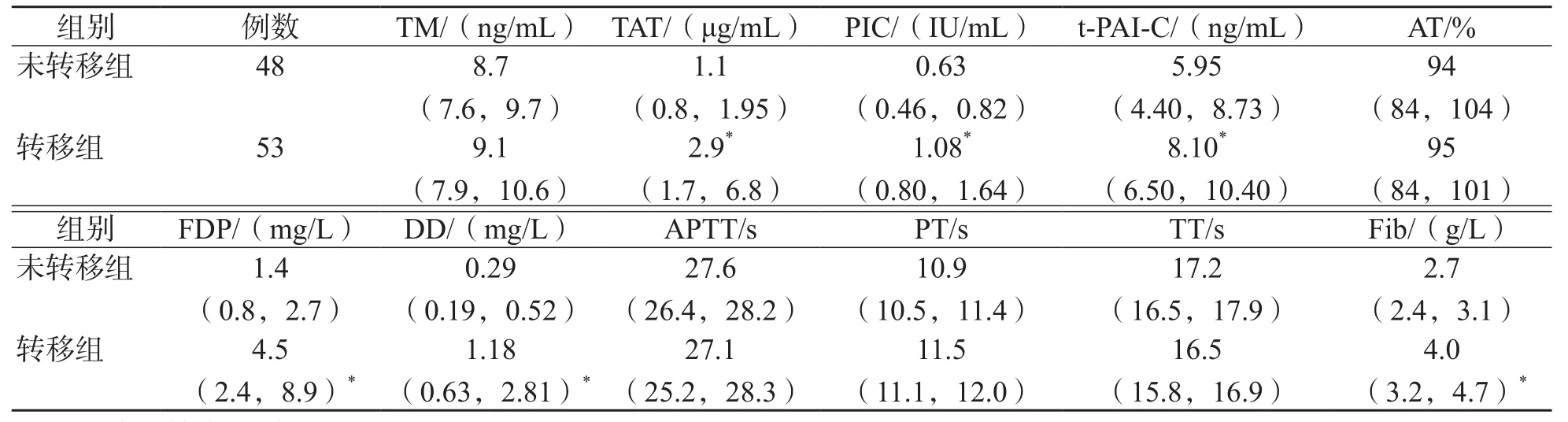
表3 结直肠癌患者转移组与未转移组各项指标比较
3 讨论
肿瘤细胞或相关炎症细胞可激活机体凝血系统,进而导致急性时相反应蛋白Fib合成大幅增多,并促进血管新生,在肿瘤的生长、侵袭及转移中起重要作用[3]。本研究比较了胃癌、结直肠癌患者与健康对照者,以及发生转移和未发生转移胃癌、结直肠癌患者常规凝血和血栓分子标志物水平,为此类患者病情进展、疗效观察及预后判断提供了实验室数据。
有研究发现,结直肠癌患者肿瘤细胞和肿瘤血管内皮细胞组织因子表达阳性率分别为70%和53%[4],53%的肿瘤血管内皮细胞表达组织因子TF。而组织因子过表达极有可能与癌基因(k-ras,p53)突变有关[5]。肿瘤组织表达的组织因子与凝血因子Ⅶ结合,会产生一系列凝血级联反应。凝血途径的激活使凝血酶原转化为凝血酶,可能导致血小板激活、Fib转化为纤维蛋白,并促进一系列化学介质的产生,如血小板源生长因子、表皮生长因子、血管内皮生长因子均可促进肿瘤组织新生血管的生成;促进肿瘤细胞增殖和转移的细胞因子,如肿瘤坏死因子β、白细胞介素-1、白细胞介素-8和有助于肿瘤细胞侵袭的基质[6]。同时,凝血酶还可增强肿瘤细胞与血管内皮的黏附性,上调缺氧诱导因子-α表达[7]。本研究发现,胃癌、结直肠癌患者APTT、PT均低于健康对照者(P<0.01),Fib高于健康对照者(P<0.01),且转移组Fib均高于未转移组(P<0.01)。提示胃癌、结直肠癌患者体内确实存在凝血异常。
凝血系统被激活后,抗凝系统也随即活跃,作为机体重要的抗凝物质,AT的消耗增加,同时与凝血酶结合形成不可逆的TAT[8],故TAT升高可提示凝血系统被激活[9]。本研究中,胃癌、结直肠癌患者AT均低于健康体检者(P<0.01),TAT均高于健康体检者(P<0.01),提示胃癌、结直肠癌患者均存在凝血激活。
随着凝血途径被激活,纤溶系统也被激活。血管内皮细胞释放的凝血酶可引起纤溶系统被动活化,交联的纤维蛋白水解,形成DD和FDP,继而形成血栓[10-11]。本研究中,胃癌、结直肠癌患者DD和FDP均高于健康对照者(P<0.01),转移组高于未转移组(P<0.01),与文献报道[11]一致。本研究发现,胃癌、结直肠癌患者PIC高于健康对照者(P<0.01),转移组高于未转移组(P<0.01);结直肠癌患者t-PAI-C高于健康对照者(P<0.01),转移组高于未转移组(P<0.01)。提示在纤维蛋白溶解过程中,胃癌、结直肠癌患者体内纤溶活性虽升高,但凝血纤溶平衡向血栓形成方向偏移,血栓分子标志物水平升高,进一步提示胃癌、结直肠癌患者体内更易形成血栓[12]。
肿瘤与高凝状态的关系目前仍是癌症研究的热点。胃癌、结直肠癌患者体内的凝血异常主要由高凝状态与纤溶状态不平衡所致,从而增加了血栓风险。因此,对胃癌、结直肠癌患者血栓分子标志物的监测显得尤为重要,可以及早提示血栓风险,对患者疗效观察与预后有重要意义。
