伴有异常早幼粒样细胞的RUNX1-RUNX1T1融合基因阳性急性髓系白血病1例报道
2022-07-15王洪玲刘庆中张春玲蔺丽慧王小蕊
王洪玲,李 莉,刘庆中,张春玲,蔺丽慧,王小蕊,赵 旻,白 萍
(1.上海交通大学医学院附属第一人民医院检验科,上海 201600;2.上海交通大学医学院附属第一人民医院血液科,上海 201600)
随着医学技术的发展,细胞遗传学和分子生物学检测成为急性髓系白血病 (acute myeloid leukemia,AML)诊断、治疗和预后监测的重要方法。本研究回顾性分析1例骨髓和外周血中出现异常早幼粒样细胞的RUNX1-RUNX1T1融合基因阳性AML患者病史、实验室检查结果,介绍其形态学的特殊之处和诊断过程,以提高临床及检验人员对此类疾病的认识。
1 患者临床资料
1.1 病史
患者,男,32岁,主诉“间断发热伴咳嗽、咳痰3 d”,外院骨髓细胞涂片提示AML-M3可能性大,遂就诊于上海交通大学医学院附属第一人民医院。查体:体温38.6 ℃,贫血貌、有皮下出血点,肝区叩击痛阳性,全身浅表淋巴结无肿大,肝脾肋下未触及,其余无殊。实验室检查:白细胞计数27.75×109/L,血红蛋白59 g/L,血小板计数20×109/L;D-二聚体80 mg/L,凝血酶原时间15.1 s,凝血酶时间21.3 s。
1.2 实验室检查
1.2.1 细胞形态学检查 (1)外周血细胞涂片:淋巴细胞9%,单核细胞2%,嗜酸性粒细胞1%,早幼粒细胞23%(可见“臀样核”),中幼粒细胞15%(部分可见胞质呈粉红样改变),晚幼粒细胞12%,带形核15%,分叶核20%,原始细胞3%(图1)。(2)骨髓细胞涂片:骨髓有核细胞增生明显活跃;原始细胞约占5%;粒系增生明显活跃(约71%),其中早幼粒细胞增高(约21%),部分早幼粒细胞胞核不规则,有“臀样核”“蝴蝶样核”变化,胞质较丰富,有内外浆,颗粒粗大,为异常早幼粒样细胞;中幼粒细胞约占20%,偶见核质发育不平衡中幼粒细胞,晚幼粒细胞约占7%,杆状核粒细胞约占5%,分叶核粒细胞约占10%,部分成熟粒细胞核分叶不良,淋巴细胞约占7%,单核细胞约占4%。全片Auer小体偶见;红系增生减低(约占13%),以中、晚幼粒红细胞为主,偶见“花瓣核”、核出芽;全片可见巨核细胞13个,颗粒型巨核细胞12个,产板型巨核细胞1个,血小板少见(图2)。骨髓细胞髓过氧化物酶(myeloperoxidase,MPO)染色阳性(图3),提示原始细胞增多伴早幼粒细胞增多骨髓象,不排除AML-M3,建议行免疫分型、染色体及分子生物学检查。

图1 外周血涂片(×1 000)
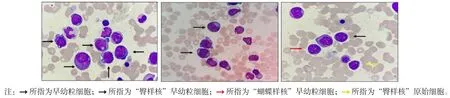
图2 骨髓细胞涂片(×1 000)

图3 骨髓细胞MPO染色(×1 000)
1.2.2 流式细胞术免疫分型 共分析4.5万个细胞,结果显示:异常髓系细胞(CD45dimSS偏高,土黄色区域)约占白细胞总数的12.1%,部分表达CD34、CD19,表达CD117、CD13、CD33、HLA-DR、CD38、CD56、MPO,弱表达CD45(图4)。

图4 流式细胞免疫分型结果(部分)
1.2.3 分子生物学检查 分子生物学检查结果显示RUNX1-RUNX1T1基因阳性,RUNX1-RUNX1T1基因拷贝数为663 409,内参基因拷贝数为602 420,RUNX1-RUNX1T1/内参基因为110.12%。
1.2.4 染色体核型分析 染色体核型分析结果显示45,X,-Y,t(8;21)(q22;q22)[3]/46,XY[7]。见图5。
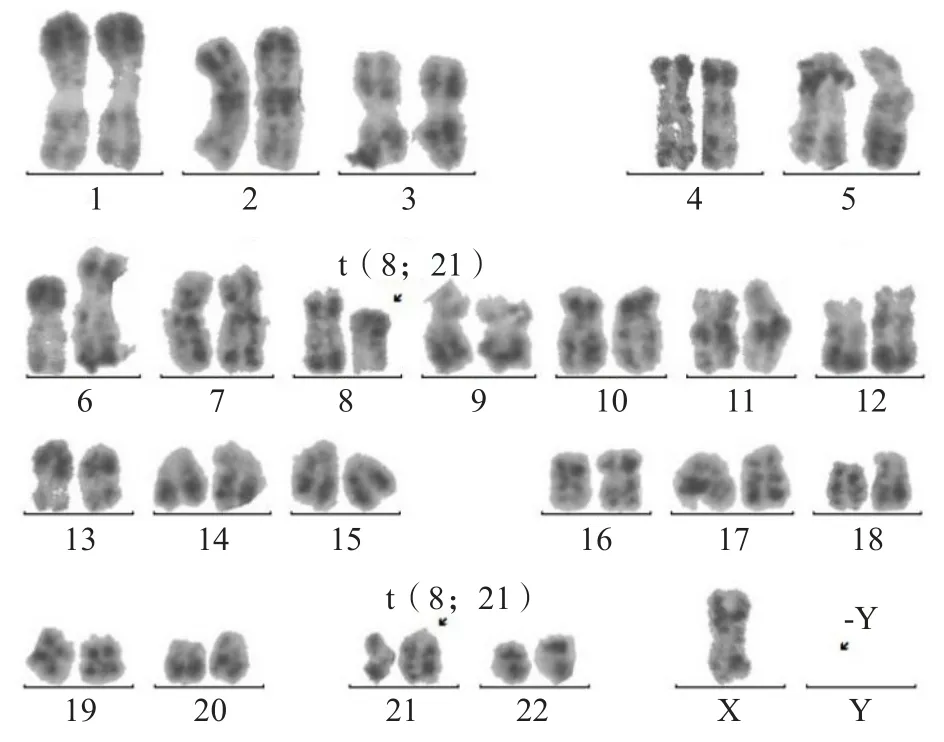
图5 染色体(R显带分析)结果
2 讨论
2016年,世界卫生组织在造血和淋巴组织肿瘤分类标准中将伴有重现性遗传学异常的AML划分为一个独立的类别,发生率约占所有AML的30%[1]。常见的重现性遗传学异常包括:t(8;21)(q22;q22.1);RUNX1-RUNX1T1、inv(16)(p13.1;q22)或t(16;16)(p13.1;q22)、急性早幼粒细胞伴PML/RARα、t(9;11)(p21.3;q23.3),前三者往往和形态学表现有一定的关联性,形态特点可能预示相应的遗传学异常。
法国、美国、英国(France-American-British,FAB)分型标准中的AML-M2常伴有t(8;21)(q22;q22.1),RUNX1-RUNX1T1阳性发生率约占M2的40%[2]。根据FAB分型中M2的细胞形态学特点,又分M2a和M2b 2个亚型。在细胞形态学上,伴有t(8;21)(q22;q22.1);RUNX1-RUNX1T1的AML与M2b有许多相似之处。典型的AML-M2b患者骨髓中以异常中性中幼粒细胞增多为主,常>30%,该类细胞胞核常有核仁,核质发育不平衡,核质比约为1∶1,胞质量丰富且充满密集、细小的中性颗粒,致使胞质呈均匀的粉红色,俗称“黄沙样”或“朝阳红”,MPO染色呈团块状反应。有学者认为异常中性中幼粒细胞的出现是核质蛋白形成紊乱所致,RUNX1-RUNX1T1基因可能是蛋白形成紊乱的原因所在[3]。本例患者骨髓细胞涂片形态学表现比较特殊,不同于典型的M2b骨髓象:原始细胞约占5%,低于急性白血病的形态学诊断标准,且早幼粒细胞明显增多,尤其是可见一定比例的异常早幼粒样细胞,其胞核不规则,可见“臀样核”和“蝴蝶样核”,胞质量丰富,颗粒粗大,有内外浆。患者外周血涂片早幼粒细胞多见,也可见到“蝴蝶样核”的异常早幼粒样细胞,这种形态学表现极易与AML-M3相混淆,特别是出现于外周血中,更易混淆。AML-M3不同于其他类型的AML,患者病情极为凶险,常出现以纤溶亢进和弥散性血管内凝血为代表的凝血功能异常,具有严重的出血倾向,出血是常见死亡原因,病死率约为2.4%~11.6%[4-5]。因此,M3是AML诊断的关键,在细胞形态学上,典型的AML-M3骨髓中异常早幼粒细胞常>30%,其胞核不规则,常为肾形或双叶形,俗称“蝴蝶样核”或“臀样核”,胞质量丰富,颗粒密集粗大,致使核、质界限不清,Auer小体常见,有时呈柴束状。但临床实践发现形态上不典型的M3越来越多见,本例患者有凝血指标异常和皮下出血等症状,在没有基因检测结果的情况下,从形态学上很难排除AML-M3的可能性。细胞免疫学方面,伴有t(8;21)(q22;q22.1);RUNX1-RUNX1T1的AML通常表达CD34,偶见表达TdT,还可表达髓系标志CD13、CD33、MPO,以及淋系标志CD19、CD56;典型的AML-M3通常表达CD13、CD33、CD117、MPO,CD34和HLADR常阴性或低表达[1],而非典型的M3一般伴有CD34和/或HLA-DR表达。本例患者流式细胞术免疫分型结果显示异常髓系细胞CD45dimSS偏高,表达CD117、CD13、CD33、HLA-DR、CD38、CD56、MPO,部分表达CD34、CD19,弱表达CD45,从免疫分型结果也无法完全排除M3的可能,需要借助分子生物学和细胞遗传学检测结果。本例患者分子生物学检测结果显示RUNX1-RUNX1T1基因阳性;细胞遗传学结果显示有t(8;21)(q22;q22.1)。根据2016年世界卫生组织造血和淋巴组织肿瘤分类标准,本例患者最终被界定为伴有t(8;21)(q22;q22.1);RUNX1-RUNX1T1的AML。
鉴于本例患者的特殊形态学表现和最终的诊断结果,我们有2点建议:(1)在形态学不能完全排除M3可能性的情况下,要及时联系临床,并进行分子生物学检查,在基因检测结果未出之前,临床医生也可以给患者以全反式维甲酸进行预防性治疗,以防延误病情,当基因诊断结果明确后,再进一步调整治疗方案[6];全反式维甲酸可以诱导早幼粒阶段的髓系细胞继续向下一阶段分化,从而降低由于出血而导致的早期死亡风险;(2)RUNX1-RUNX1T1阳性的AML形态学表现也是多样化的,尤其在原始细胞<20%时,易与其他类型白血病相混淆。本实验室曾报道了1例RUNX1-RUNX1T1阳性的AML,该患者的骨髓原始细胞<20%,骨髓象与慢性粒细胞白血病加速期极为相似[7]。李菁原等[8]也报道了1例原始细胞<20%伴RUNX1-RUNX1T1融合基因阳性的AML,该病例早幼粒细胞和中幼粒细胞明显增多,并伴有病态胞质和胞核,极易被误诊为骨髓增生异常综合征。本例患者在形态学上的特殊表现易与急性早幼粒细胞白血病相混淆。细胞形态学检查简便快速,在白血病的诊断中发挥着非常重要的作用,但是临床实践发现不典型病例日益增多,细胞形态学工作者除需要提高自身把控细胞形态的能力外,还要有MICM综合诊断的思维,有问题及时与临床沟通,尽早明确诊断,使患者及时得到良好的治疗。
