血清miR-21、miR-135a对胃癌患者化疗后复发和转移的预测价值
2022-07-16梁春芳朱康宁
梁春芳,朱康宁,张 琦
(河南省人民医院 省直第一医院检验科,河南 郑州 450000)
胃癌是消化道常见的恶性肿瘤之一,发生率和病死率均较高。我国胃癌发病率较高,因胃癌患者初期无明显特征,早期筛查的诊断率较低,待确诊时大多已处于中晚期[1]。目前,胃癌的主要治疗方法为化疗,但有超过50%的患者会出现复发和转移[2]。胃癌的发生、发展是一个极其复杂的过程,与一些原癌基因和抑癌基因异常表达密切相关[3]。因此,寻找异常表达的小分子,对胃癌的发生、发展及预后评估有重要的意义。miRNA是由22~24个核苷酸构成的单链非编码RNA分子,广泛分布于真核生物中,调控哺乳动物1/3的基因表达[4]。miRNA的异常表达与恶性肿瘤的发生、发展密切相关,主要作用为调控癌基因或抑癌基因[5]。有研究结果显示,miR-21在肝癌[6]、胃癌[7]和乳腺癌[8]等肿瘤中呈异常表达,主要通过与目的基因的特异性结合,阻断其转录来调控基因的表达。miR-135a与消化系统肿瘤,如胃癌、结直肠癌和胰腺癌密切相关,主要通过抑制抑癌基因的活化来调控消化系统肿瘤的发生、发展[9-11]。这提示miR-21和miR-135a与胃癌有密切联系,化疗后检测患者miR-21和miR-135a的表达或可用于评估胃癌患者的早期复发和转移风险。为此,本研究拟探讨胃癌患者血清miR-21、miR-135a表达与化疗后复发、转移的关系。
1 材料和方法
1.1 研究对象
选取2016年1月—2018年1月河南省人民医院行化疗的胃癌患者100例(胃癌组),其中男62例、女38例,年龄38~77岁。肿瘤部位包括贲门(22例)、胃体(34例)、胃窦(31例)、全胃(13例);病理类型包括单纯腺癌(55例)、印戒细胞癌(10例)、黏液腺癌(6例)、混合型(29例);参考国际抗癌联盟及美国肿瘤联合会发布的胃癌TNM分期标准[12]进行TNM分期:ⅠB期8例、Ⅱ期15例、ⅢA期28例、ⅢB期22例、ⅢC期27例。另选取同期河南省人民医院健康体检者50名(正常对照组),其中男29名、女21名,年龄38~77岁。2个组之间年龄、性别差异均无统计学意义(P>0.05)。本研究经河南省人民医院伦理委员会批准。
1.2 纳入与排除标准
纳入标准:(1)以病理学检查结果为诊断标准;(2)入组前未经过放疗或化疗等治疗;(3)临床资料和随访资料齐全,且签署知情同意书。
排除标准:(1)术前曾接受手术、辅助化疗或放疗;(2)肿瘤类型为肉瘤、间质瘤或淋巴瘤;(3)化疗过程中死亡;(4)患可经血液传播的传染性疾病。
1.3 随访
在化疗后1个月开始对患者进行随访,每个月采用电子计算机断层扫描(computed tomography,CT)复查1次,如出现复发或转移征象,则通过磁共振成像(magnetic resonance imaging,MRI)、正电子发射断层显像(positron emission tomography,PET)/CT和淋巴结穿刺等方法确诊。从2016年2月开始,对患者进行24个月的随访。随访第12个月、第14个月和第18个月各失访1例。
1.4 实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)
采集所有患者化疗前和化疗后第3、8、13、18、24个月的空腹静脉血10 mL,采集正常对照者体检当日的空腹静脉血10 mL,4 ℃1 000×g离心15 min后,分离血清,置于-80 ℃保存待检。采用Trizol LS试剂盒(美国Invitrogen公司)提取血清总RNA,采用NanoDrop 2000分光光度计(美国ThermoFisher Scientific公司)检测总RNA的纯度和浓度。将胃癌组与正常对照组的RNA浓度调至一致,再使用miRNA 第一链 cDNA 合成(加尾法)试剂盒将RNA逆转录(37 ℃ 60 min,85 ℃ 5 min)为cDNA。采用实时荧光定量PCR检测miR-21和miR-135a表达。引物序列见表1。扩增条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸30 s,40个循环。以U6为内参,采用2-ΔΔCt法计算miR-21和miR-135a的相对表达量。

表1 引物序列
1.5 统计学方法
采用SPSS 20.0软件和Graphpad 5软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验,多组间比较采用方差分析,两两比较采用SNK-q检验。计数资料以例或率表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价miR-21和miR-135a判断胃癌预后的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组与正常对照组血清miR-21和miR-135a相对表达量比较
与正常对照组比较,胃癌组化疗前血清miR-21相对表达量升高(P<0.05),miR-135a相对表达量降低(P<0.05),见表2。胃癌组中有79例(79%)miR-21表达升高,有68例(68%)miR-135a表达降低。
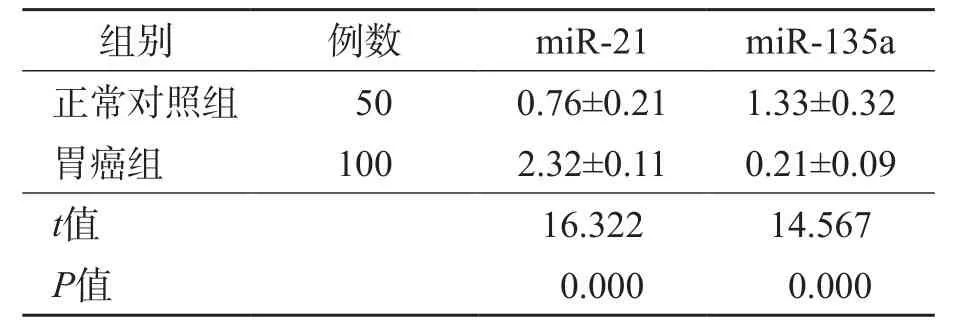
表2 胃癌组与正常对照组血清miR-21和miR-135a相对表达量比较
2.2 血清miR-21和miR-135a相对表达量与胃癌患者临床病理特征的关系
胃癌组化疗前血清miR-21和miR-135a相对表达量与淋巴结转移、分化程度、浸润深度有关(P<0.05),与年龄、性别、TNM分期、有无远处转移无关(P>0.05)。见表3。
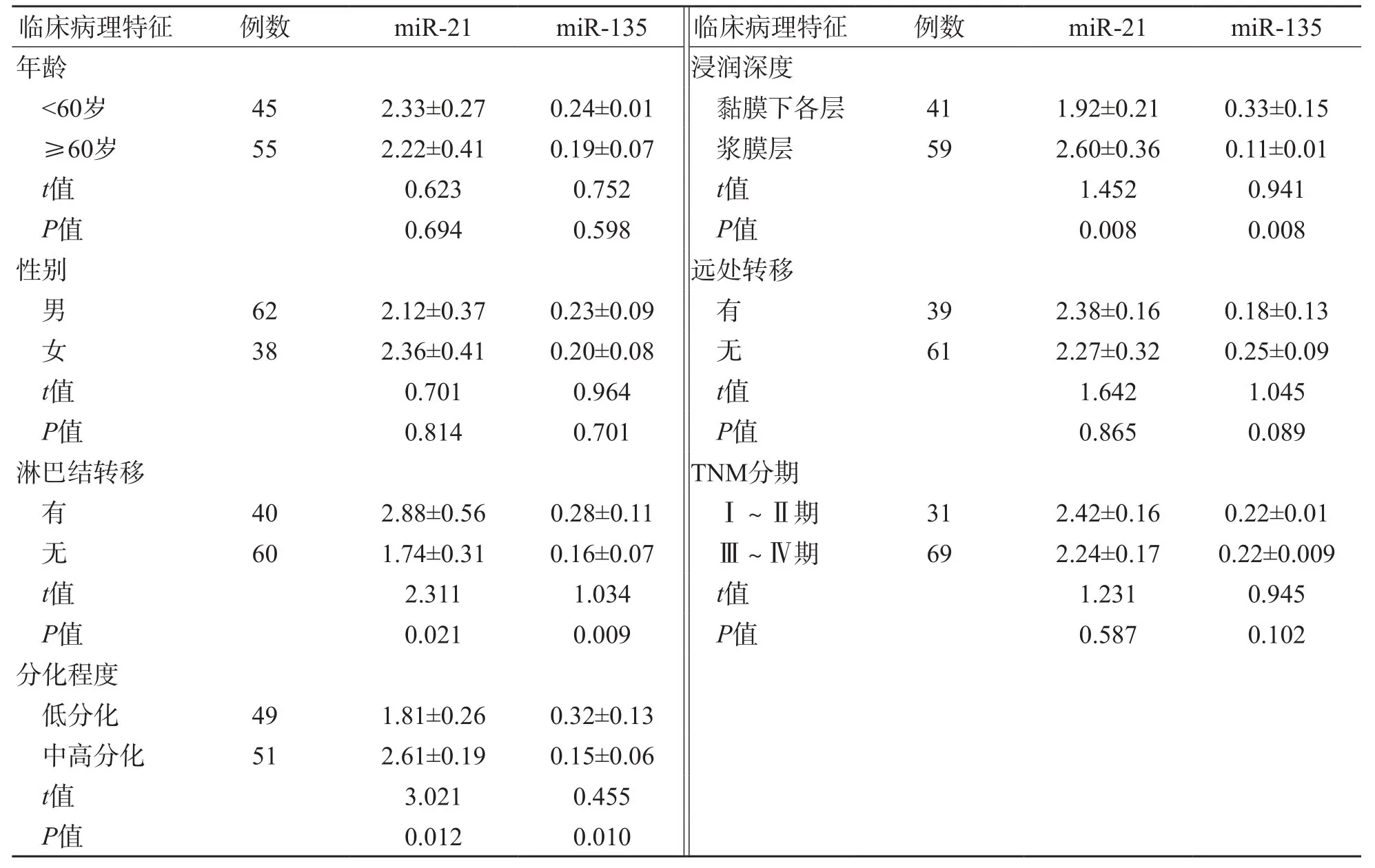
表3 胃癌组血清中miR-21和miR-135表达水平与临床特征的关系
2.3 胃癌组化疗后复发转移患者血清miR-21和miR-135a相对表达量
100例胃癌患者化疗后随访24个月,失访3例。97例完成随访的患者中有66例(68%)出现复发或转移(复发转移组),其中25例为局部复发、41例为远处转移,有33例死亡。未出现复发或转移的患者归入无复发转移组。
复发转移组化疗后3、8、13、18和24个月的血清miR-21相对表达量高于无复发转移组(P<0.05),miR-135a相对表达量低于无复发转移组(P<0.05)。复发转移组化疗后血清miR-21相对表达量随随访时间的延长而升高(P<0.05),血清miR-135a相对表达量随随访时间的延长而降低(P<0.05)。无复发转移组血清miR-21相对表达量随随访时间的延长而降低(P<0.05),血清miR-135a相对表达量各时间点差异均无统计学意义(P>0.05)。见表4、表5。
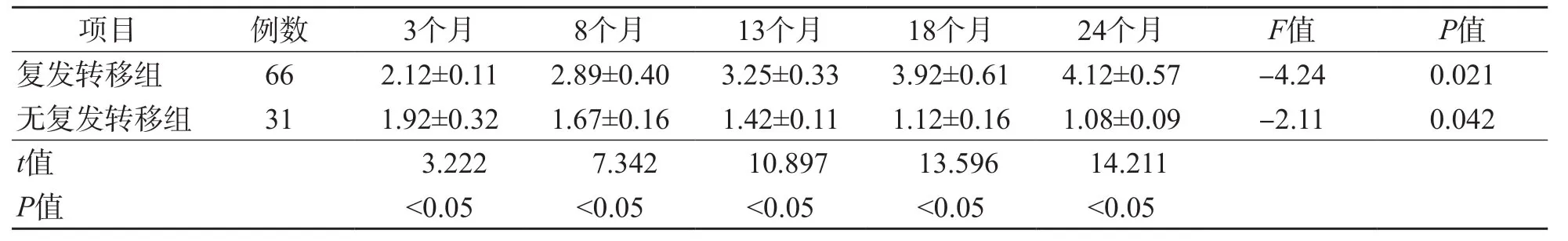
表4 复发转移组与无复发转移组各随访时间点血清miR-21相对表达量比较
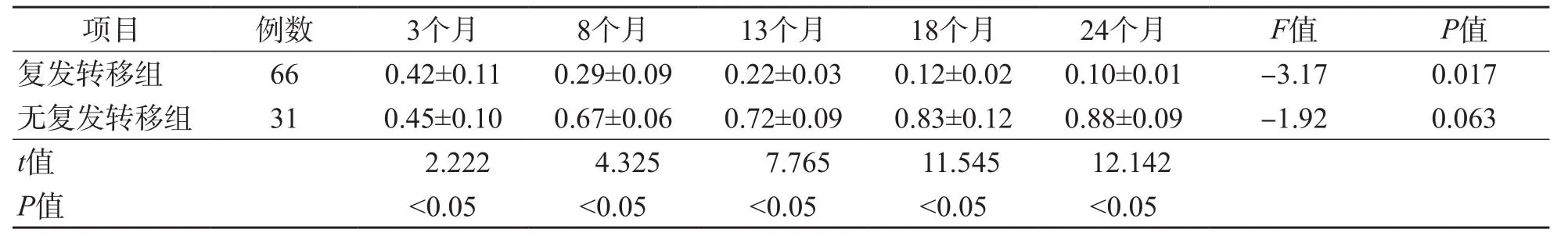
表5 复发转移组与无复发转移组各随访时间点血清miR-135a相对表达量比较
2.4 miR-21和miR-135a单项检测及联合检测判断胃癌化疗后复发转移的效能
以患者出现复发或转移作为阳性(预后不良,66例),无复发或转移作为阴性(31例),采用ROC曲线分析随访24个月时的miR-21和miR-135a检测结果判断胃癌预后的效能。结果显示,miR-21和miR-135a判断胃癌预后的曲线下面积(area under curve,AUC)分别为0.789、0.826,最佳临界值分别为1.27、1.88。以随访24个月时的miR-21和miR-135a检测结果均阳性为联合检测阳性,均阴性为联合检测阴性,miR-21+miR-135a联合检测判断胃癌预后的敏感性和特异性分别为91.2%和67.8%。见表6、图1。
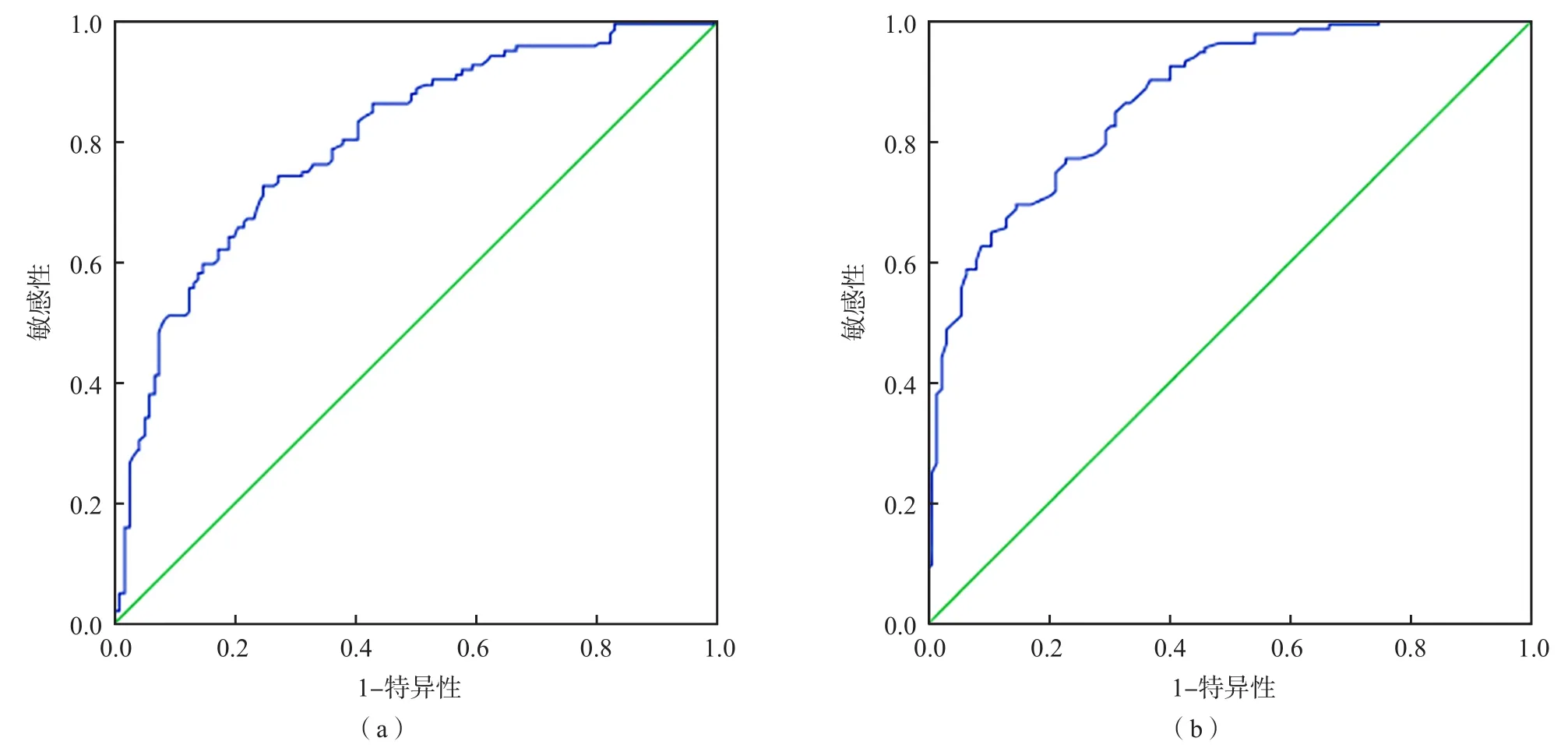
图1 随访24个月时的miR-21和miR-135a判断胃癌化疗后复发转移的ROC曲线

表6 随访24个月时的miR-21和miR-135a单项检测和联合检测判断胃癌化疗后复发转移的效能
3 讨论
胃癌是常见的恶性肿瘤之一,好发于50岁以上人群,但近年来有逐渐年轻化的趋势,男女性发病比例约为2∶1[3]。由于胃癌早期症状不明显,易被忽视,当患者被确诊时已经处于中晚期,错过了最佳的治疗时期,故大部分胃癌患者预后不良,复发转移率较高[13]。有研究结果显示,miRNA主要参与了肿瘤细胞的增殖、分化、侵袭、迁移等过程,其异常表达与肿瘤的发生、发展密切相关[14]。有研究发现,miR-181、miR-145等参与了胃癌的发生、发展,可作为胃癌的生物标志物[15-16]。
本研究结果显示,胃癌组化疗前血清miR-21相对表达量高于正常对照组(P<0.05),miR-135 a相对表达量低于正常对照组(P<0.05);高表达miR-21和低表达miR-135a与胃癌患者淋巴结转移、中高分化、浸润程度(浆膜层)密切相关,但与年龄、性别、远处转移、TNM分期无关,说明miR-21和miR-135可能参与了胃癌的发病过程。miR-21和miR-135a与消化系统肿瘤的发生、发展密切相关。有研究发现,在消化系统肿瘤,如胃癌中,miR-21表达上调,miR-135a表达下调[9,17]。miR-21可通过抑制磷酸酶及张力蛋白同源基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)的表达,阻碍磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB;又称Akt)信号通路,促进肿瘤细胞增殖[18];还可通过下调程序性细胞死亡因子4(programmed cell death 4,Pdcd4)的表达,诱导结直肠癌细胞的侵袭和迁移[19]。miR-135a与驱动蛋白家族成员C1(kinesin family member C1,KIFC1)结合后可下调KIFCI的表达,抑制胃癌细胞增殖,促进胃癌细胞凋亡[20]。在伴有淋巴结转移的胃癌患者中,miR-135a可抑制瞬时受体电位通道1的表达,从而抑制胃癌的淋巴结转移,减缓胃癌的发展[21]。
miR-21和miR-135a与胃癌的进展密切相关。本研究结果显示,在24个月的随访期中,化疗后复发转移患者的血清miR-21相对表达量随随访时间的延长而升高(P<0.05),血清miR-135a相对表达量随随访时间的延长而降低(P<0.05)。提示miR-21和miR-135a与胃癌化疗后复发转移密切相关。本研究ROC曲线分析结果显示,随访24个月时的miR-21和miR-135a单项检测判断胃癌预后的AUC分别为0.789、0.826,敏感性和特异性均>70%,两者联合检测可在特异性稍降低(67.8%)的基础上将敏感性提高至91.2%。这说明miR-21和miR-135a联合检测判断胃癌患者化疗后2年内是否会发生复发或转移具有较好的价值。
综上所述,胃癌患者血清miR-21和miR-135a表达异常,且表达水平与胃癌患者的淋巴结转移、分化程度、浸润程度密切相关。血清miR-21和miR-135a联合检测对胃癌化疗后复发或转移的判断具有较好的价值。
