miR-19b在人主动脉瓣间质细胞钙化中的作用
2022-07-15杨濛,丁辉
杨 濛,丁 辉
(西北大学附属医院 西安市第三医院心血管内科,陕西 西安 710018)
钙化性主动脉瓣疾病是与老年人心血管疾病密切相关的一种退行性疾病[1]。有研究发现,主动脉瓣膜钙化是类似成骨样分化的主动过程,涉及多个成骨相关因子的表达调节[2]。主动脉瓣间质细胞是主动脉瓣中的主要细胞之一,在维持瓣膜正常生理功能方面有重要作用[3]。在疾病的刺激下,主动脉瓣间质细胞可能发生功能受损,从而导致主动脉瓣膜病变的发生[4]。主动脉瓣间质细胞向成骨细胞样细胞表型的转化是主动脉瓣钙化病理改变的基础之一[4]。miRNA参与了人体的多种生理和病理过程,如细胞增殖、凋亡和分化[5]。有研究结果显示,miR-19b的低表达与心血管疾病患者的死亡率密切相关[6]。但miR-19b在主动脉瓣钙化疾病中的相关研究鲜有报道。为此,本研究拟探讨miR-19b在主动脉瓣间质细胞钙化中的作用及具体机制,为临床主动脉瓣钙化疾病的治疗提供新的思路。
1 材料和方法
1.1 仪器与试剂
infinite M200 PRO多功能酶标仪(瑞士TECAN公司),StepOnePlus实时荧光定量PCR仪(美国ABI公司),AgaroPower电泳仪(韩国BIONEER公司)。
人主动脉瓣间质细胞(human valve interstitial cell,hVIC)购自美国DV公司。胎牛血清、Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM)购自武汉普诺赛生命科技有限公司。骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)、地塞米松、抗维生素C和β-甘油磷酸均购自美国Sigma公司。Lipofectamine 2000转染试剂盒购自美国Invitrigen公司。Von Kossa染色试剂盒及SMAD4抗体均购自美国Abcam公司。RNA逆转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)和双荧光素酶报告基因实验试剂盒均购自日本TaKaRa公司。miRcute增强型miRNA cDNA第一链合成试剂盒购自天根生化科技(北京)有限公司。由生工生物工程(上海)股份有限公司设计并合成转录受体相关转录因子-2(Runt-related gene 2,RUNX2)基因、骨钙素(osteocalcin,OC)基因、SMAD1基因、骨桥蛋白(osteopontin,OPN)基因和SMAD4基因的引物序列,见表1。以β-actin或U6为内参。miR-19b模拟物、miR-19b空白对照(miRNC)及SMAD4过表达质粒设计及合成由汉尹生物科技(上海)有限公司完成。一抗[SMAD4抗体(货号:ab40759)、抗3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(货号:ab9485)]及二抗(货号:ab6759)均购自英国Abcam公司。聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司。
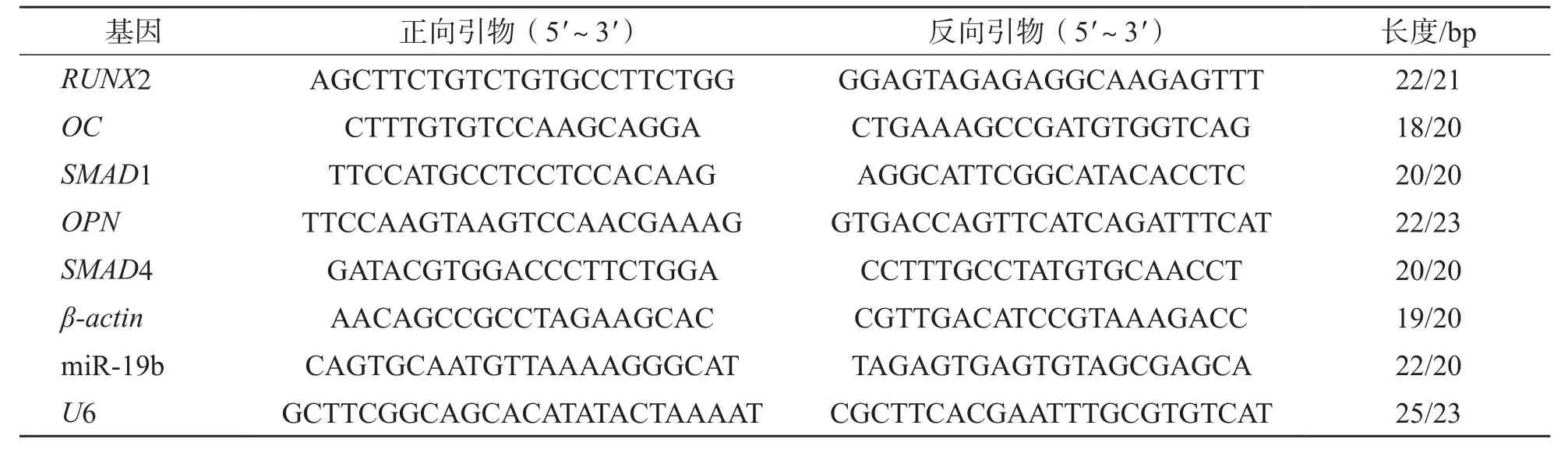
表1 引物序列
1.2 实验分组
将经钙化诱导的hVIC细胞作为钙化模型组,以未做处理的hVIC细胞作为对照组。根据转染质粒的不同,将hVIC细胞分为miR-19b空白对照组,miR-19b过表达组、SMAD4过表达组、miR-19b和SMAD4同时过表达(miR-19b+SMAD4过表达)组。
1.3 细胞培养
对照组hVIC细胞用含10%胎牛血清的DMEM培养。钙化模型组hVIC细胞用含0.1%胎牛血清、50 ng/mL BMP-2、100 nmol/L地塞米松、50 μg/mL抗维生素C和5 mmol/L β-甘油磷酸的DMEM培养,每隔2天更换1次培养基[7-8]。所有细胞均在37 ℃、5% CO2的恒温培养箱中进行培养,培养7 d后进行后续实验。
1.4 细胞转染
将hVIC细胞以3×104个细胞/孔的密度接种至6孔板,当细胞融合度为80%时,使用30 pmol miR-19b模拟物或2.5 μg SMAD4过表达质粒,根据Lipofectamine 2000试剂盒说明书转染hVIC细胞。转染48 h后采用荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测转染效率。
1.5 Von Kossa染色
去除对照组和钙化模型组hVIC细胞的培养基后,用磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗3次;用4%多聚甲醛固定10 min,随后使用蒸馏水洗涤3次;将hVIC细胞浸入新配置的5%硝酸银溶液中,紫外灯照射60 min后使用5%硫代硫酸钠还原2 min;用95%乙醇逐级各脱水2次,在CX23型光学显微镜(日本奥林巴斯公司)下用低倍镜观察,记录各组hVIC细胞中钙化结节的数目。
1.6 荧光定量PCR
常规提取各组hVIC细胞内的总RNA,逆转录为互补DNA(complementary DNA,cDNA)(mRNA采用RNA逆转录试剂盒,miRNA采用miRcute增强型miRNA cDNA第一链合成试剂盒)。采用荧光定量PCR定量检测RUNX2 mRNA、OC mRNA、SMAD1 mRNA、OPN mRNA、SMAD4 mRNA和miR-19b的表达量。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。根据公式2-ΔΔCt计算RUNX2 mRNA、OC mRNA、SMAD1 mRNA、OPN mRNA、SMAD4 mRNA及miR-19b的表达量。
1.7 双荧光素酶报告基因实验
通过StarBase数据库(https://starbase.sysu.edu.cn)在线预测miR-19b的下游靶基因。采用PCR扩增SMAD4 mRNA 3'-非翻译区(untranslated region,UTR),插入psiCHECK2载体,构建野生型(wide-type,WT)质粒,以WT质粒为模板,通过点突变的方式构建突变型(mutanttype,Mut)质粒。将hVIC细胞以3×103个细胞/孔的密度接种至96孔板,当细胞融合度为80%时,转染miR-NC、miR-19b-mimics、psiCHECK2-SMAD4-WT或psiCHECK2-SMAD4-Mut,转染后48 h在各孔中加入100 μL裂解液并离心。收集各孔上清液后,加入40 μL萤火虫荧光素酶底物,轻晃摇匀后上机检测荧光强度。再向各孔中加入40 μL海肾荧光素酶底物,轻晃摇匀后测量各孔的荧光素酶活性。
1.8 免疫印迹法
采用RIPA裂解液分离hVIC细胞内的总蛋白。将蛋白质混合物95 ℃加热10 min。将20 μL加热后的蛋白质混合物加入聚丙烯酰胺凝胶平板中,电泳分离蛋白质。将电泳后的蛋白质转移至PVDF膜上,在4 ℃条件下与SMAD4一抗封闭过夜,采用三羟甲基氨基甲烷-吐温缓冲液(tris-hydroxymethyl aminomethane-Tween,TBST)洗涤3次后加入二抗,在室温下孵育1 h。使用ECL试剂盒(美国ThermoFisher Scientific公司)进行显影后拍照,使用Image J软件(美国国立卫生研究院)分析条带灰度值。
1.9 统计学方法
采用SPSS 22.0软件进行统计分析。采用GrapahPad 8.2软件作图。所有实验均独立重复3次。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 人主动脉间质细胞体外钙化模型构建
钙化模型组hVIC细胞密度增加,互相重叠生长,并表现出明显的聚集样生长趋势。Von Kossa染色结果显示,钙化模型组hVIC细胞外基质中钙化结节的数目明显多于对照组。荧光定量PCR检测结果显示,钙化模型组hVIC细胞内成骨相关因子RUNX2 mRNA、OC mRNA、SMAD1 mRNA和OPN mRNA的相对表达量显著高于对照组(P<0.05)。见图1。
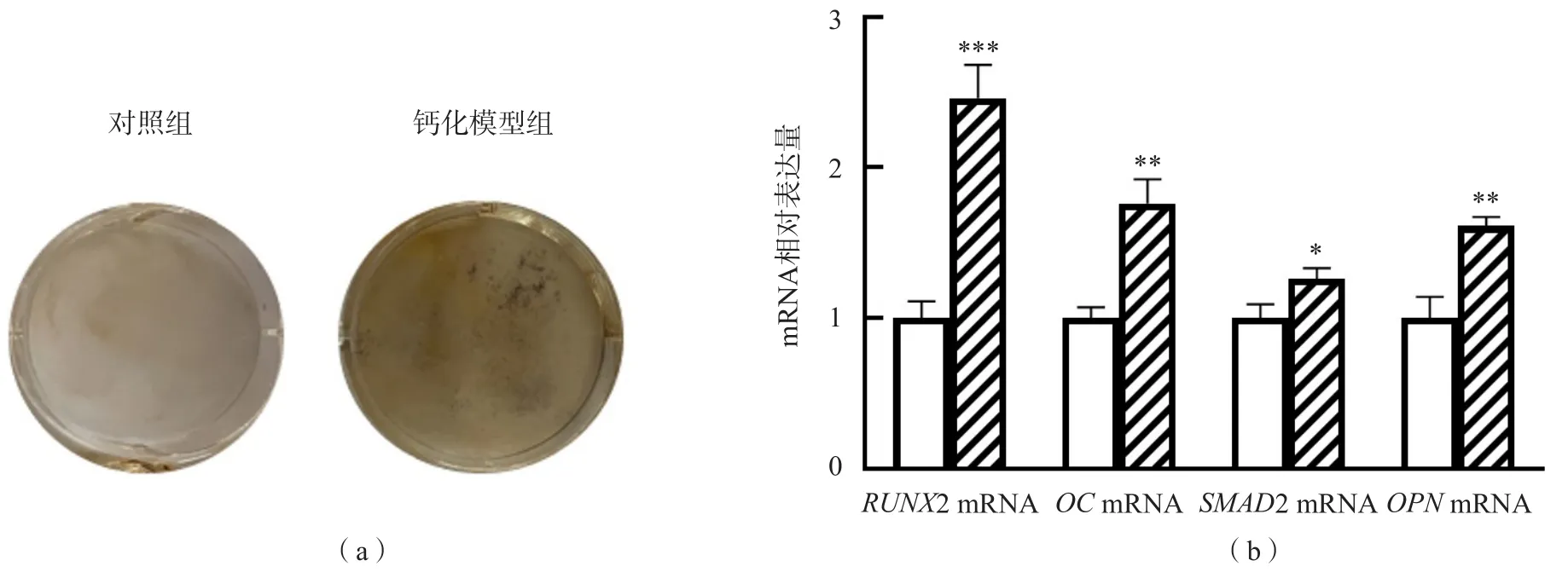
图1 hVIC细胞体外钙化模型
2.2 miR-19b对hVIC细胞钙化的作用
钙化模型组miR-19b表达量(0.46±0.06)显著低于对照组(1.00±0.10)(t=8.020,P<0.01),miR-19b过表达组(2.46±0.21)显著高于对照组(t=10.870,P<0.001)。
miR-19b过表达组hVIC细胞内成骨相关因子RUNX2 mRNA、OC mRNA、SMAD1 mRNA及OPN mRNA表达量显著低于钙化模型组(P<0.05、P<0.01、P<0.01、P<0.01)。见表2。
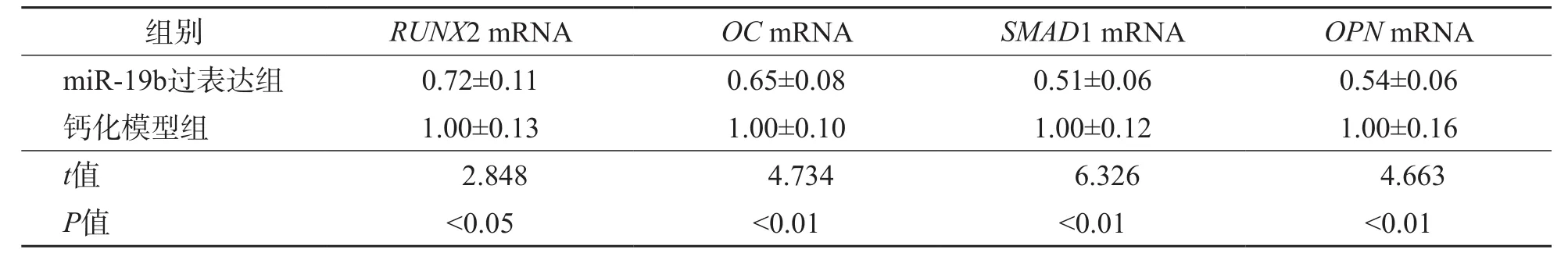
表2 miR-19b过表达组与钙化模型组成骨相关因子表达的比较
2.3 miR-19b下游靶基因的预测结果
StarBase数据库预测结果显示,SMAD4与miR-19b的3'-UTR端存在部分结合序列,见图2。
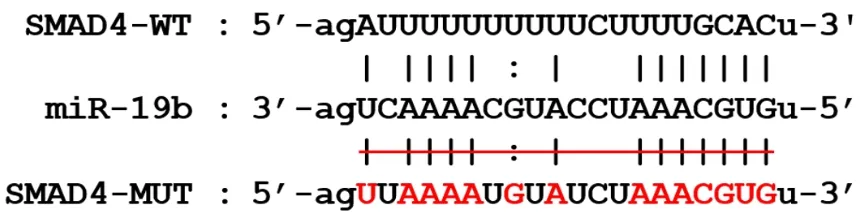
图2 miR-19b与SMAD4的结合序列
miR-19b过表达组SMAD4蛋白的表达量(0.42±0.04)和野生型SMAD4荧光素酶活性(0.53±0.05)均显著低于miR-NC组(1.00±0.14和1.00±0.11)(t值分别为6.900、6.737,P<0.01);而miR-19b过表达组突变型SMAD4荧光素酶活性(0.97±0.06)与miRNC组(1.00±0.07)比较,差异无统计学意义(P>0.05)。见图3。
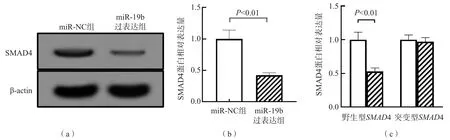
图3 miR-19b过表达组与miR-NC组SMAD4蛋白相对表达量及SMAD4荧光素酶活性比较
2.4 miR-19b/SMAD4分子轴在人主动脉瓣间质细胞钙化中的作用
钙化模型组、SMAD4过表达组SMAD4 mRNA相对表达量分别为1.46±0.09、3.15±0.17,均显著高于对照组(1.00±0.10)(t值分别为5.922、18.881,P<0.001),miR-19b+SMAD4过表达组SMAD4 mRNA水平与对照组比较差异无统计学意义(P>0.05)。
SMAD4过表达组RUNX2 mRNA、OC mRNA、SMAD1 mRNA和OPN mRNA的相对表达量显著高于钙化模型组和miR-19b+SMAD4过表达组(P<0.05),而钙化模型组与miR-19b+SMAD4过表达组之间差异均无统计学意义(P>0.05)。见表3。

表3 各组成骨相关因子表达的比较
3 讨论
目前,除了传统的手术治疗外,尚无其他方法可阻止主动脉瓣钙化的发生、发展。有研究证实,炎症反应、主动脉瓣间质细胞表型转化、凋亡、血管形成和矿物质沉积等多种病理改变在主动脉瓣钙化疾病中发挥重要作用[9]。
成骨细胞特异性转录因子RUNX2、SMAD1是多种成骨细胞和骨组织标志物,其水平升高提示主动脉瓣钙化[10]。有研究结果显示,主动脉瓣间质细胞向成骨细胞表型转化是主动脉瓣钙化疾病的发病原因之一[11]。本研究通过体外培养主动脉瓣间质细胞,诱导其发生钙化,在显微镜下可观察到细胞聚集生长,采用Von Kossa染色后发现钙化结节数量增多,同时细胞转录因子RUNX2、OC、SMAD1及Osteoponin水平增高,提示钙化模型成功建立。
miRNA是一类具有重要生物学功能的内源性非编码小RNA。有研究发现,miR-137可调节主动脉瓣间质细胞的成骨活性[12-13]。有研究结果显示,在小鼠主动脉钙化模型中,miR-204表达降低,RUNX2表达升高,提示miR-204是主动脉钙化疾病的潜在治疗靶标[14];miR-638在主动脉瓣钙化组织中表达增加,且具有调节主动脉瓣间质细胞钙化的作用[15]。miR-19b是近年来发现与心脏疾病密切相关的miRNA之一[16-17],但其在主动脉瓣钙化疾病中的作用鲜有报道。本研究结果显示,钙化模型组miR-19b表达量明显降低,过表达miR-19b可诱导钙化模型细胞降低RUNX2 mRNA、OC mRNA、SMAD1 mRNA和OPN mRNA的表达,提示miR-19b表达的异常缺失可能是导致主动脉瓣钙化疾病的因素之一。有学者在骨髓间充质干细胞中发现miR-19b过表达可诱导RUNX2表达增加,促进细胞增殖与分化[18]。然而,本研究在主动脉瓣间质细胞中发现,过表达miR-19b可抑制RUNX2表达,这与既往在其他细胞系中的发现[18]相反,提示miR-19b具有细胞表达特异性及功能的差异。此外,既往支持miR-19b调控OC、SMAD1和OPN基因表达的研究尚少,因此miR-19b的调控作用仍需进一步研究。
有研究发现,BMP-2/SMAD信号通路与间质细胞的成骨分化密切相关,SMAD4是其中的关键调节蛋白[19]。SMAD4蛋白可以与磷酸化的SMAD1、SMAD5或SMAD8结合形成复合物,增加下游钙化基因的表达。HUANG等[20]的研究结果显示,SMAD4是成骨细胞分化的关键调节因子之一。本研究结果显示,过表达SMAD4可使间质细胞模型成骨相关因子RUNX2 mRNA、OC mRNA、SMAD1 mRNA和OPN mRNA相对表达量明显升高,荧光素酶报告基因实验结果证实SMAD4是miR-19b的下游靶基因。JIANG等[21]通过基因数据库预测及荧光素酶报告基因分析,在结肠癌细胞中发现miR-19b可靶向SMAD4并抑制其表达,与本研究结果一致。这明确了miR-19b与SMAD4的靶向作用,而过表达miR-19b可抑制SMAD4的表达。因此,当hVIC同时过表达miR-19b和SMAD4时,过表达miR-19b逆转了过表达SMAD4对钙化模型细胞内成骨相关因子表达的上调。
综上所述,miR-19b是hVIC钙化的关键调节因子,可通过调节SMAD4蛋白的表达影响主动脉瓣间质细胞钙化,提示miR-19b和SMAD4有可能成为治疗主动脉瓣钙化疾病的潜在靶标。
