贝莱斯芽孢杆菌降解脱氧雪腐镰刀菌烯醇及抑制禾谷镰刀菌的研究
2022-07-12曹荣耀谢岩黎程思忠
曹荣耀,谢岩黎,刘 晨,程思忠
河南工业大学 粮油食品学院,河南 郑州 450001
脱氧雪腐镰刀烯醇(deoxynivalenol,DON)又称呕吐毒素(vomitoxin),是由禾谷镰刀菌和雪腐镰刀菌等一系列真菌产生的次级代谢产物,属于B类单端孢酶烯族毒素[1-2]。DON广泛存在于玉米、小麦、大豆等粮食作物中,是常见的真菌毒素之一[3-4]。DON通过影响免疫细胞增殖从而降低机体的免疫力,同时能够抑制DNA、RNA和部分蛋白质的合成,使人和动物中毒,引起人体免疫抑制、贫血等症状,也能造成家畜呕吐、生殖紊乱和生长缓慢等现象[5-6]。目前世界上至少37个国家和组织制定了DON的限量标准[7],GB 2761—2017 《食品安全国家标准 食品中真菌毒素限量》中规定了谷物及其制品中DON的含量不能超过 1 mg/kg。因此采取有效的脱毒方法对粮食、饲料安全以及人和动物的健康具有重要意义。
当前,DON的脱毒方法主要包括物理、化学和生物降解法[8]。目前已知的物理吸附法对DON的吸附效果不佳,甚至会导致谷物和饲料中营养物质被破坏,造成二次污染。DON具有十分稳定的化学结构[9],化学脱毒可以有效破坏DON结构,但同时会引入化学物质,影响谷物和饲料的品质。生物降解法主要通过从自然界中筛选微生物,利用微生物释放的胞外酶对DON进行降解,具有温和、安全、高效等特点。微生物可以通过水合作用、去环氧化和糖苷化等方式使DON的结构发生改变,进而使DON转化成为低毒或者无毒的产物[10-12]。目前,国内外利用微生物降解DON的研究已慢慢成为主流,且相关研究结果表现出良好的应用和开发前景[13-14]。
禾谷镰刀菌(Fusariumgraminis)属于植物病原真菌[15],通过侵染不同生长阶段的小麦分泌出DON等真菌毒素,对人和牲畜造成威胁[16]。小麦赤霉病每年的发病面积超过总种植面积的20%[17]。现今喷洒农药是防治禾谷镰刀菌产生危害的主要措施,但是化学试剂长期使用会导致菌株产生耐药性,并且会造成病原菌毒素的积累[18]。生物防治技术在植物病害综合治理中具有重要作用,利用微生物或者其代谢产物已经成为生物防治的重要组成部分,能够保障食品和环境的安全,同时对农业的可持续绿色发展具有重大意义[19]。在禾谷镰刀菌的生物防治中研究最为广泛的菌株是芽孢杆菌,如多黏类芽孢杆菌[20]、枯草芽孢杆菌[21]、解淀粉芽孢杆菌[22]等对其都有较好的抑制作用。作者从猪肠道微生物中分离得到1株能够降解呕吐毒素的贝莱斯芽孢杆菌Vel-HNGD-F2,研究其降解效果及特性,同时探究其对禾谷镰刀菌的拮抗效果。
1 材料与方法
1.1 材料与试剂
样品:洛阳仔猪肠道微生物;禾谷镰刀菌:河南工业大学生物工程学院。
DON标准品:江苏省农业科学院农产品质量安全与营养研究所;Ezup 柱式细菌基因组 DNA 抽提试剂盒:上海生工生物工程股份有限公司;呕吐毒素免疫亲和柱:佰奥萃(天津)生物科技有限公司;蛋白酶k:德国 biofroxx 公司;甲醇:天津市四友精细化学品有限公司;牛肉膏、蛋白胨、胰蛋白胨、酵母浸粉:北京奥博星生物技术有限责任公司。硫酸铵、氯化钙、硫酸亚铁等:天津市科密欧化学试剂有限公司。
1.2 仪器与设备
ZQZY-A8E全温振荡培养箱:上海知楚仪器有限公司;数显恒温水浴锅:游目仪器有限公司;TGL-16M高速冷冻离心机:湖南湘仪仪器有限公司;高效液相色谱仪:安捷伦科技(中国)有限公司;JY92-IIN超声波细胞破碎仪:宁波新芝生物科技股份有限公司。
1.3 培养基
初筛培养基:1 g 硫酸铵、0.5 g 氯化钠、0.05 g 氯化钙、6 g 磷酸氢二钾、3 g 磷酸二氢钾、0.5 g 硫酸镁、0.001 g 硫酸亚铁、20 g琼脂、1 L蒸馏水。
发酵培养基:3 g牛肉膏、10 g蛋白胨、6 g葡萄糖、5 g氯化钠、20 g琼脂、1 L蒸馏水。
LB培养基:10 g胰蛋白胨、5 g酵母浸粉、10 g氯化钠、20 g琼脂、1 L蒸馏水。
PDA培养基:200 g马铃薯、20 g葡萄糖、20 g琼脂、1 L蒸馏水。
1.4 菌株的分离纯化
称取10 g样品加入90 mL生理盐水中,150 r/min恒温振荡2 h,吸取0.2 mL悬浮液于灭菌后的发酵培养基中,37 ℃摇床150 r/min培养48 h。将发酵液等梯度稀释至10-1、10-2、10-3、10-4、10-5和10-6,然后吸取不同稀释度的发酵培养菌液100 μL涂布于含有20 μg/mL DON的初筛培养基中,37 ℃培养48 h。在培养基中挑选出长势良好且形态较大的单菌落,将菌落划线于初筛培养基上,纯化并培养3代后得到单一菌落。将单一菌落接种在液体发酵培养基中,37 ℃摇床150 r/min 培养48 h后保藏于-80 ℃冰箱中。
1.5 降解DON菌株的筛选
在LB培养基中接种筛选出的单菌落,37 ℃摇床150 r/min培养24 h,将1%的培养液接种到液体发酵培养基中,37 ℃摇床150 r/min培养48 h。吸取950 μL培养液和50 μL DON标准品(100 μg/mL)于1.5 mL棕色离心管中,使DON 的终质量浓度达到5 μg/mL,37 ℃摇床150 r/min 孵育72 h。将孵育完全的混合体系以10 000 r/min离心10 min后收集上清液,将上清液以1~2 s/滴通过呕吐毒素免疫亲和柱,用10 mL蒸馏水清洗免疫亲和柱,将3 mL甲醇以1~2 s/滴通过免疫亲和柱,用10 mL离心管收集甲醇溶液,并使用氮吹仪吹干收集的甲醇溶液,向吹干后的离心管中加入1 mL流动相进行复溶,通过高效液相色谱(HPLC)检测DON降解率。HPLC检测参数:Eclipse Plus C18(250 mm×4.6 mm,5 μm);柱温35 ℃;上样量20 μL ;流动相为水-甲醇(体积比70∶ 30);波长218 nm ;流速1 mL/min。

式中:A0为对照组DON含量;A1为试验组DON含量。
1.6 菌株鉴定
根据《常见细菌系统鉴定手册》分析菌株的生理生化特征。
1.7 分子生物学鉴定
筛选菌株的DNA使用Ezup 柱式细菌基因组 DNA 抽提试剂盒提取。将提取出来的DNA进行PCR扩增,目标产物在150 V、100 mA条件下电泳20 min,根据电泳条带判断PCR扩增是否成功。将扩增成功的目标产物纯化、测序,测序结果与NCBI数据库比对分析,使用MEGA7.0软件构建系统发育树。
1.8 孵育时间对DON降解的影响
将接种在LB培养基中的单菌落于37 ℃、150 r/min培养24 h,在发酵培养基中接种1%的菌液后继续培养48 h。在1.5 mL离心管中加入950 μL 的发酵液和50 μL的 DON标准品,使DON终质量浓度为5 μg/mL,使用HPLC检测37 ℃、150 r/min条件下培养12、24、36、48、72 h的DON降解率。
1.9 细菌细胞及上清液对DON降解的影响
使用低温离心机将发酵液在4 ℃、12 000 r/min离心10 min,收集上清液;菌体沉淀用磷酸缓冲盐溶液(PBS)洗涤2遍后加入5倍的PBS形成菌体悬浮液;收集部分菌体悬浮液使用超声波细胞破碎仪(输出功率360 W、裂解10 s、间隔10 s、总时间30 min)进行破碎,将破碎之后的菌体悬浮液4 ℃、12 000 r/min离心15 min,保留上清液得到胞内提取物。将950 μL的上清液、菌体悬浮液和胞内提取物与50 μL的 DON标准品混合,37 ℃摇床150 r/min 孵育48 h。对照组为发酵培养基和PBS,每组设置3个平行,使用HPLC检测DON降解率。
1.10 经蛋白酶k、热处理后的上清液对DON降解的影响
上清液中加入1 mg/mL 蛋白酶k,37 ℃混合培养12 h,加入50 μL DON标准品(100 μg/mL),设置3个平行,37 ℃摇床150 r/min 孵育48 h。将上清液在100 ℃水浴中加热10 min后与50 μL(100 μg/mL)DON标准品混合均匀,设置3个平行,37 ℃摇床150 r/min 孵育48 h,然后用HPLC检测DON降解率。
1.11 Vel-HNGD-F2菌株及上清液对禾谷镰刀菌的拮抗作用
采用皿内平板对峙法[23],将5 mm的禾谷镰刀菌接种在PDA平板中央处,取长势良好的筛选菌的单菌落接种在PDA平板周围4个点上。27 ℃恒温箱中培养72 h后观察禾谷镰刀菌的生长情况,并计算抑菌率。
将培养48 h的菌体发酵液6 000 r/min离心10 min,用0.22 μm滤膜过滤除去残留菌体得到上清液。将PDA培养基和上清液按体积比9∶ 1混合摇匀,倒入培养皿中,以相同比例的发酵培养基代替上清液作为空白对照,在混合均匀的PDA平板中央接种5 mm的禾谷镰刀菌菌饼,27 ℃恒温培养72 h后观察禾谷镰刀菌在培养基上的生长情况。
2 结果与讨论
2.1 DON 降解菌的筛选与鉴定
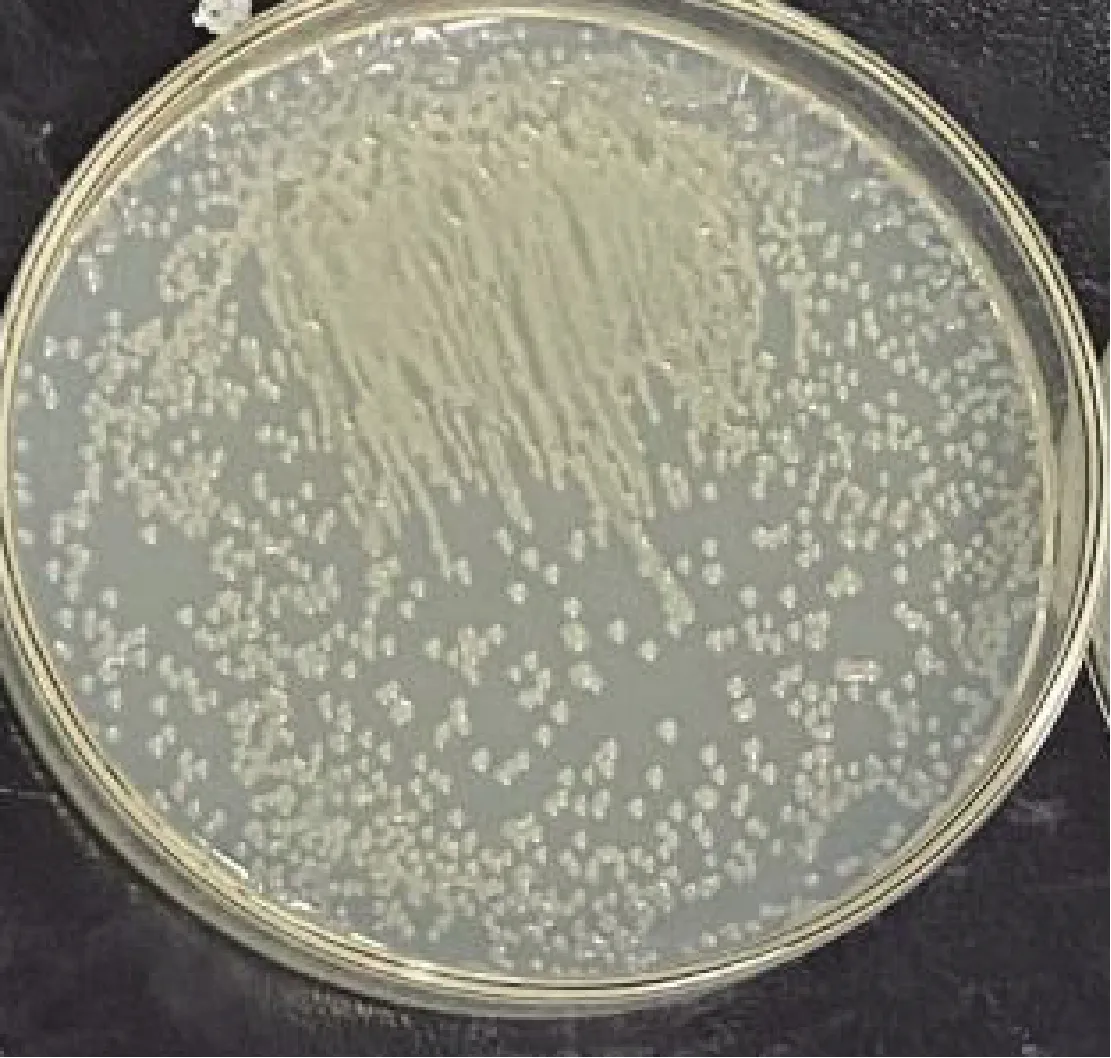
图1 菌株Vel-HNGD-F2的菌落形态Fig.1 Colony morphology of strain Vel-HNGD-F2
从猪肠道微生物中分离得到1株能够高效降解DON的菌株,命名为Vel-HNGD-F2。从图1可以看出,Vel-HNGD-F2为单菌落,呈凸起状,浅黄色且不透明,菌落表面干燥,边缘不光滑,这与缪伏荣等[24]观察到的结果一致。菌株经过革兰氏染色后用显微镜观察(图2),该菌株呈椭圆短杆状、紫色,说明Vel-HNGD-F2为革兰氏阳性菌。参照《常见细菌系统鉴定手册》对Vel-HNGD-F2菌株进行生理生化分析测试,结果见表1。图3为PCR扩增产物的凝胶电泳图,可以看到在大约1 500 bp处出现一条清晰的扩增条带,说明扩增产物的序列长度为1 500 bp左右。将得到的基因序列与NCBI数据库进行基因比对分析可知,菌株Vel-HNGD-F2与芽孢杆菌属同属一大分支,其16 S rDNA与贝莱斯芽孢杆菌有100%序列同一性。根据构建的系统发育树(图4)进一步确定Vel-HNGD-F2为贝莱斯芽孢杆菌。

图2 菌株Vel-HNGD-F2革兰氏 染色后的形态Fig.2 Morphology of strain Vel-HNGD-F2 after gram staining

表1 菌株Vel-HNGD-F2生理生化鉴定结果Table 1 Physiological and biochemical identification of strain Vel-HNGD-F2
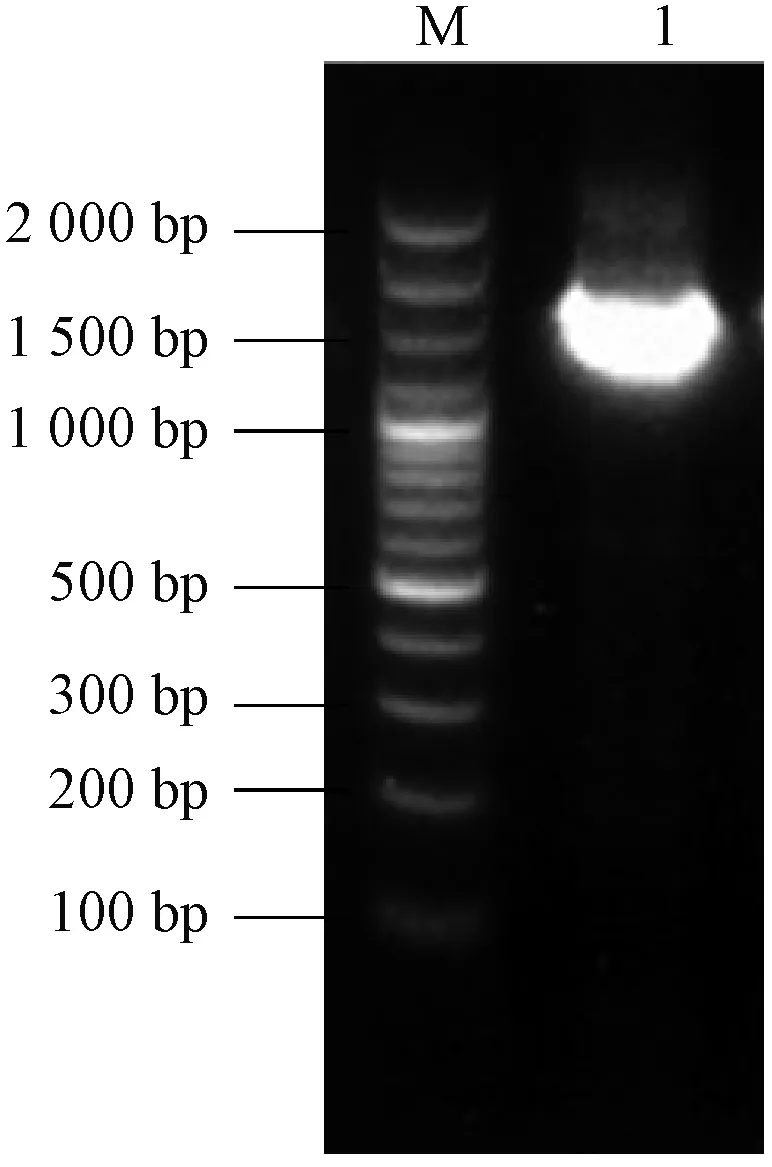
注:M为Marker;1为Vel-HNGD-F2的PCR产物。图3 菌株Vel-HNGD-F2的PCR扩增 产物电泳图Fig.3 Electrophoresis of PCR amplification products of strain Vel-HNGD-F2
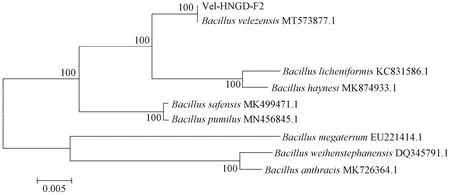
图4 菌株Vel-HNGD-F2及相关菌群16S rDNA基因序列构建的系统发育树Fig.4 Phylogenetic tree of Vel-HNGD-F2 and 16S rDNA gene sequences of related strains
2.2 贝莱斯芽孢杆菌对DON的降解效果
菌株Vel-HNGD-F2对DON的降解效果见图5,DON的保留时间在6 min左右,试验组与对照组相比DON含量明显下降。由图6可知,菌株Vel-HNGD-F2对DON的降解是一个快速而且连续的过程,12 h内Vel-HNGD-F2可以快速降解DON,降解率达到60.0%,36 h后降解率趋于稳定,72 h降解率达到76.7%。可能是由于菌株Vel-HNGD-F2在培养发酵过程产生大量降解物质使降解速率在12 h内快速增长,当发酵液中降解物质的降解能力达到最大限度时,降解效果趋于稳定,这与窦勇等[25]的试验结果非常相似。

图5 菌株Vel-HNGD-F2对DON的降解效果Fig.5 Degradation effect of strain Vel-HNGD-F2 on DON

图6 菌株Vel-HNGD-F2不同孵育时间 对DON的降解率Fig.6 Degradation rate of DON by strain Vel-HNGD-F2 at different incubation time
2.3 贝莱斯芽孢杆菌对DON的降解特性
为了探究菌株Vel-HNGD-F2对DON的降解特性,将培养48 h的发酵液离心后收集上清液,同时收集用PBS悬浮的菌体悬浮液和通过细胞破碎收集的胞内提取物,分别检测其降解DON的能力。由图7可知,孵育48 h,上清液对DON的降解率达到58.9%,菌体悬浮液和胞内提取物对DON的降解率只有5.98%和6.26%。说明菌株Vel-HNGD-F2对DON的降解主要来自分泌的胞外活性物质,并不是菌体的吸附作用,与付苗苗等[26]的研究结果相似。为了进一步探究菌株的降解特性,将上清液与蛋白酶k混合处理12 h之后,再与DON混合孵育,发现降解率降低了14.5个百分点,可能是蛋白酶k的处理抑制了酶的作用活性导致降解率降低,因此进一步推测对DON降解的活性物质主要来自于菌株Vel-HNGD-F2分泌的胞外酶,与付苗苗等[26]研究结果一致。上清液经过100 ℃水浴处理10 min后,DON的降解率下降了11.2个百分点,推测可能是高温处理破坏了酶的结构,降低了酶的活性,造成胞外酶对DON的降解率下降。在许多情况下,微生物对真菌毒素的降解主要是靠酶活性,例如孟玲玲[27]将NJA-1菌中的DON降解酶基因表达在毕赤酵母中,得到的毕赤酵母对DON的降解率达到50%;He等[28]筛选得到1株德沃斯氏菌,能够使DON的C3位异构化3-epi-DON,且其降解酶及基因也已明确,在48 h内DON的降解率达到88%;计成等[29]将德沃斯氏菌添加到被污染饲料中,DON的降解率达到86.19%。这些研究表明微生物对DON降解主要是通过酶的作用,对农业和食品业都有重要的应用价值。

图7 菌株发酵液不同组分和上清液经蛋白酶k、 加热处理后DON的降解率Fig.7 Degradation rate of DON by different components of strain fermentation broth and after protease K and heating treatment of the supernatant
2.4 贝莱斯芽孢杆菌及上清液对禾谷镰刀菌的拮抗作用
从图8可以看出,对照组中的禾谷镰刀菌生长良好,菌丝铺满整个平板,将Vel-HNGD-F2接种在PDA四角之后可以观察到,禾谷镰刀菌在Vel-HNGD-F2周围的生长受到明显抑制,产生了抑菌圈(试验组),抑菌率达到了56.2%,出现这一现象的原因可能是Vel-HNGD-F2分泌产生了抑制禾谷镰刀菌的代谢物质。已有研究表明,芽孢杆菌能有效地控制有害真菌的生长发育,短小芽孢杆菌能有效抑制碳曲霉在PDA培养基上的生长和碳曲霉浆果腐病的发生[30]。这些结果与本试验观察到的结果一致。
将Vel-HNGD-F2上清液添加到PDA培养基后,禾谷镰刀菌生长明显受到了抑制,由图9可以看到菌丝大幅减少,经计算抑菌率为63.2%。推测可能是Vel-HNGD-F2能够代谢产生抑制禾谷镰刀菌的胞外活性物质,使用上清液与培养基混匀后,Vel-HNGD-F2产生的胞外活性物质在其中发挥作用,导致禾谷镰刀菌生长受到抑制。
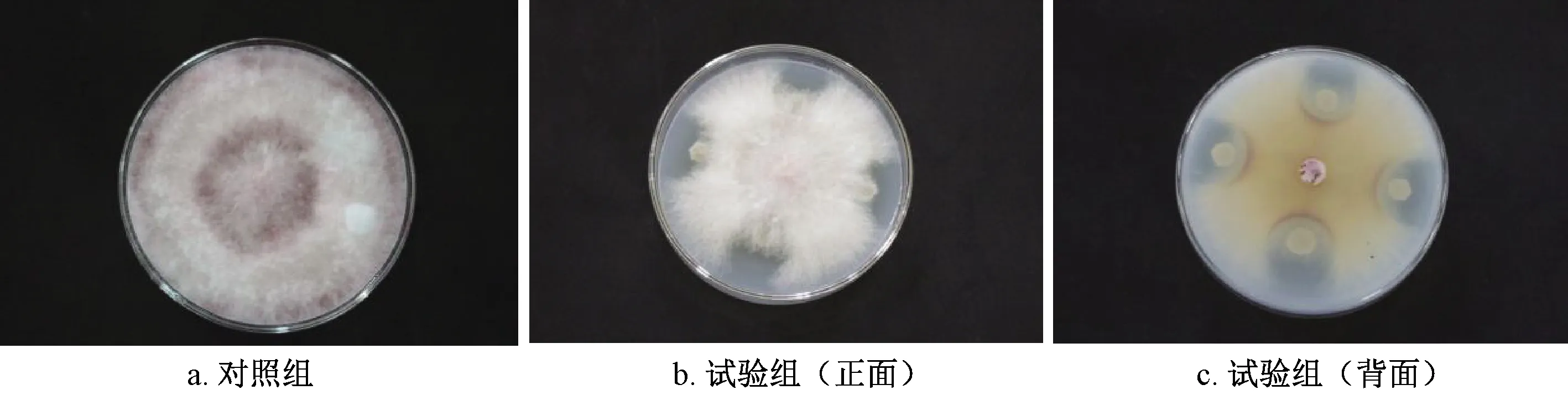
图8 菌株Vel-HNGD-F2对禾谷镰刀菌的抑制Fig.8 Inhibition of strain Vel-HNGD-F2 against Fusarium graminis
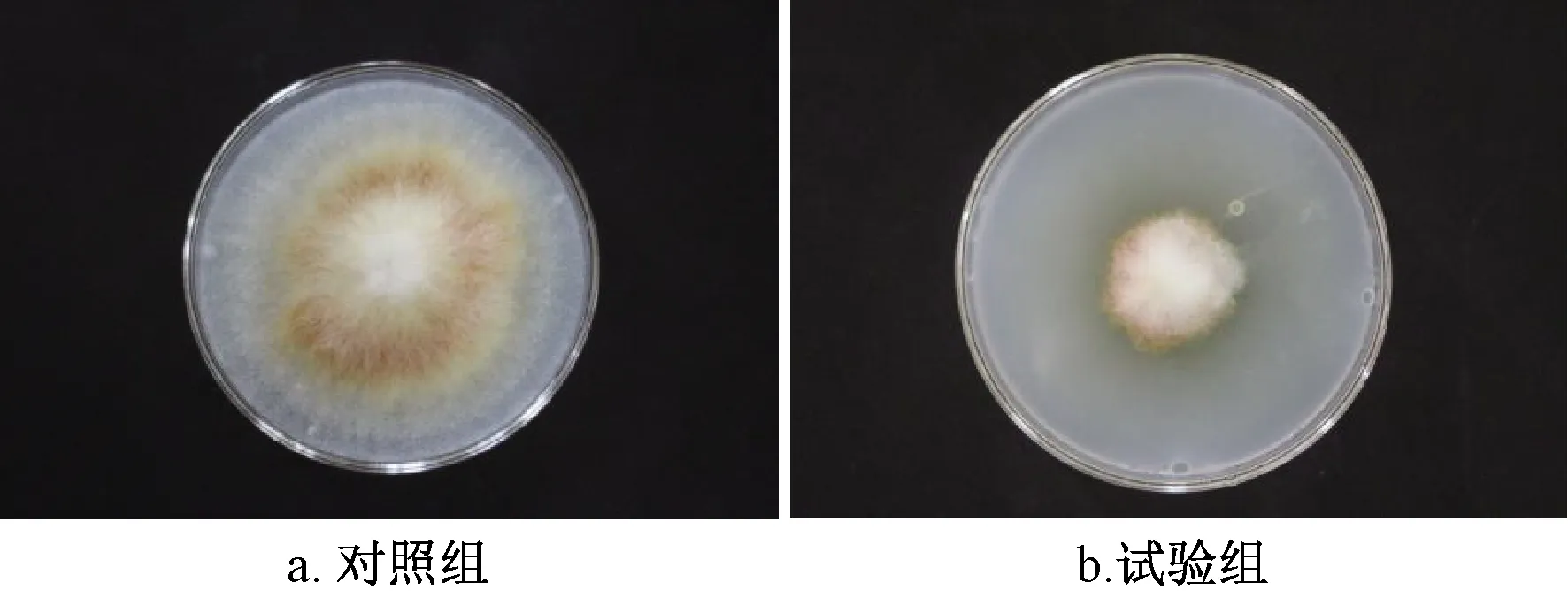
图9 菌株Vel-HNGD-F2上清液对禾谷镰 刀菌的抑制Fig.9 Inhibition of supernatant of strain Vel-HNGD-F2 against fusarium graminis
3 结论
从猪肠道微生物中筛选得到1株具有降解DON能力的贝莱斯芽孢杆菌Vel-HNGD-F2,该菌72 h对DON的降解率为76.7%,菌体悬浮液和胞内提取物对DON的降解率为5.98%和6.26%,推测Vel-HNGD-F2可以产生降解DON的胞外酶。此外菌株Vel-HNGD-F2还可以对禾谷镰刀菌的生长进行抑制,能够为禾谷镰刀菌所造成的病害提供生物防治的理论基础。已经确定了一些降解DON的酶,如醛酮还原酶和乙酰转移酶,本研究尚未确定胞外酶的种类,在后续的试验中可以继续研究胞外酶,挖掘其基因并进行外源克隆表达,开发出能够应用于饲料和食品的生物脱毒酶制剂。
