非小细胞肺癌不同样本中EGFR 基因突变、PD-L1表达检测的一致性
2022-07-11师艺马文梅刘婷张巍
师艺,马文梅,刘婷,张巍
新疆医科大学第一附属医院病理科,乌鲁木齐 830000
肺癌是全球发病率和病死率最高的恶性肿瘤[1],85%以上的肺癌为非小细胞肺癌(NSCLC),其中有2/3 的肺癌患者确诊时已是晚期,失去最佳手术时机,且放化疗效果不佳,5 年生存率仅为15%左右[2]。近年来,随着精准医疗的出现,靶向治疗如靶向表皮生长因子受体(EGFR)的酪氨酸激酶抑制剂(TKI)、免疫治疗如免疫检查点抑制剂的临床应用极大的改善了晚期NSCLC 患者的预后[3]。但使用EGFR-TKI 或者免疫检查点抑制剂的前提条件是检测EGFR 基因突变类型或者程序性死亡配体1(PD-L1)表达水平。肿瘤组织检测是肺癌诊断的金标准,但晚期患者难以获得实体肿瘤组织,而穿刺样本存在一定局限性,如采样错误或肿瘤细胞含量低。此外,临床需要重复采样来监测治疗效果或与耐药性相关的变化从而调整药物,但重复组织采样对患者来说难以承受[4]。因此,对于非侵入性的体液标本的需求日益增多,尤其对于无法进行活检或无法获得足够组织的患者,体液标本是唯一可用于基因检测的样本类型。胸腔积液和血液是除肿瘤组织外可用于EGFR 基因突变检测的样本[5],另外也有研究表明NSCLC 患者胸腔积液标本可以检测PD-L1 的表达[6]。因此,本研究通过检测NSCLC 患者肿瘤组织、血液、胸腔积液中EGFR 的突变情况,以及肿瘤组织、胸腔积液细胞中PD-L1的表达,分析不同样本类型检测结果的一致性和差异性,为指导NSCLC患者精准靶向治疗和免疫治疗提供参考。
1 资料与方法
1.1 临床资料 选取2020 年6 月—2021 年6 月于本院就诊的NSCLC 患者150 例,其中男88 例,女62例;年龄27~90 岁,中位年龄62 岁。纳入标准:病理检查诊断为肺腺癌;同时满足有肿瘤组织、胸腔积液及血液样本;肿瘤组织、胸腔积液和血液样本同一天获取。患者知情同意,本研究经过医院医学伦理委员会批准(220610-02)。
1.2 胸腔积液细胞蜡块制备 胸腔积液样本静置后,取底部样本20 mL,2 000 r/min 离心5~10 min,半径为12.4 cm,吸干上清液。加入4%中性缓冲甲醛液混匀,2 000 r/min 离心5 min,半径为12.4 cm,吸干上清液,轻轻沿管壁加入95%乙醇,静置1~2 h,用尖头的硬签将沉淀物挑出,放入包埋盒,经过固定、脱水,石蜡包埋成细胞蜡块。
1.3 肿瘤石蜡组织、胸腔积液细胞蜡块及血浆游离DNA 提取 肿瘤石蜡组织和胸腔积液细胞蜡块(肿瘤组织所占切片率>30%)中切取4~5 μm 厚的切片,切片依次放入二甲苯缸中进行脱蜡,然后依次放入无水乙醇缸中洗脱二甲苯,水冲洗切片,用一次性刀片将肿瘤组织刮入1.5 mL EP 管中,按照QIAamp®DNA FFPE Tissue Kit 试剂盒(德国Qiagen公司)说明书提取DNA,加入Buffer DTL、Protease K Solution,于56 ℃消化1 h,加入Buffer DES,于90 ℃孵育1 h。液体转移到DNA 吸附柱中离心后,加入Buffer DTE 静置离心,收集DNA。血浆游离DNA 按照QIAamp® MinElute®ccfDNA Midi Kit 试 剂 盒(Qiagen 公司,德国)说明书提取血液样本DNA,将磁珠悬浮液、蛋白酶K、磁珠结合溶液与患者血浆混合,室温孵育10 min,置于磁力架上吸附至溶液透明,弃去上清,加入200 μL 洗脱溶液,振荡混匀后,置于磁力加上吸附至溶液透明,将上清转移至新的EP 管中,加入300 μL Buffer ACB 混匀后,将溶液加入UCP MinElute Column 中,6 000 g 离心1 min,加入500 μL buffer ACW2 至 吸 附 柱 中,6 000 g 离 心1 min,20 000 g离心3 min。将吸附柱转移至新的EP管中,56 ℃下开盖晾3 min,随后加入20~80 μL 去离子水至吸附柱中央,室温孵育1 min,20 000 g 离心1 min 收集DNA 溶液。DNA 提取完成后采用超微量紫外分光光度计检测DNA 浓度及OD260/OD280,OD260/OD280值1.8~2.0。
1.4 肿瘤组织、胸腔积液及血液中EGFR 基因突变检测 采用扩增阻遏突变系统-实时荧光定量聚合酶链反应。取肿瘤组织、胸腔积液及血液标本,人类EGFR 突变基因检测试剂盒购自厦门艾德生物医药科技股份有限公司,试剂盒采用的8连PCR 条设计,主要检测EGFR 外显子18、19、20 和21 位点中常见的突变类型,包含19-Del、L858R、T790M、G719X、S768I 和L861Q 突变等,每个PCR 反应管内均含有5~10 pmol/L 特异性引物、20 pmol/L 双环探针、
12.5 μmol/L dNTPs、175 μmol/L 氯化镁、1 mmol/L硫酸铵、2.5 mmol/L 氯化钾和纯化水等。通过ABI7500 实时荧光PCR 仪进行检测。反应条件:95 ℃10 min;95 ℃40 s、64 ℃40 s、72 ℃30 s,15 个循环;93 ℃40 s、60 ℃45 s、72 ℃30 s,28 个循环。60 ℃时收集FAM/ROX/CY5(VIC)信号。按照试剂盒说明书提供的判读原则确定样本EGFR 基因突变类型。
1.5 肿瘤组织及胸腔积液中PD-L1 蛋白表达检测 采用免疫组化法。将石蜡切片68 ℃烤片20 min 后,常规脱蜡复水,3%H2O2室温孵育10 min,灭活内源性过氧化物酶。将稀释后的胰蛋白酶滴加到组织上抗原修复后,用含5%BSA 封闭液封闭,滴加适当比例稀释(1∶200)的PD-L1 兔单克隆抗体,4 ℃孵育过夜;PBS 清洗,加入HRP 标记的二抗孵育30 min;PBS 清洗后,DAB 显色,在显微镜下观察棕色深浅,当颜色达到最优后用自来水冲洗;苏木素复染;随后脱水、封片、固片;显微镜下观察并照相、记录。结果判定标准:由三位病理医师对检测结果进行评估。显微镜下随机取5 个视野,用阳性细胞百分比≥50%为高表达,1%≤阳性细胞百分比<50%为低表达,阳性细胞百分比<1%为无表达。
1.6 统计学方法 采用SPSS24.0 统计软件。计数资料比较采用χ2检验、Fisher’s精确概率法;不同样本类型检测结果一致性用Kappa检验,Kappa>0.75 为一致性较好,0.4≤Kappa≤0.75 为一致性一般,Kappa<0.4为一致性差。P<0.05为差异有统计学意义。
2 结果
2.1 各样本中EGFR基因突变检测的一致性 ①肿瘤组织中共检测出52 例EGFR 基因突变,突变率为34.67%(52/150),突变类型包括19-del、L858R、T790M 及18 外 显子G719X 和20 外 显子S768I 共 突变,分别占50%(26/52)、46.15%(24/52)、1.92%(1/52)、1.92%(1/52)。②胸腔积液中共检测出44例EGFR 基因突变,基因突变率为29.33%(44/150),突变类型包括19-del、L858R、T790M 及18 外显子G719X 和20 外显子S768I 共突变,分别占
45.45 %(20/44)、50%(22/44)、2.27%(1/44)、2.27%(1/44)。③血液中共检测出40例EGFR 基因突变,基因突变率为26.67%(40/150),突变类型包括19-del、L858R 及18 外 显 子G719X 和20 外 显 子S768I 共突变,分别占50%(20/40)、47.5%(19/40)、2.5%(1/40),但血液有1 例T790M 突变患者未检出。各样本中EGFR 基因突变类型检出情况比较差异无统计学意义(P均>0.05)。
150 例NSCLC 患者中,胸腔积液与肿瘤组织中EGFR 基因突变检测结果一致142 例,不一致8 例;血液与肿瘤组织中EGFR 基因突变检测结果一致138 例,不一致12 例;胸腔积液与血液中EGFR 基因突变检测结果一致146 例,不一致4 例。胸腔积液、血液与肿瘤组织中EGFR 基因突变检测结果一致性较好(Kappa分别为0.878、0.813,P均<0.05);胸腔积液与血液中EGFR 基因突变检测结果一致性较好(Kappa=0.934,P<0.05)。见表1、2。
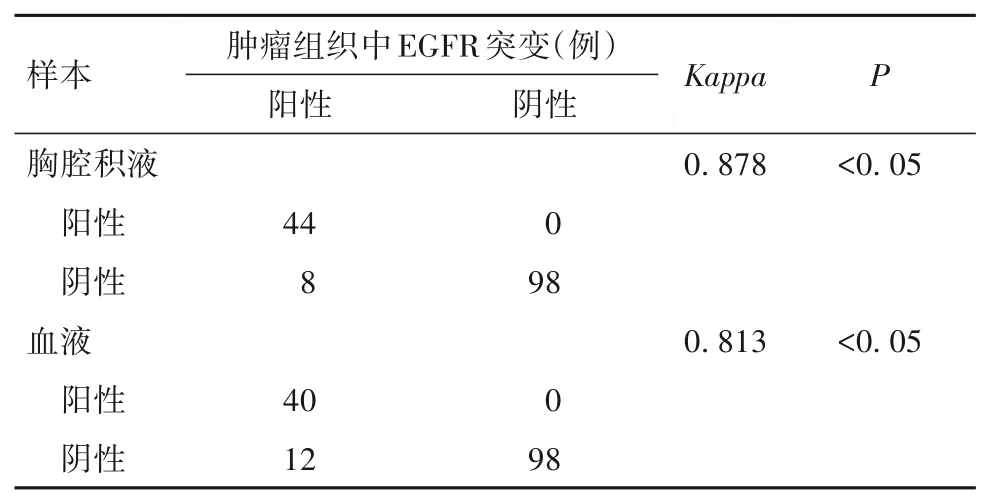
表1 胸腔积液、血液与肿瘤组织样本中EGFR基因突变检测结果的一致性
2.2 胸腔积液与肿瘤组织中PD-L1 蛋白表达一致性比较 以阳性细胞百分比≥50%为阈值时,肿瘤组织中PD-L1 蛋白阳性表达率为16.67%(25/150),胸腔积液中PD-L1 蛋白阳性表达率为4.67%(7/150)。以肿瘤组织样本阳性结果为真阳性,则胸腔积液检测结果为假阴性19例、假阳性1例,胸腔积液与肿瘤组织中PD-L1 蛋白表达检测结果一致率为86.67%(130/150),一致性较差(Kappa=0.326,P>0.05)。
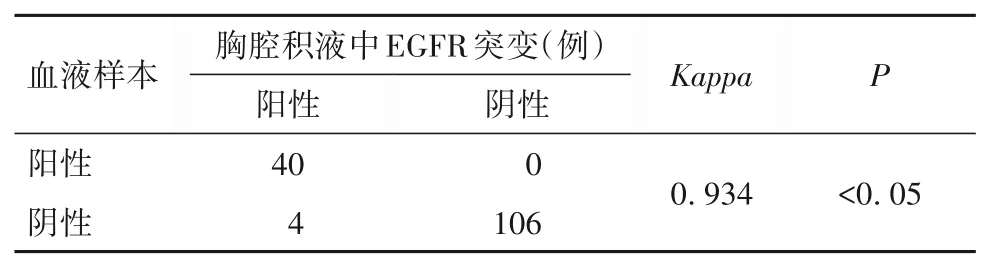
表2 血液与胸腔积液中EGFR基因突变检测结果的一致性
以阳性细胞百分比≥1%为阈值时,肿瘤组织中PD-L1 蛋白阳性表达率为60.6%(91/150),胸腔积液中PD-L1 蛋白阳性表达率为28.67%(43/150)。当以肿瘤组织阳性结果为真阳性,则胸腔积液检测结果为假阴性48例、假阳性3例,胸腔积液与肿瘤组织中PD-L1 蛋白表达检测结果一致率为66%(99/150),一致性较差(Kappa=0.367,P>0.05)。
3 讨论
NSCLC 的精准治疗在所有实体肿瘤治疗中是发展较快,接受传统化疗的转移性NSCLC 患者5 年相对生存率只接近6%,但是接受靶向治疗或免疫检查点抑制剂治疗的转移性NSCLC患者的5年相对生存率提高至15%~50%[7]。驱动基因突变以及PD-L1表达检测是决定患者选择治疗方法及治疗药物的前提条件。合适的样本类型对于快速、准确的检测患者驱动基因突变以及PD-L1 表达,筛选出适合靶向治疗和免疫治疗的患者具有重要的临床意义。
目前NSCLC 诊断样本类型多为肿瘤组织,但高达30%的晚期NSCLC 患者无任何可用的组织标本;除此之外,肿瘤组织样本类型不适合多次采样,难以用于动态监测驱动基因突变情况和检测靶向治疗是否出现耐药,无法指导临床适时调整患者治疗方案。因此,对于无法获得肿瘤组织的患者,亟需寻找新的检测样本类型。研究表明,血液样本中的循环游离DNA(cfDNA)可用于驱动基因突变检测。另外,胸腔积液是晚期NSCLC 患者常见并发症,是肿瘤细胞的常见来源,也是驱动基因突变检测的重要样本类型[9]。血液和胸腔积液样本可以通过相对无创的方式重复获取,对于无法获取组织标本的NSCLC 患者而言,血液和胸腔积液样本用于EGFR基因突变检测不失为一个不错的选择。本研究对150 例同时有肿瘤组织、胸腔积液和血液样本的NSCLC患者的EGFR基因突变进行分析,EGFR基因突变率为34.67%,EGFR 突变类型主要为19-del 和L858R,不同样本类型检出均无差异。除此之外,血液、胸腔积液和肿瘤组织样本均检测出一例EGFR 18 外显子G719X 和20 外显子S768I 共突变。黄建等[10]研究表明,胸腔积液与肿瘤组织样本检测EGFR 基因突变状态一致性极好,而血液与肿瘤组织样本检测EGFR 基因突变一致性良好。但本研究结果中,胸腔积液、血液与配对肿瘤组织样本检测EGFR 基因突变状态一致性均极好;但与胸腔积液样本相比较,血液样本有4 例患者未检测出EGFR基因突变,尤其是1 例EGFR T790M 突变患者在肿瘤组织和胸腔积液细胞蜡块中均被检测出,在血液样本中未检测出该突变,造成血液样本漏检的原因可能是血液中cfDNA 浓度较低,未达到ARMS 法检测EGFR 基因突变的检测下限[11]。仍需要灵敏度更高的方法来进一步确定血液样本检测EGFR 基因突变的可行性。张平等[12]利用高通量测序技术比较了肺腺癌患者胸腔积液、腹水、心包积液和脑脊液中EGFR 基因突变状态,发现这些体液样本的上清游离DNA 的EGFR 基因突变丰度显著高于体液沉积肿瘤细胞和血浆游离DNA 样本,其中血浆cfDNA 检出率最低,在肿瘤部位附近采集的体液或细胞学样本的基因突变丰度高于血浆cfDNA。由此可见,虽然血液和胸腔积液样本与肿瘤组织的EGFR 基因突变检测结果一致性均极好,但从检出率的角度来说,血液样本劣于胸腔积液样本,所以对于难以获得肿瘤组织且伴有胸腔积液并发症的NSCLC 患者,可以优先考虑胸腔积液样本作为EGFR 基因突变检测首要样本。
免疫检查点抑制剂对无靶向基因突变的NSCLC 患者治疗有效,已经成为靶向治疗耐药和化疗耐药的晚期转移性NSCLC 患者的标准疗法。检测肿瘤组织表面PD-L1表达是筛选潜在接受免疫检查点抑制剂治疗的获益人群的重要标准,目前免疫组织化学法检测肿瘤组织PD-L1表达是检测的金标准。胸腔积液中也包含大量的肿瘤细胞,虽然胸腔积液样本在靶向驱动基因突变检测应用已经得到临床认可,但是否可以作为PD-L1 表达检测的样本类型用于筛选免疫治疗获益人群目前还未有统一说法。血液中循环肿瘤细胞(CTC)可以用来检测PD-L1蛋白表达,但血液中CTC 含量极低,需要对CTC 进行富集处理,操作过程较复杂,且目前试剂盒较少。除此之外,CTC 中PD-L1 阳性表达的结果判读还未有明确的指南推荐。本研究考虑到成本及结果判读的难度,未做血液样本的PD-L1 蛋白表达检测。在本研究中,通过免疫组织化学分析了150 例NSCLC 患者肿瘤组织样本和配对胸腔积液细胞蜡块样本中PD-L1 表达水平,其中肿瘤组织中PD-L1 高表达率为16.67%,胸腔积液细胞蜡块样本中PD-L1高表达率为4.67%,这与相关研究的PD-L1 在胸腔积液样本中表达率为3.5%的结论基本一致[13]。但是低于马海玥等[14]的研究结果。造成这种不同结果的原因可能是,不同实验室检测PD-L1 表达所使用的的检测平台,抗体种类有所不同,除此之外,不同实验室在制备胸腔积液细胞蜡块过程中选择固定剂类型、固定时间的长短以及制备方法都存在一定的差异。当以阳性细胞百分比≥50%为阈值时,肿瘤组织和胸腔积液细胞蜡块样本的一致性为86.67%;但是当以阳性细胞百分比≥1%为阈值时,两种样本类型的一致率降低至66%,一致性为0.367。表明低阳性细胞百分比阈值筛选阳性样本可能会造成误判,这与叶伟等[15]的研究结果相似。但是GROSU 等[16]通过比较NSCLC 患者肿瘤组织样本和配对的胸腔积液细胞块样本中的PD-L1 表达情况,检测结果一致性为0.78,一致性极好。另外,在本研究中,当以阳性细胞百分比≥50%为阈值时,有1 例患者的胸腔积液细胞蜡块和肿瘤组织样本中PD-L1表达结果不一致。当以阳性细胞百分比≥1%为阈值时,有3 例患者患者胸腔积液细胞学样本PD-L1 表达阳性,而肿瘤组织样本表达阴性,这可能是肿瘤异质性造成的,有研究表明,使用相同的实验平台和检测抗体,在NSCLC 患者同一肿瘤组织蜡块的不同切片中检测PD-L1 表达,得到的结果也不尽相同[17],可见同一瘤体内存在着细胞的异质性。胸腔积液是晚期NSCLC 患者转移样本,而组织样本是多为患者的原发灶,由于NSCLC 细胞异质性,可能有些组织样本PD-L1 表达阴性患者在转移胸腔积液细胞学样本中PD-L1 阳性,因此,胸腔积液细胞学样本可以筛选出一部分肿瘤组织样本PD-L1阴性但适合免疫检查点抑制剂治疗的患者。但是胸腔积液细胞学样本中评估PD-L1的表达仍具有很多挑战,例如,胸腔积液细胞学样本中含有大量的非肿瘤细胞,如巨噬细胞、间皮细胞和炎症细胞等,这些细胞也会表达部分PD-L1,影响结果。虽然有研究提示,树突状细胞和巨噬细胞的PD-L1 表达量均与免疫检查点抑制剂疗效相关,非肿瘤细胞PD-L1 表达量越高疗效越好[18]。但还需要大量研究进一步证实。除此之外,胸腔积液中的肿瘤细胞数量也会影响PD-L1 检测结果,研究发现,在少于100个细胞的细胞块中,检测结果与相应的手术标本的检测结果一致性较低[19]。
综上所述,血液、胸腔积液标本检测EGFR 基因突变与肿瘤组织标本相比具有较好的一致性,并且胸腔积液和血液样本可以多次、微创采取,在肿瘤组织缺乏时,可以考虑采用血液、胸腔积液标本进行EGFR 基因检测。另外PDL-1 在胸腔积液中的表达与肿瘤组织检测结果一致性差,可能在制备细胞蜡块过程中试剂的选择以及处理方式都需要优化,仍需要大量研究来探讨针对细胞学样本进行PD-L1免疫组织化学检测的规范化操作。
