药物联合方案治疗小儿癫痫临床疗效及其对高迁移率族蛋白-1、Toll样受体4水平影响
2022-07-08郝立成张淑敏
金 超, 董 琰, 张 双, 郝立成, 陈 娜, 张淑敏
唐山市妇幼保健院 儿内科,河北 唐山 063000
癫痫高发阶段为1~10岁的儿童期,发病机制复杂,目前认可度较高的发病核心为中枢神经系统的抑制与兴奋失衡,多与炎症反应、神经递质、神经胶质细胞、遗传等因素有关[1]。有研究发现,Toll样受体(Toll-like receptor,TLR)能够结合机体内一些内源性分子,介导多种神经系统疾病[2]。TLR家族共有13个成员,有研究报道,在癫痫患儿胶质细胞、小胶质细胞及广泛区域均可检测到TLR4[3]。高迁移率族蛋白(high-mobility group box, HMGB)有3个亚型,其中HMGB-1主要参与基因的复制、调控、转录等生物过程[4]。HMGB-1为促炎因子,可刺激免疫细胞和神经胶质细胞活化,并进行大量分泌[5]。HMGB-1、TLR4水平与癫痫发病有关[6]。左乙拉西坦与奥卡西平均为新型抗癫痫药物,两者相比传统的抗癫痫药物不良反应更低,对认知损害的不良反应较轻。本研究旨在探讨左乙拉西坦与奥卡西平联合方案治疗小儿癫痫的临床疗效及其对HMGB-1、TLR4水平的影响。现报道如下。
1 资料与方法
1.1 一般资料 选取自2018年1月至2020年1月于唐山市妇幼保健院就诊的180例癫痫患儿为研究对象。按随机数字表法将患儿分为A、B两组,每组各90例。A组中,男性52例,女性38例;年龄5~12岁,平均年龄(7.22±1.39)岁;病程0.8~6.0年,平均(3.51±1.07)年;癫痫分类:部分性42例,全面性48例;发作频率每年1~5次,平均每年(3.05±0.47)次;发作类型:单纯局限性发作12例,复杂局限性发作19例,继发性全身性42例,强直性17例;病灶部位:额叶42例,颞叶27例,顶叶14例,枕叶7例。B组中,男性50例,女性40例;年龄4~14岁,平均年龄(6.88±2.12)岁;病程0.6~6.0年,平均(3.68±1.26)年;癫痫分类:部分性40例,全面性50例;发作频率每年1~6次,平均每年(3.41±0.68)次;发作类型:单纯局限性发作11例,复杂局限性发作18例,继发性全身性45例,强直性16例;病灶部位:额叶39例,颞叶26例,顶叶15例,枕叶10例。两组患儿一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。所有患儿家属均签署知情同意书。
1.2 纳入与排除标准 纳入标准:符合《临床诊疗指南:癫痫病分册》中癫痫诊断标准[7];年龄5~16岁;既往单药治疗失败,且未应用过左乙拉西坦与奥卡西平治疗。排除标准:有明确诱因的急性癫痫发作;合并严重的精神疾病;治疗前存在严重认知功能障碍;存在脑部器质性病变;存在进行性神经系统疾病;合并肿瘤;依从性极差,无法配合完成研究。
1.3 治疗方法 A组接受单药治疗,奥卡西平(北京诺华制药有限公司,国药准字:J20140103,规格:0.3 g)水吞服,起始剂量8 mg/(kg·d),分2次服用。每日剂量根据临床效果及耐受性逐渐递增,最大剂量60 mg/(kg·d),剂量以最小有效剂量为最佳。B组接受药物联合方案治疗,在A组的基础上加用左乙拉西坦[优时比(珠海)制药有限公司,国药准字:HJ20160254,规格:0.5 g]水吞服,体质量<50 kg起始剂量20 mg/(kg·d),分2次给药;体质量≥50 kg起始剂量500 mg/次,2次/d。每日剂量根据临床效果及耐受性逐渐递增,体质量<50 kg最大剂量60 mg/(kg·d),体质量≥50 kg最大剂量1 500 mg/d,剂量以最小有效剂量为最佳。所有患儿均进行为期1年的随访观察。
1.4 观察指标 (1)根据癫痫发作频率评价临床疗效。1年内无发作为完全控制;发作频率较治疗前减少>50%为显效;减少25%~50%为有效;减少<25%,无改变或增加为无效。(2)评估治疗前及治疗1年后认知功能。采用韦氏儿童智力量表第4版(WISC-Ⅳ)评估,量表分为言语理解(94分)、直觉推理(104分)、工作积极(106分)、加工速度(125分)、总智商(105分),分数越高说明认知功能越好。(3)检测治疗前及治疗1年后实验室指标。抽取患儿外周静脉血3~4 ml,分离血清置于EP管中,冰箱保存。采用酶联免疫吸附法检测HMGB-1、TLR4、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、半胱氨酸蛋白酶-1( Caspase-1 )、S-100蛋白(S100β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。(4)不良反应,包括嗜睡、心烦不安、脱发、睡眠障碍、注意力不集中、记忆障碍等。
1.5 统计学方法 采用SPSS 23.0统计学软件对数据进行处理。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例(百分率)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿临床疗效比较 A组患儿完全控制44例、显效32例、有效12例、无效2例,B组分别为65例、21例、4例、0例,B组完全控制率72.2%(65/90)高于A组的48.9%(44/90),差异有统计学意义(P<0.05)。
2.2 两组患儿WISC-Ⅳ评分比较 两组治疗后WISC-Ⅳ量表各维度评分均升高,且B组高于A组,差异有统计学意义(P<0.05)。见表1。
表1 两组患儿WISC-Ⅳ评分比较(±s,评分/分)

表1 两组患儿WISC-Ⅳ评分比较(±s,评分/分)
注:与本组治疗前比较,①P<0.05
组别言语理解 直觉推理 工作积极 加工速度 总智商治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 48.75±5.59 72.02±7.59① 55.48±6.16 80.50±8.12① 60.16±6.49 86.22±8.89① 67.19±6.83 97.40±10.07① 56.12±5.76 80.29±8.04①B组 50.17±5.89 80.48±8.09① 56.80±6.75 89.91±9.06① 61.41±6.53 94.75±10.15①66.48±6.74 112.99±13.67① 57.38±5.83 89.16±9.10①t值 1.659 7.235 1.370 7.338 1.288 5.998 0.702 8.711 1.459 6.930 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患儿神经因子、蛋白酶比较 两组治疗后NSE、S100β、Caspase-1均降低,且B组低于A组,差异有统计学意义(P<0.05)。见表2。
表2 两组患儿神经因子、蛋白酶比较(±s)

表2 两组患儿神经因子、蛋白酶比较(±s)
注:与本组治疗前比较,①P<0.05
组别NSE/U·ml-1 S100β/μg·L-1 Caspase-1/ng·ml-1治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 32.29±4.56 15.40±2.01① 1.42±0.48 0.68±0.23① 8.13±1.25 3.91±0.63①B组 31.48±4.39 13.07±1.85① 1.48±0.51 0.51±0.16① 8.20±1.37 3.00±0.37①t值 1.214 8.092 0.813 5.756 0.358 11.816 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组患儿HMGB-1、TLR4及炎症因子比较 两组治疗后HMGB-1、TLR4、TNF-α均降低,且B组低于A组,差异有统计学意义(P<0.05)。见表3。
表3 两组患儿HMGB-1、TLR4及炎症因子比较(±s)
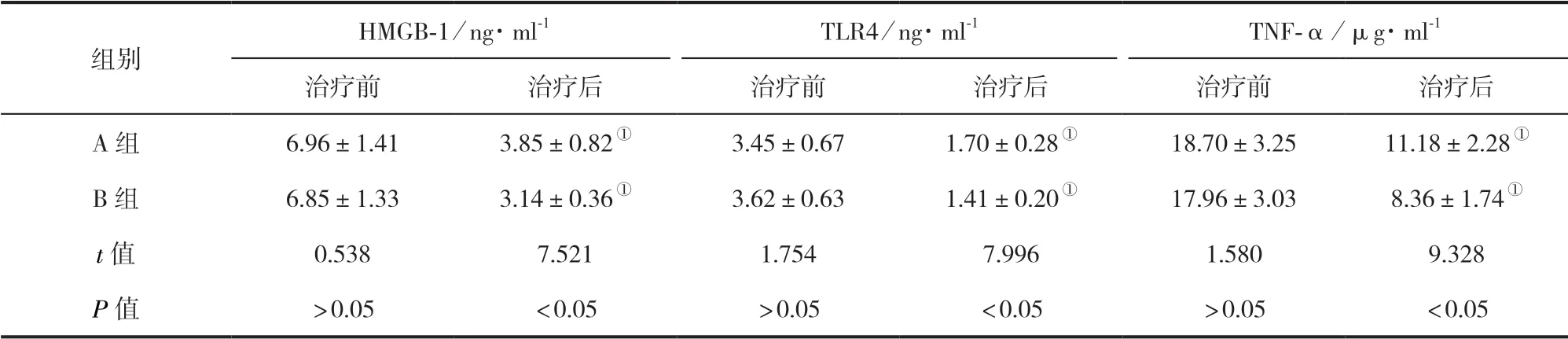
表3 两组患儿HMGB-1、TLR4及炎症因子比较(±s)
注:与本组治疗前比较,①P<0.05
组别HMGB-1/ng·ml-1 TLR4/ng·ml-1 TNF-α/μg·ml-1治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 6.96±1.41 3.85±0.82① 3.45±0.67 1.70±0.28① 18.70±3.25 11.18±2.28①B组 6.85±1.33 3.14±0.36① 3.62±0.63 1.41±0.20① 17.96±3.03 8.36±1.74①t值 0.538 7.521 1.754 7.996 1.580 9.328 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.5 两组患儿不良反应发生情况比较 两组患儿的主要不良反应包括嗜睡、心烦不安、脱发、注意力不集中/记忆障碍、眩晕、皮疹,但A组不良反应发生率13.3%(12/90)与B组18.9%(17/90)比较,差异无统计学意义(P>0.05)。
3 讨论
脑内慢性炎症是癫痫发病的机制之一,其中TNF-α、白细胞介素-1β、HMGB-1等信号通路介导的炎症反应可能发挥关键作用[8]。促炎因子不仅是激活免疫T细胞活性,调节免疫应答反应的重要因子,也在中枢神经系统病理过程、游离神经元细胞内钙离中发挥重要作用[9]。癫痫发作后,炎症因子经脑血管进入血液,诱发全身反复强直-阵挛,可引起神经元异常放电,导致中枢神经系统结构改变[10]。因此,阻断其通路可作为治疗小儿癫痫的重要靶点。
奥卡西平作为传统抗癫痫药物卡马西平的衍生物,主要通过阻断脑细胞电压依赖性Na2+通道,降低细胞内环磷酸腺苷浓度,进而稳定细胞膜的兴奋性,减少突触对兴奋冲动的传递[11]。同时,奥卡西平作用于K+通道,可阻断异常动作电位的散布[12]。另有研究报道,奥卡西平可抑制癫痫大鼠海马TNF受体超家族蛋白CD40的表达,从而抑制炎症因子的释放,最终阻止癫痫发作[13]。Suo等[14]研究认为,左乙拉西坦可通过抑制癫痫环路中的异常放电,直接阻断癫痫发作,且对正常神经元兴奋性无影响。王景立等[15]研究报道,奥卡西平联合左乙拉西坦治疗小儿癫痫可显著提高其认知功能,降低血清胶质纤维酸性蛋白及S-100β 水平,且不增加不良反应。本研究中,B组完全控制率、WISC-Ⅳ评分高于A组,提示左乙拉西坦联合奥卡西平治疗小儿癫痫的疗效高于单一左乙拉西坦治疗,认知功能改善效果较佳,与既往研究[16]结果一致,分析原因可能与左乙拉西坦的神经保护作用与抗炎、抗氧化等生物效应有关。许雪梅等[17]研究报道,左乙拉西坦可通过抑制核苷酸结合寡聚化结构域样受体家族pyrin 结构域蛋白1炎症小体的活化和氧化应激,降低Caspase-1水平,改善小鼠的认知功能。
HMGB-1是一种细胞核内结合蛋白,在中枢神经系统中主要分布在胶质细胞内,参与DNA转录及调控等过程。同时,HMGB-1还可以与对应的靶细胞表面受体相结合,启动TLR4等相关的炎症信号转导途径[18]。TLR4主要表达于星型胶质细胞、小胶质细胞,通过髓样分化因子88依赖性与非依赖性信号传导途径发挥生物学效应,其可激活NF-κB通路,使核因子κB进入细胞核内,连接相应的基因片段调控基因序列表达,从而促进TNF-α、HMGB-1等炎症因子释放,促发癫痫[19]。冉东旺[20]研究报道,癫痫患儿血清HMGB-1、TLR4水平显高于健康儿童。本研究中,B组治疗后NSE、S100β、Caspase-1、HMGB-1、TLR4、TNF-α水平低于A组,进一步推测左乙拉西坦联合奥卡西平可能通过抑制Caspase-1、HMGB-1、TLR4水平及降低炎症反应等途径发挥减轻神经系统损伤的功效。
值得注意的是,抗癫痫药物不良反应较大,常见的有嗜睡、头晕、皮疹等,即使新型抗癫痫药物可在一定程度上降低不良反应,但仍发生率仍较高。Beydoun等[21]研究认为,奥卡西平作为卡马西平的衍生物,比卡马西平具有更好的耐受性。幸鸿宇等[22]研究报道,左乙拉西坦单药治疗小儿癫痫不良反应较低。本研究中,两组患儿不良反应发生率比较,差异无统计学意义(P>0.05),提示左乙拉西坦与奥卡西平联合治疗小儿癫痫耐受性良好。
综上所述,左乙拉西坦与奥卡西平联合方案治疗小儿癫痫疗效显著,可有效改善患儿认知功能,降低HMGB-1、TLR4水平,减轻炎症反应,调节神经功能因子水平,且未明显增加不良反应。本研究仍存在不足,本研究属于小样本量研究,研究结果可信度仍有待考证,还需扩大样本量进一步进行前瞻性、多中心的对照研究。
