双特异性磷酸酶1通过视神经萎缩蛋白1抑制血管平滑肌细胞钙化
2022-07-06陈韦任周玉杰陈韵岱金琴花吴雪萍
陈韦任,霍 霞,周玉杰,陈韵岱,马 茜,金琴花,吴雪萍,沙 媛
1首都医科大学附属北京安贞医院心内12病房 北京市心肺血管疾病研究所 冠心病精准治疗北京市重点实验室 首都医科大学冠心病临床诊疗与研究中心,北京 100029 2中国人民解放军总医院第二医学中心心血管内科 国家老年疾病临床医学研究中心,北京 100853 3中国人民解放军总医院第一医学中心心血管内科,北京 100853
血管钙化是动脉粥样硬化和慢性肾脏疾病患者常见的并发症,能够增加心血管疾病的发病率和死亡率。有研究将血管钙化分为3种类型:遗传型、炎症型和代谢型[1-3]。目前认为血管钙化的机制主要和遗传、血管平滑肌细胞(vascular smooth muscle cell,VSMC)成骨型转化、钙磷代谢失衡、钙化促进因子和抑制因子间失衡、炎症、细胞凋亡、线粒体自噬等相关[4-7]。最近研究发现线粒体结构和功能的改变在血管钙化中起着重要作用[8-9]。视神经萎缩蛋白1(optical atrophy 1,OPA1)是线粒体塑形蛋白家族中的成员,参与线粒体内膜融合,对线粒体的结构和功能起着重要作用。本课题组前期研究发现血管钙化时OPA1表达水平下降,线粒体分裂增加,线粒体氧化应激和凋亡增多,而促进OPA1表达能够增加线粒体融合,减少线粒体分裂,减轻血管钙化[10]。但OPA1上游调控通路尚不清楚。双特异性磷酸酶1(dual-specificity phosphatase 1,DUSP1)是细胞调控低氧、氧化应激的关键因子,在动脉粥样硬化斑块中具有抗炎症和抗凋亡作用[11-13]。研究发现DUSP1是线粒体调控的重要蛋白[14-15]。在心肌缺血再灌注损伤中,DUSP1表达下降,细胞凋亡增加,而激活DUSP1可以抑制线粒体通透性转换孔开放,下调线粒体分裂蛋白表达,保护线粒体结构和功能,抑制氧化应激和细胞凋亡,减轻再灌注损伤[16]。因此,本研究建立VSMC钙化体外模型,探讨DUSP1是否通过调控OPA1蛋白影响VSMC钙化,并阐明其可能的机制,为血管钙化的防治提供新思路。
材料和方法
材料4周龄SD大鼠30只,购于中国人民解放军总医院动物实验中心。β磷酸甘油、氯化钙、茜素红S染色试剂盒购自美国Sigma公司,胎牛血清购自美国Hyclone公司,DMEM培养基购自美国Gibco公司,钙测定试剂盒购自北京中生北控生物公司,TUNEL试剂盒购自美国罗氏公司,DUSP1抗体、OPA1抗体、Runt相关转录因子2(Runt-related transcription factor 2,Runx-2)抗体、骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)抗体和β-actin抗体均购自英国Abcam公司。本研究通过首都医科大学实验伦理委员会批准,伦理审查编号:S2021-099-01。
VSMC分离与纯化及模型构建无菌台内获取大鼠胸主动脉,置于无菌培养皿中,去除血管外的结缔组织,使用眼科剪剪成小碎块,采用贴块法获取原代VSMC[17]。使用10%胎牛血清和DMEM培养基培养。采用免疫组织化学α-平滑肌肌动蛋白染色证实VSMC纯度大于95%。钙化模型构建:在含有胎牛血清的培养基中加入10 mmol/L β磷酸甘油和7.2 mmol/L氯化钙(钙化培养基)培养14 d,以制备VSMC钙化模型[18]。
细胞转染大鼠DUSP1基因过表达和OPA1基因敲减慢病毒载体购自北京赛业生物科技有限公司,参照公司试剂说明书,将3~6代VSMC接种至6孔板,细胞密度为2×105个/孔,通过载体转染DUSP1。另将OPA1基因敲减慢病毒感染VSMC,使用单克隆细胞方法筛选OPA1敲减细胞用于实验。
细胞分组将VSMC分为4组:(1)对照组:培养基培养14 d;(2)钙化组:钙化培养基培养14 d;(3)钙化+DUSP1TG组:过表达DUSP1蛋白后,钙化培养基培养14 d;(4)钙化+DUSP1TG+OPA1-/-组:过表达DUSP1和敲减OPA1蛋白后,钙化培养基培养14 d。每2 d更换1次培养基。每组实验均重复6次。
Western blot检测蛋白表达收集各组细胞,加入100 μl RIPA裂解液裂解细胞,取上清液,BCA法检测蛋白浓度,然后取50 μg蛋白进行SDS-PAGE电泳分离,将蛋白电转移至PVDF膜上,5%脱脂牛奶室温封闭。加入一抗DUSP1(1∶1000)、OPA1(1∶1000)、Runx-2(1∶1000)、BMP-2(1∶1000)、半胱氨酸天冬氨酸蛋白酶3(cysteinyl aspartate-specific proteinase-3,Caspase-3)(1∶1000)、β-actin(1∶1000)4 ℃孵育过夜,洗膜后加入二抗室温孵育60 min。TBST洗涤后ECL发光显影。使用Image J软件进行条带灰度定量分析。
细胞钙化检测β磷酸甘油和氯化钙诱导VSMC钙化后,4%多聚甲醛固定细胞,PBS冲洗细胞后,加入2%茜素红S(pH=4.2),室温下孵育30 min,去离子水冲洗细胞3次,观察各组细胞染色情况并拍照。随后对细胞进行脱钙处理,按照说明书检测细胞钙含量水平[19],同时测定总蛋白含量,以细胞钙含量除以总蛋白含量得出细胞钙含量结果。
细胞凋亡检测采用TUNEL试剂盒检测细胞凋亡。4%多聚甲醛固定细胞,每个样本加入50 μl TUNEL反应液,室温下孵育60 min,用PBS冲洗后,加入辣根过氧化物酶孵育30 min,DAB液显色,显微镜下观察细胞凋亡数,细胞核染成棕褐色为凋亡细胞。
统计学处理采用SPSS 20.0统计软件,符合正态分布的计量资料以均数±标准差表示,两组均数比较采用t检验,多组均数比较采用单因素方差分析,多组间差异的两两比较采用q检验。P<0.05为差异有统计学意义。
结 果
VSMC钙化中DUSP1和OPA1蛋白表达Western blot检测结果显示,β磷酸甘油和氯化钙诱导细胞钙化第7、14、21天,DUSP1蛋白表达水平较钙化前显著下降(t=4.899,P=0.008;t=8.573,P=0.001;t=7.961,P=0.001)(图1)。对照组、钙化组、钙化+DUSP1TG组、钙化+DUSP1TG+OPA1-/-组中OPA1表达量分别为1.00±0.11、0.51±0.05、1.01±0.12、0.32±0.03,差异有统计学意义(F=43.678,P<0.001)。与对照组比较,钙化组的DUSP1和OPA1蛋白表达水平均显著降低(t=11.951,P<0.001;t=8.487,P<0.001);与钙化组比较,钙化+DUSP1TG组的DUSP1和OPA1蛋白表达水平均显著增加(t=-8.660,P<0.001;t=-8.921,P<0.001);与钙化+DUSP1TG组比较,钙化+DUSP1TG+OPA1-/-组的OPA1蛋白表达水平显著降低(t=11.258,P<0.001)(图2)。

DUSP1:双特异性磷酸酶1;VSMC:血管平滑肌细胞;Mr:相对分子质量

OPA1:视神经萎缩蛋白1
过表达DUSP1蛋白促进OPA1表达抑制VSMC钙沉积茜素红S染色结果显示,β磷酸甘油和氯化钙可以诱导VSMC红色钙化结节生成,过表达DUSP1能抑制钙化结节生成,而敲减OPA1表达后红色钙化结节再次增多(图3)。对照组、钙化组、钙化+DUSP1TG组、钙化+DUSP1TG+OPA1-/-组中钙含量分别为(51.2±5.2)、(403.5±49.3)、(50.6±5.8)、(416.3±50.5)nmol/(mg·pro),差异有统计学意义(F=99.861,P<0.001)。与钙化组比较,钙化+DUSP1TG组细胞钙含量显著降低(P<0.001);与钙化+DUSP1TG组比较,钙化+DUSP1TG+OPA1-/-组细胞钙含量显著升高(P<0.001)。

图3 茜素红S染色观察DUSP1/OPA1对VSMC钙化结节的影响
过表达DUSP1蛋白促进OPA1表达抑制VSMC骨型分化对照组、钙化组、钙化+DUSP1TG组、钙化+DUSP1TG+OPA1-/-组中Runx-2蛋白表达量分别为1.00±0.09、2.76±0.21、0.99±0.11、3.38±0.24,差异有统计学意义(F=148.363,P<0.001);BMP-2蛋白表达量分别为1.00±0.10、3.25±0.22、1.19±0.12、3.01±0.26,差异有统计学意义(F=142.704,P<0.001)。与对照组比较,钙化组VSMC骨型分化标志性蛋白Runx-2(P<0.001)和BMP-2(P<0.001)的表达水平显著增加;与钙化组比较,钙化+DUSP1TG组Runx-2(P<0.001)和BMP-2(P<0.001)的表达水平显著降低;与钙化+DUSP1TG组比较,钙化+DUSP1TG+OPA1-/-组Runx-2(P<0.001)和BMP-2(P<0.001)的表达水平显著增加(图4)。
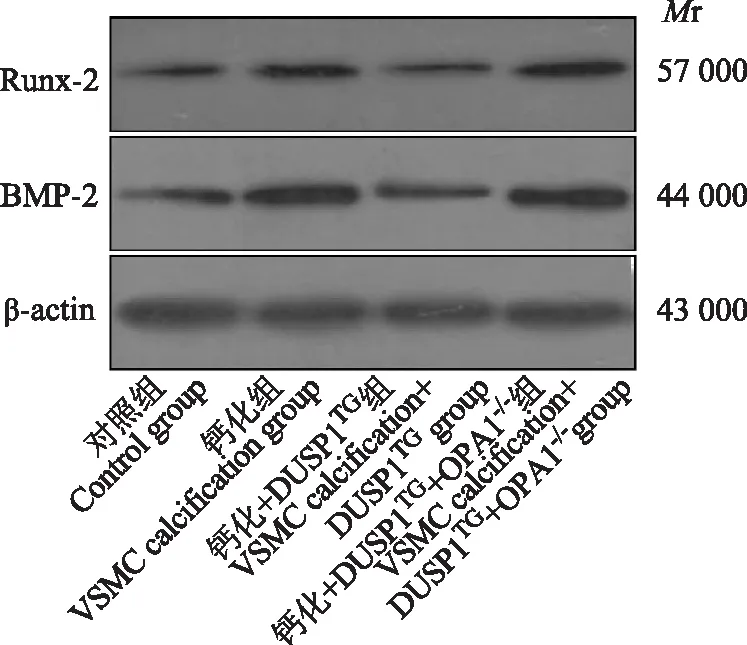
Runx-2:Runt相关转录因子2;BMP-2:骨形态发生蛋白2
过表达DUSP1蛋白促进OPA1表达抑制VSMC凋亡对照组、钙化组、钙化+DUSP1TG组、钙化+DUSP1TG+OPA1-/-组中活化的Caspase-3蛋白表达量分别是1.00±0.11、2.31±0.19、1.35±0.12、2.76±0.25,差异有统计学意义(F=70.537,P<0.001);细胞凋亡率分别是(3.2±2.6)%、(25.1±5.3)%、(11.2±3.1)%、(26.3±5.4)%,差异有统计学意义(F=22.044,P<0.001)。与对照组比较,钙化组活化的Caspase-3表达(P<0.001)和细胞凋亡率(P<0.001)显著增加;与钙化组比较,钙化+DUSP1TG组活化的Caspase-3表达(P<0.001)和细胞凋亡率(P<0.001)显著降低;与钙化+DUSP1TG组比较,钙化+DUSP1TG+OPA1-/-组活化的Caspase-3表达(P<0.001)和细胞凋亡率(P<0.001)显著增加(图5)。
讨 论
随着人口老龄化的加剧,心脑血管疾病发病率逐年增加,血管钙化越来越常见。对于血管钙化的机制和作用靶点的研究越来越重要。最近研究发现血管钙化受到钙化因子调控,是主动的可调控的过程,与骨发生过程类似[20-21]。当VSMC受到高血糖、氧化应激、炎症等刺激后,可向成骨型细胞转化,分泌大量骨相关蛋白如Runx-2、BMP-2、碱性磷酸酶等,进而诱导钙化[22-23]。VSMC凋亡是血管钙化的启动步骤,凋亡先于细胞钙化,凋亡小体成为矿化和钙聚集的成核位点[24],细胞凋亡还能刺激Runx-2、BMP-2分泌,促进VSMC骨型分化,而抑制细胞凋亡,细胞骨型分化减轻[25-26]。本研究也证实血管钙化与细胞凋亡、细胞骨型分化、钙沉积密切相关,抑制细胞凋亡、细胞骨型分化和钙沉积能明显减轻血管钙化。
DUSP1也称丝裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase 1,MKP-1),是首个MKP磷酸酶家族成员,最早研究发现其通过调节丝裂原活化蛋白激酶系统,在人类细胞生长周期和肿瘤发生发展中起着重要作用[27]。最新研究发现其在动脉粥样硬化中具有抗炎、抗氧化和抑制细胞凋亡等心血管保护作用。DUSP1通过抑制动脉粥样硬化c-Jun氨基末端激酶和P38蛋白磷酸化,降低血管细胞黏附分子-1等炎症黏附分子的表达,从而发挥抗炎和抗凋亡的血管保护作用[28]。DUSP1通过抑制P38蛋白磷酸化,下调Caspase-3蛋白水平,进而抑制心肌细胞凋亡,发挥抗凋亡作用[29]。在糖尿病肾病模型中,DUSP1能抑制氧化应激损伤,减少凋亡蛋白的表达,减轻高血糖对线粒体的破坏,保护肾功能,而抑制DUSP1则加重细胞凋亡和高血糖对肾脏的损害[30]。本研究中,血管钙化抑制DUSP1表达,促进细胞凋亡,进而刺激Runx-2、BMP-2的表达和钙盐沉积,进一步加重血管钙化。过表达DUSP1后,细胞凋亡被抑制,VSMC骨型分化和钙沉积减少,血管钙化减轻。
研究发现DUSP1能通过调控线粒体相关蛋白,减少线粒体损伤,起到细胞保护作用[16,30]。研究证实血管钙化时,线粒体融合蛋白OPA1分泌减少,线粒体分裂增加,线粒体结构和功能受到损害,而促进OPA1蛋白表达,能抑制线粒体分裂,减少细胞凋亡和细胞骨型分化,减轻血管钙化[10]。本研究尝试明确DUSP1是否通过调控OPA1起到影响血管钙化的作用。结果显示,DUSP1蛋白过表达可促进OPA1蛋白的表达,敲减OPA1后钙沉积增多、VSMC骨型分化、细胞凋亡率增加,由此推断DUSP1通过OPA1调控钙沉积、VSMC骨型分化、细胞凋亡进而影响血管钙化。
本研究的局限性在于DUSP1/OPA1之间的作用机制研究不够深入,DUSP1是否通过OPA1调控线粒体融合和自噬,保护线粒体结构和功能完整,进而起到抗血管钙化作用还有待于进一步探索。
综上,本研究结果显示,DUSP1可能通过促进OPA1蛋白表达起到抑制VSMC钙化的作用。相信随着研究的深入,将为血管钙化的诊断和治疗提供新的思路和作用靶点。
