肺原发黏液表皮样癌的影像表现与临床病理分析
2022-07-06田树平聂永康赵绍宏吴重重付岩宁
刘 烨,田树平,聂永康,赵绍宏,邢 宁,吴重重,金 鑫,付岩宁
1中国人民解放军总医院第一医学中心放射诊断科,北京 100853 2全景医学影像诊断中心,北京 100039
肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)是一种罕见的肺部肿瘤,属于肺原发涎腺型肿瘤,与常见的肺原发低度恶性肿瘤具有相似性,但又存在差异性,在部分病例中可出现远处转移等高度恶性特征[1]。由于临床症状无明显特异性,且影像表现与其他肺原发肿瘤具有一定重叠性,易误诊。认识其影像表现及特征,尽早诊断,可帮助临床医师制订合理的治疗方案,改善预后。因此,本研究回顾性分析起源于气道不同部位的PMEC患者的临床及CT影像表现,总结归纳其特点,以期提高诊断准确率,为临床进一步治疗及评估预后提供依据。
资料和方法
资料来源连续收集2016年1月至2020年12月解放军总医院第一医学中心经病理证实的27例PMEC患者,其中,男19例,女8例,中位年龄42.5岁(15~70岁)。纳入标准:(1)经支气管镜或穿刺活检病理确诊为黏液表皮样癌;(2)经病理明确原发于气管、支气管或肺内病变;(3)具有完整的治疗前CT检查数据。本研究经中国人民解放军总医院第一医学中心伦理委员会批准,所有患者均豁免知情同意(伦理审查编号:S2021-150-01)。
方法采用荷兰Philips Brilliance 256 iCT机,27例患者全部行胸部平扫和增强扫描。患者取仰卧位,扫描范围从肺尖到膈下3 cm,吸气末屏气后完成整个胸部CT扫描检查。扫描参数:管电压120 kVp,自动管电流调整技术,薄层重建层厚1.0~1.5 mm,肺窗窗宽1600 HU、窗位-600 HU,纵隔窗窗宽400 HU、窗位40 HU。增强扫描采用非离子型对比剂碘海醇或碘普罗胺(300 mgI/ml)70~90 ml,流速3.5 ml/s,注射对比剂后25~30 s、60~65 s分别行动脉期、静脉期扫描。
图像分析由2名具有5年以上诊断经验的放射科医师在PACS工作站对图像进行分析,包括病灶的位置、大小、边缘、密度、强化程度、内部有无坏死区及钙化灶等。此外,还观察病灶的继发改变,包括是否侵犯周围组织、有无肺门及纵隔淋巴结肿大、胸腔积液、远处转移等。根据既往文献[2]以及病灶在气管支气管的位置分为3型:大气道型,病灶局限于气管、左右主支气管及叶或段以上支气管(包括右肺中间段支气管);肺门型,病灶在肺门处同时向腔内外生长,浸润左右主支气管及叶或段以上支气管内、外壁;周围型,病灶位于段支气管分支以下的小支气管。强化程度分级:CT值增加≤20 HU为轻度强化;20 HU
病理学检查27例患者病灶均行HE染色及切片观察,由2名具有5年以上诊断经验的病理科医师判读结果。根据2015年世界卫生组织肺部肿瘤分类和组织学分级,将PMEC分为低级别组和高级别组[3]。
统计学处理采用SPSS 24.0软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;计数资料以频数(百分比)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一般资料27例PMEC患者中,≤30岁7例、31~60岁13例、>60岁7例。临床症状包括咳嗽、咳痰14例(咯血或痰中带血3例),发热4例,胸闷气短4例,胸痛1例,咽部异物感1例,体检发现2例,肺部病变伴脑转移2例,出现症状时间2周~24个月不等。大气道型发病平均年龄(34.80±12.72)岁,肺门型发病平均年龄(43.07±17.83)岁,周围型发病平均年龄(59.43±12.14)岁;发病男女比例为19∶8。
影像表现大气道型(图1)6例,包括左主支气管5例,右主支气管1例;病灶边缘光滑,边界清晰,密度均匀;增强扫描示轻度强化2例、中度强化2例、重度强化2例;可见砂砾样钙化1例;伴有阻塞性肺炎1例;肺外表现包括淋巴结转移1例、淋巴结及骨、肝脏、脾脏多发转移1例。肺门型(图2)14例,包括左肺上叶3例,左肺下叶4例,右肺上叶1例,右肺中叶3例,右肺下叶3例;CT平扫病灶密度均匀9例,CT值约25 HU,增强扫描示轻度强化3例、中度强化1例、重度强化3例、不均匀强化2例;密度不均匀5例,CT值15~25 HU,增强扫描呈不均匀强化、实性部分重度强化;可见砂砾样钙化2例;伴有远端阻塞性肺炎或肺不张、支气管扩张黏液栓形成14例;肺外表现包括胸腔积液1例、侵及胸膜1例、淋巴结转移2例、淋巴结及双肺、脑、骨、肝脏转移4例。周围型(图3)7例,包括右肺上叶1例、右肺中叶1例、右肺下叶4例、左肺下叶1例;病灶边缘光滑,有浅分叶;CT平扫密度均匀6例,CT值约20 HU,增强扫描示轻度强化5例、中度强化1例;密度不均匀1例,CT值15~20 HU,增强扫描呈不均匀强化、实性部分重度强化;伴有远端阻塞性肺炎1例;肺外表现包括胸腔积液1例、侵及胸膜3例、淋巴结转移1例、脑转移2例。

图1 男,36岁,反复咳嗽半年余。肺窗轴位(A)及冠状位(B)示左主支气管见宽基底并凸向腔内的软组织密度结节(箭头),边缘较光滑;纵隔窗轴位(C)平扫示病灶密度均匀,增强扫描轴位(D)、矢状位(E)、冠状位(F)示明显强化

图2 男,27岁,发热、咳嗽2月余。肺窗轴位(A)示左肺上叶肺门处软组织肿块(箭头),边缘浅分叶,伴有上叶支气管截断;纵隔窗平扫轴位(B)示密度均匀,其内见弧形钙化;增强扫描轴位(C)示局部重度强化

图3 男,36岁,体检发现肺结节。肺窗轴位(A)示右肺下叶外基底段结节(箭头),边缘光滑,边界清晰,近端见扩张的支气管;纵隔窗平扫轴位(B)示密度均匀,CT值约19 HU;增强扫描轴位(C)示轻中度强化
病理结果27例PMEC患者中行支气管镜检查20例,穿刺活检7例。病理类型均为黏液表皮样癌,肿瘤细胞由胞质淡染的黏液细胞和胞质粉染的中间型细胞构成(图4)。其中,低级别PMEC 11例,高级别PMEC 16例。年龄(t=-3.132,P=0.005)、淋巴结肿大(χ2=9.281,P=0.003)及远处转移(χ2=7.816,P=0.008)在低级别和高级别组中差异有统计学意义(表1)。
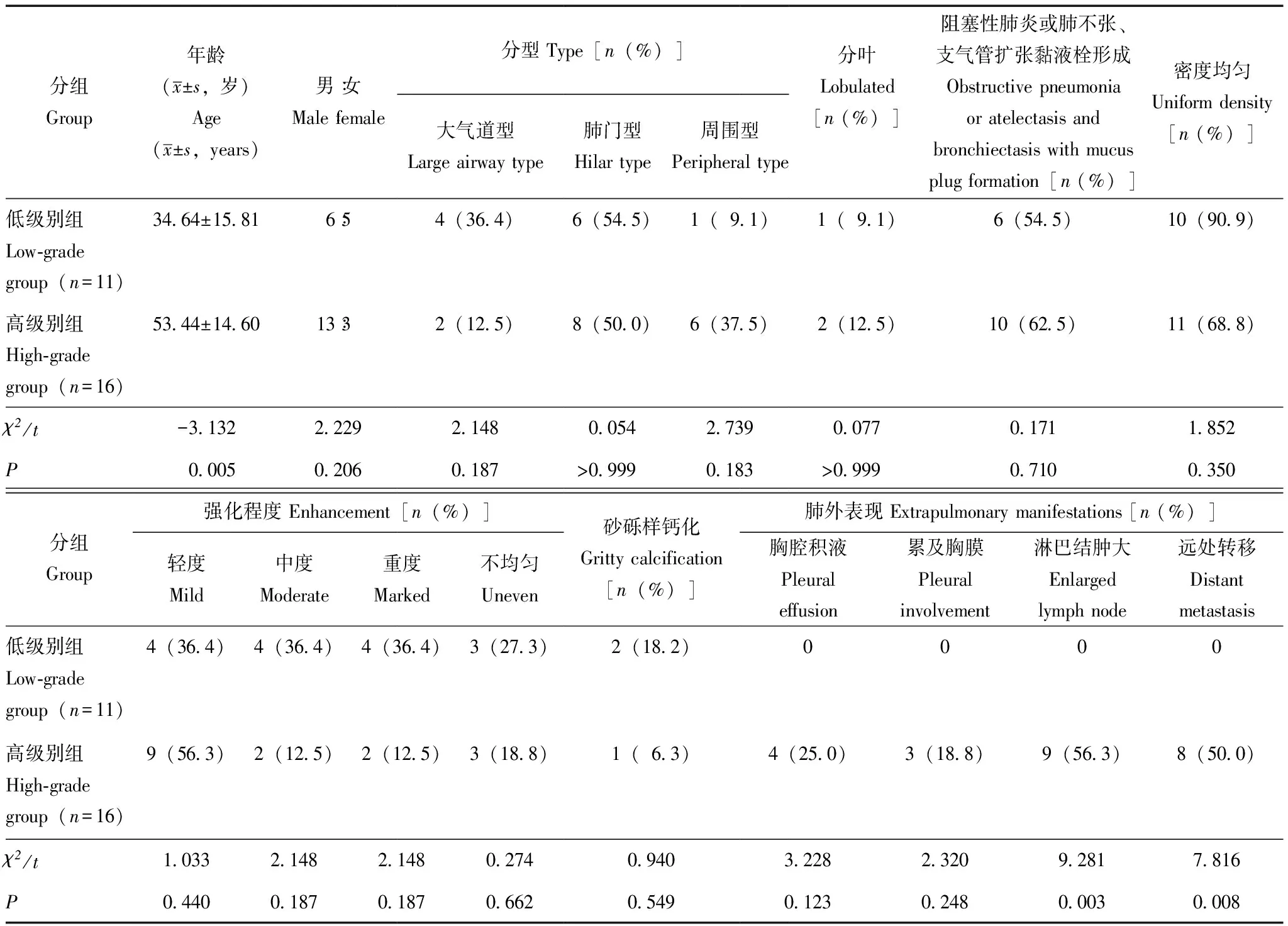
表1 肺黏液表皮样癌患者低级别和高级别组一般资料和CT表现的比较

图4 HE染色示肿瘤细胞由胞质淡染的黏液细胞和胞质粉染的中间型细胞构成(×200)
治疗及随访27例PMEC患者中,手术切除11例,介入治疗后手术切除1例,化学治疗13例,粒子植入治疗1例,住院期间因其他并发症死亡1例。有随访资料14例,随访时间(6~48)个月,12例无转移或复发,出现新发腺癌1例,复发1例;无随访资料13例。
讨 论
肺原发涎腺型肿瘤为一组罕见的肺部恶性肿瘤,包括PMEC、腺样囊性癌、涎腺上皮-肌上皮癌和多形性腺瘤[3]。与其他肺原发肿瘤不同,这一类肿瘤多见于中青年,主要位于大气道,同时生物学特性也更偏良性[4],其中PMEC为肺原发涎腺型肿瘤中最常见类型。
PMEC的发病年龄在3~78岁,多见于30~40岁,本组27例患者中20例为中青年,中位年龄42.5岁,年轻患者以大气道型多见,老年患者以周围型多见,与韩小雨等[1]报道一致,且年龄在低级别与高级别组中差异有统计学意义。通常认为,PMEC发病无性别差异,但庄武等[5]报道男性多于女性。本组病例中男女比例为19∶8。PMEC临床症状无特异性,包括咳嗽、咳痰、咯血或痰中带血、发热、背部疼痛、气促等[6],病程2周~20个月不等。当病变位于大气道内生长时,主要引起进行性气管或支气管阻塞性症状和体征,常反复发作并逐渐加重,表现为进行性加重的哮喘[7-8]。本组27例患者中,无症状者仅2例,有症状者25例(93%),包括咳嗽、咳痰,咯血或痰中带血、胸闷气短、发热、咽部异物感等。
PMEC影像表现主要为大气道型及肺门型,位于左右主支气管、叶或段以上支气管腔内,与该类型肿瘤起源于支气管树的腺体有关,因为混合腺体和透明软骨存在于3级以上的支气管黏膜下层,小气道几乎无混合腺体和透明软骨[9]。Kim等[10]报道大气道型黏液表皮样癌10%发生于主支气管,75%发生于叶或段以上支气管,15%发生于外周分支支气管。本组6例(22.2%)位于左右主支气管腔内,14例(51.9%)位于左右主支气管、叶或段以上支气管(包括右侧中间支气管)。有文献报道个别病例位于胸膜下[11],本组7例(25.9%)周围型PMEC中有3例位于胸膜下。形态学上,6例(22.2%)大气道型PMEC均表现为宽基底且凸向腔内的光滑类圆形结节,其中1例完全阻塞大气道引起远端阻塞性肺炎和肺不张,5例部分阻塞大气道,仅表现为腔内的孤立性结节;14例(51.9%)肺门型PMEC表现为肺门周围类圆形肿块,可浅分叶,沿支气管长轴走行,管壁增厚,管腔明显狭窄、闭塞,引起远端阻塞性肺炎或肺不张、支气管扩张黏液栓形成;7例(25.9%)周围型PMEC主要表现为边缘光滑、境界清楚的椭圆形或分叶状孤立的结节(4例)或肿块(3例),支气管包绕其中,累及周围肺组织,未见毛刺征、胸膜凹陷等恶性肿瘤征象。病灶密度平扫多数较均匀,低于或等于胸壁肌肉密度,本组27例患者病灶,21例(77.7%)密度较均匀,与张大福等[12]报道一致。强化程度各文献报道不一[13]。本组PMEC强化无特征性,10例(37.0%)轻度强化,4例(14.8%)中度强化,5例(18.5%)重度强化,8例(29.6%)不均匀强化。强化方式的多样性可能与肿瘤内部黏液分泌区与非黏液分泌区血管成分比例不同、分布不均有关。部分文献报道PMEC钙化发生率可达50%[3],但本组钙化发生率较低,仅3例(11%)。本组16例(59.3%)病灶远端出现阻塞性肺炎或肺不张、支气管扩张黏液栓形成,其中1例为大气道型,14例为肺门型,1例为周围型,可能与疾病的生长方式有关。此外,9例(33.3%)淋巴结转移,8例(29.6%)远处多器官转移,且在低级别与高级别组中差异有统计学意义。
对于大气道型及肺门型PMEC,支气管镜为最重要的检查手段,术前常可明确细胞学诊断。本组病例中20例通过支气管镜检查明确诊断,7例周围型PMEC通过穿刺检查确诊。PMEC病理特点为由黏液细胞、表皮细胞、中间型细胞构成管状、囊腺样或夹杂有黏液细胞的实片状结构。根据其病理形态特征将PMEC分为低级别和高级别2种类型。其中低级别肿瘤多见,以囊性成分为主,细胞异形性不明显,肿瘤多无坏死区域,可见钙化,可能与黏液细胞分泌的黏液吸收不全致钙盐沉积有关。Han 等[14]报道PMEC的黏液分泌物钙化主要出现在肿瘤细胞高分化程度的患者中,即低级别的黏液表皮样癌。本组研究中仅3例出现钙化,均为低级别肿瘤,这种钙化现象可能是PMEC偏良性的预测因子[15]。高级别肿瘤少见,由中间型细胞和表皮样细胞组成,黏液细胞较少,肿瘤多呈实性,细胞异型性明显,核分裂象活跃,坏死灶易见,肺门及区域淋巴结常见转移[16]。虽然PMEC进展缓慢,但其生物学特性与偏良性的腺样囊性癌或类癌有差异,部分病例还是会出现局部侵袭和淋巴结转移,具有进展侵袭性[10]。本组16例为高级别PMEC,其中13例伴有肺门、纵隔淋巴结转移及其他脏器转移,可能与样本量小,样本偏倚所致。有文献认为气道腔内病灶远端支气管扩张伴黏液栓形成是PMEC的特征性改变,病理证实为气道黏液细胞分泌大量黏液物质所致[6]。本研究14例肺门型PMEC,均伴有病灶远端支气管扩张伴黏液栓形成,与文献报道基本一致[12]。
PMEC需与肺肿瘤性及非肿瘤性疾病相鉴别[1,17-18]。包括(1)中央型肺癌:患者发病年龄较大,多见于中老年男性,与吸烟有关,病灶边缘毛糙、分叶多见,由于肿瘤快速生长导致中央液化坏死多见,增强扫描多为不均匀强化,可见偏心性空洞,更易出现肺门及纵隔淋巴结转移。(2)周围型肺癌:边缘多分叶、毛刺,增强扫描为不均匀强化,可见液化、坏死及癌性空洞,胸膜凹陷或牵拉多见。(3)腺样囊性癌:与PMEC较难鉴别,主要表现为气管及左右主支气管腔内外肿块或弥漫浸润性生长的病灶,多为轻中度强化,远处转移发生率高于PMEC。(4)类癌:多发生于主支气管或段支气管分叉处的息肉样富血供结节,增强扫描为明显强化,临床常伴有副肿瘤综合征。(5)肺黏液腺癌:主要与孤立型黏液腺癌鉴别,多位于肺外周,实性或部分实性结节伴有空泡、支气管充气征或血管造影征。(6)错构瘤:腔内型错构瘤为支气管内最常见的良性肿瘤,CT平扫可见脂肪成分或爆米花样钙化。(7)硬化性肺细胞瘤:女性多见,多位于肺门周围,明显强化,偶可见晕征及空气新月征。(8)其他弥漫的非肿瘤性气管支气管病变,如支气管内膜结核、淀粉样变性、复发性多软骨炎等,可见支气管管壁增厚,管腔变形狭窄,且支气管内膜结核常伴有肺门淋巴结肿大、肺结核以及钙化。
PMEC治疗以手术切除为主,本组12例手术切除患者中,6例随访无异常,1例随访1年后新发腺癌,1例随访4年后复发,4例未随访;放化疗效果尚可,本组14例病例经放化疗治疗后,随访未见异常。预后与患者的年龄、肿瘤分布、恶性程度相关。经彻底手术切除,低级别PMEC患者可治愈,高级别PMEC患者术后易早期发生远处转移,预后差。
综上,本研究结果表明,PMEC的CT影像表现具有一定特征性。气道内孤立光滑的结节或肿块,平扫密度均匀,增强扫描实性部分中度至重度强化,偶有钙化,合并或不合并远端肺组织阻塞性病变或黏液栓形成,应考虑诊断PMEC。结合CT三维重建技术可为临床诊治提供更多的有效信息。
