白细胞介素6基因敲除对阿尔茨海默病5×FAD模型小鼠β淀粉样蛋白沉积和认知的影响
2022-07-06曹晶晶潘吉荣张东圆陈博睿孟爱民
曹晶晶,潘吉荣,张东圆,陈博睿,张 玲,孟爱民,秦 川
中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心 国家卫生健康委员会人类疾病比较医学重点实验室北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021
阿尔茨海默病(Alzheimer’s disease,AD)是一种脑内神经元退行性疾病,表现为进行性的记忆减退和认知障碍,其主要病理特征是脑组织萎缩、β淀粉样蛋白(amyloid β-protein,Aβ)沉积形成斑块和Tau蛋白高度磷酸化在细胞内聚集形成神经纤维缠结[1]。目前认为Aβ沉积激活小胶质细胞引起的炎性反应是AD的主要病理机制之一[2-4]。多项研究证实,炎症因子白细胞介素6(interleukin-6,IL-6)与AD的认知障碍和外周代谢改变有密切关系[5]。AD患者的外周血及脑脊液中IL-6的水平升高[6-8]。动物实验也表明,中枢神经系统炎症随着IL-6水平升高,可引起小鼠认知障碍[9]。5×FAD小鼠是一种新型AD模型小鼠,具有与AD相关的5个突变位点,其中与淀粉样前体蛋白(amyloid precursor protein,APP)相关的突变为K670N/M671L(瑞典型)、I716V(佛罗里达型)和V717I(伦敦型),与早老素-1(presenilin-1,PS-1)相关的突变为M146L和L286V,在1.5月龄可见细胞内Aβ42聚集,2月龄开始出现Aβ沉积,约4月龄出现记忆损害,是在APP/PS1转基因模型小鼠的基础上更接近临床AD病理特征的AD模型[10]。本研究将IL-6基因敲除小鼠与5×FAD小鼠杂交,繁育得到5×FAD;IL-6-/-小鼠,探究IL-6基因敲除对5×FAD小鼠学习记忆能力及脑组织病理变化的影响。
材料和方法
主要试剂与仪器EasyPure Genomic DNA Kit(货号:L61101)、凝胶染料(货号:GS101-02)购自北京全式金生物技术股份有限公司,Premix Taq(货号:RR901A)、DNA分子量标准(货号:3427A)购自宝日医生物技术有限公司,RIPA裂解液(货号:P0013B)、苯甲基磺酰氟蛋白酶抑制剂(货号:ST506)、磷酸酶抑制剂(货号:P1081)、SDS-PAGE凝胶快速配制试剂盒(货号:P0012AC)、SDS-PAGE电泳液(货号:P0014B)、Western转膜液(货号:P0021A)均购自上海碧云天生物技术有限公司,BCA蛋白定量试剂盒(货号:23227)购自赛默飞世尔科技有限公司,IL-6抗体(货号:66146-1-Ig)购自武汉三鹰生物技术有限公司,6E10抗体(货号:IG-39320)购自美国BioLegend公司,柠檬酸盐修复液(货号:ZLI-9065)、小鼠二步法检测试剂盒(货号:PV9002)、DAB试剂盒(货号:ZLI-9019)均购自北京中杉金桥生物技术有限公司。T100 PCR仪购自美国Bio-Rad公司,DYY-11电泳仪购自北京六一仪器厂,Tanon-1600数码凝胶图像处理系统购自上海天能科技有限公司,EthoVision XT 9行为学系统和视频分析软件购自诺达斯信息技术有限责任公司。
实验动物及分组亲本小鼠5×FAD及IL-6基因敲除小鼠(IL-6+/-)均由中国医学科学院医学实验动物研究所提供。IL-6+/-小鼠与5×FAD小鼠杂交,繁殖得到的5×FAD;IL-6+/-F1代小鼠与IL-6+/-回交,根据孟德尔定律,子代小鼠基因型分别为5×FAD;IL-6-/-、5×FAD、野生型(wild type,WT)、IL-6-/-、5×FAD;IL-6+/-、IL-6+/-。本研究选用3、10月龄子代小鼠进行实验,每个月龄分为3组:WT组、5×FAD组、5×FAD;IL-6-/-组。3月龄各组小鼠数量分别为27、26、20只;10月龄各组小鼠数量分别为16、24、5只。所有小鼠均饲养于中国医学科学院医学实验动物研究所SPF屏障环境,自由采食和饮水。本研究通过中国医学科学院医学实验动物研究所实验动物管理和使用委员会(IACUC)审批,批准号:PJR18001。
小鼠基因型鉴定剪取1周龄幼鼠的鼠尾组织0.1~0.3 cm,置于1.5 ml无菌EP管中,按照EasyPure Genomic DNA Kit说明书提取基因组DNA。根据TaKaRa Premix Taq说明书进行PCR鉴定小鼠基因型。用无菌双蒸水作为空白对照,WT小鼠基因组作为阴性对照,5×FAD;IL-6+/-小鼠基因组作为阳性对照。5×FAD引物为F:5’-AGGACTGACCACTCGACCAG-3’,R:5’-CGGGGGTCTAGTTCTGCAT-3’;IL-6引物为F:5’-CCACCAAGAACGATAGTCA-3’,R:5’-AGAGAACACAGTCTAGTCTG-3’。扩增产物用于琼脂糖凝胶电泳。
旷场实验旷场实验自发活动实验箱大小为50 cm×50 cm×20 cm,侧壁及底面均为白色不透明材料,底面分为中央区、中间区和边缘区,区域划分参考文献[11]。实验前将小鼠放置在临时笼架适应1 h以减少动物紧张,实验时将单只小鼠放入箱底中央,记录小鼠5 min的活动轨迹,通过Ethovision XT监测系统分析动物的运动状态。实验时保持安静,房间为弥散性光源,每只小鼠实验结束后用75%乙醇擦拭实验装置,减少实验动物之间气味的影响。通过运动总路程、平均速度、静止总时间、中央区停留时间等观察小鼠活动情况。
新物体识别新物体识别实验箱大小为50 cm×50 cm×20 cm,侧壁及底面均为白色不透明材料。实验参考文献[12]并进行适当调整,实验过程由适应期、熟悉期和测试期3部分组成:第1天为适应期,将小鼠放入实验箱内适应5 min;第2天为熟悉期,在实验箱一侧对称的两端放入2个完全相同的绿色立方体积木,将小鼠背对积木放入实验箱中央区域,自由探索5 min;第3天为测试期,将箱内其中1个积木替换成紫色正四棱锥积木,将小鼠背对积木放入实验箱中央区域,自由探索5 min。记录测试期小鼠对新旧物体的探究时间。探索指数=探索新物体总时间/(探索新物体总时间+探索旧物体总时间)。
Morris水迷宫水池直径为1 m、高60 cm、深30 cm,分为4个象限,水温(22±1)℃,房间为弥散性光源。实验分6 d进行。前5天为定位航行实验:在目标象限中央放置1个直径5 cm的圆形透明平台,高度在水面下1 cm,每天按照不同的象限顺序将小鼠放入水池中,给予60 s的时间寻找平台,记录小鼠找到平台需要的时间(即潜伏期)并让小鼠在平台上休息15 s,如未找到平台则潜伏期记为60 s并引导小鼠到平台上休息15 s。第6天为空间探索实验:将平台撤去,然后将平台对面象限作为入水点,放入小鼠寻找平台,寻找时间60 s,记录小鼠穿越原平台位置的次数和在平台象限停留的时间。可视平台测试:将平台升高到水面上1 cm,并在平台上安装1个小红旗使平台更醒目,然后在平台旁的象限放入小鼠,让其寻找平台,记录小鼠找到平台的时间,从而检测参与实验的小鼠在视力和体力上是否存在差异。
HE染色及免疫组织化学染色小鼠深度麻醉后,暴露胸腔,将灌流针插入左心室,同时剪开右心耳,以4 ℃预冷的生理盐水冲洗掉血液,至肝脏完全泛白停止。取右侧大脑组织固定于4%多聚甲醛48 h,脱水透明后石蜡包埋,制成5 μm厚度切片。HE染色:切片脱蜡水化后,放置于苏木素染液中浸染20 min,进行分色、蓝化,再放置于伊红染液中2 min,脱水透明后封片,观察结果。免疫组织化学染色:切片脱蜡水化后,柠檬酸盐缓冲液微波抗原修复,自然冷却至室温,依次滴加3%过氧化氢(10 min),山羊血清(30 min),6E10抗体(1∶200,4 ℃过夜),辣根酶标记山羊抗小鼠二抗(1∶10 000,20 min),辣根酶标记链霉卵白素工作液(30 min),DAB试剂显色,苏木素染核1 min,1%盐酸酒精分化数秒,自来水冲洗,脱水透明封片,观察结果。
蛋白免疫印迹4 ℃预冷的生理盐水灌流后取左侧大脑,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,冰上匀浆并离心取上清液,BCA法测定蛋白浓度。聚丙烯酰胺凝胶电泳分离蛋白,然后转移至PVDF膜,5%封闭液室温封闭1 h,加入一抗4 ℃孵育过夜,TBST缓冲液洗膜3次,每次10 min,加入二抗室温孵育1 h,TBST缓冲液冲洗6次,每次5 min。采用ECL化学发光法显色,凝胶成像系统采集成像。
统计学处理采用GraphPad Prism 8软件对数据进行统计分析。计量资料通过Shapiro-Wilk算法进行正态分布检验,以均数±标准差表示。水迷宫定位航行中的逃避潜伏期数据采用重复测量的方差分析,多组间比较采用单因素方差分析,并采用Tukey法进行组间两两比较。P<0.05为差异有统计学意义。
结 果
子代小鼠基因型鉴定结果WT小鼠5×FAD基因扩增无条带,IL-6基因扩增得到539 bp单条带;5×FAD小鼠5×FAD基因扩增得到377 bp单条带,IL-6基因扩增得到539 bp单条带;IL-6+/-小鼠5×FAD基因扩增无条带,IL-6基因扩增得到539 bp和516 bp双条带;IL-6-/-小鼠5×FAD基因扩增无条带,IL-6基因扩增得到516 bp单条带;5×FAD;IL-6+/-小鼠5×FAD基因得到377 bp单条带,IL-6基因扩增得到539 bp和516 bp双条带;5×FAD;IL-6-/-小鼠5×FAD基因扩增得到377 bp单条带,IL-6基因扩增得到516 bp单条带(图1)。
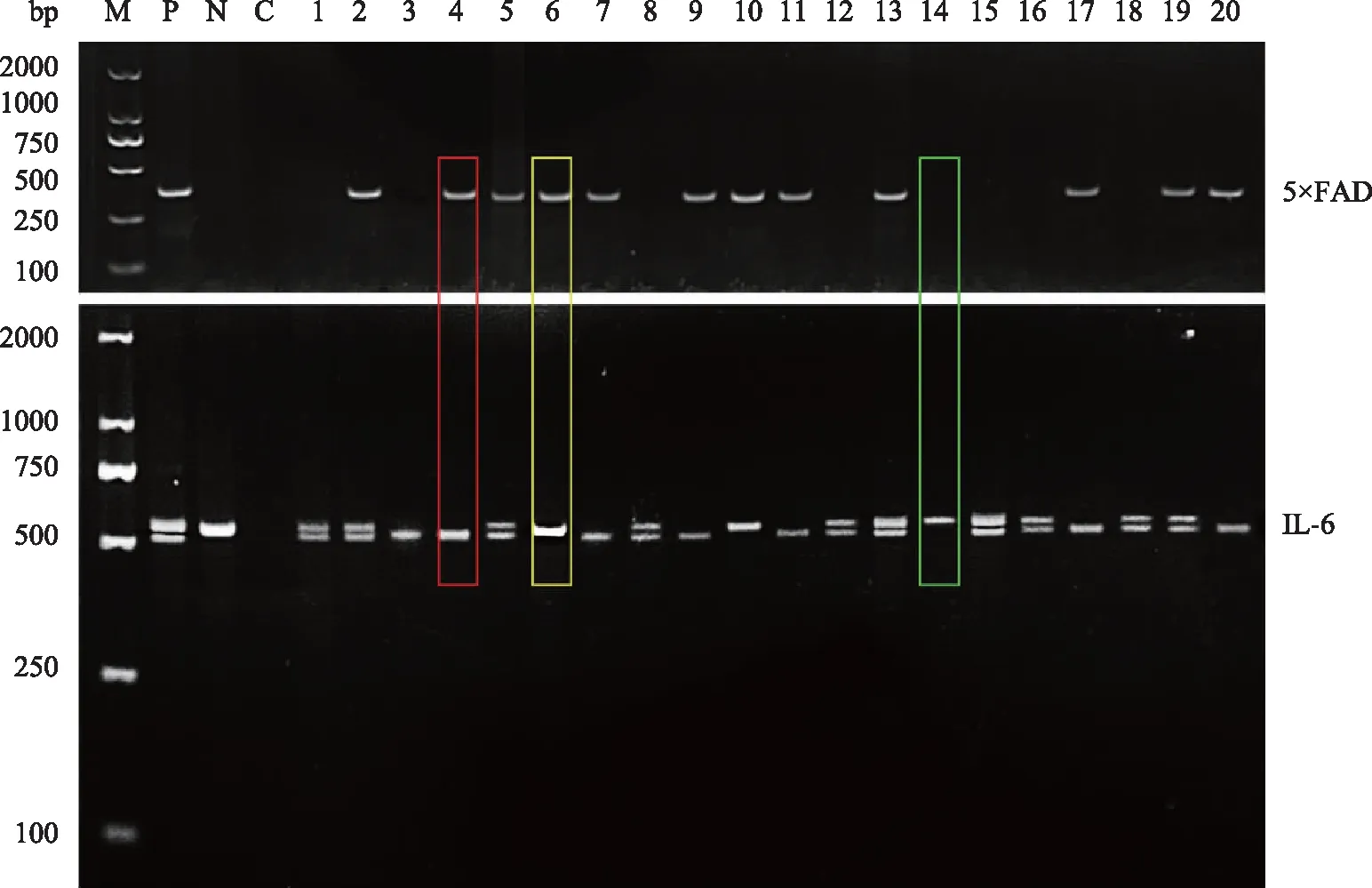
IL-6:白细胞介素6;M:DNA marker;P:阳性对照;N:阴性对照;C:空白对照;1~20:小鼠编号;绿色框指示野生型小鼠,黄色框指示5×FAD小鼠,红色框指示5×FAD;IL-6-/-小鼠;其他泳道代表的小鼠基因型由5×FAD和IL-6的基因型共同决定
旷场实验结果与3月龄WT小鼠相比,3月龄5×FAD及5×FAD;IL-6-/-小鼠在旷场中的运动总路程(q=0.136,P=0.995;q=0.352,P=0.966)、平均速度(q=0.138,P=0.995;q=0.253,P=0.983)、静止时间(q=0.139,P=0.995;q=0.794,P=0.841)、中央区停留时间(q=0.791,P=0.843;q=1.742,P=0.439)差异均无统计学意义。与10月龄WT小鼠相比,10月龄5×FAD及5×FAD;IL-6-/-小鼠在旷场中的运动总路程(q=2.649,P=0.159;q=0.587,P=0.909)、平均速度(q=2.649,P=0.159;q=0.588,P=0.909)、静止时间(q=2.795,P=0.131;q=0.727,P=0.865)、中央区停留时间(q=0.559,P=0.918;q=1.326,P=0.619)差异均无统计学意义。
新物体识别实验结果与同月龄WT小鼠相比,3、10月龄5×FAD小鼠的探索指数显著降低,差异有统计学意义(q=8.237,P<0.001;q=2.838,P=0.004)。与同月龄WT小鼠相比,3月龄5×FAD;IL-6-/-小鼠的探索指数显著下降(q=4.607,P=0.003),而10月龄5×FAD;IL-6-/-小鼠的探索指数下降差异无统计学意义(q=0.926,P=0.613)。与同月龄5×FAD小鼠相比,3月龄5×FAD;IL-6-/-小鼠的探索指数显著升高(q=3.891,P=0.002),而10月龄5×FAD;IL-6-/-小鼠的探索指数升高差异无统计学意义(q=1.336,P=0.428)(图2)。
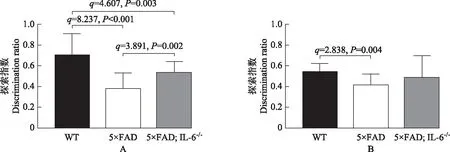
WT:野生型
Morris水迷宫实验结果空间学习阶段各组小鼠找到隐藏平台的时间随着训练天数的增加而不断缩短。3月龄5×FAD小鼠与3月龄WT小鼠相比找到隐藏平台所需时间延长,并且在第4、5天差异有统计学意义(q=3.777,P=0.049;q=5.729,P=0.001);3月龄5×FAD;IL-6-/-小鼠与3月龄WT小鼠、5×FAD小鼠相比找到隐藏平台所需时间差异无统计学意义(P均>0.05)(图3A)。10月龄5×FAD小鼠与10月龄WT小鼠相比找到隐藏平台所需时间延长,并且在第4、5天差异有统计学意义(q=3.791,P=0.011;q=4.801,P=0.001);10月龄5×FAD;IL-6-/-小鼠与10月龄WT小鼠、5×FAD小鼠相比找到隐藏平台所需时间差异无统计学意义(P均>0.05)(图3B)。空间探索阶段,与同月龄WT小鼠相比,3、10月龄5×FAD小鼠在目标象限停留时间显著降低,且差异有统计学意义(q=3.982,P=0.005;q=4.023,P=0.012),而3、10月龄5×FAD;IL-6-/-小鼠在目标象限停留时间差异无统计学意义(q=0.528,P=0.926;q=1.990,P=0.349);与同月龄5×FAD小鼠相比,3月龄5×FAD;IL-6-/-小鼠目标象限停留时间增加且差异有统计学意义(q=3.797,P=0.012),而10月龄5×FAD;IL-6-/-小鼠目标象限停留时间差异无统计学意义(q=0.922,P=0.426)(图3C)。与同月龄WT小鼠相比,3、10月龄5×FAD小鼠穿台次数显著降低,且差异有统计学意义(q=5.265,P=0.001;q=4.899,P=0.002),而3、10月龄5×FAD;IL-6-/-小鼠穿台次数差异无统计学差异(q=2.649,P=0.157;q=1.762,P=0.434);与同月龄5×FAD小鼠相比,3月龄5×FAD;IL-6-/-小鼠穿台次数增加且差异有统计学意义(q=2.505,P=0.017),而10月龄5×FAD;IL-6-/-小鼠穿台次数差异无统计学意义(q=1.556,P=0.226)(图3D)。
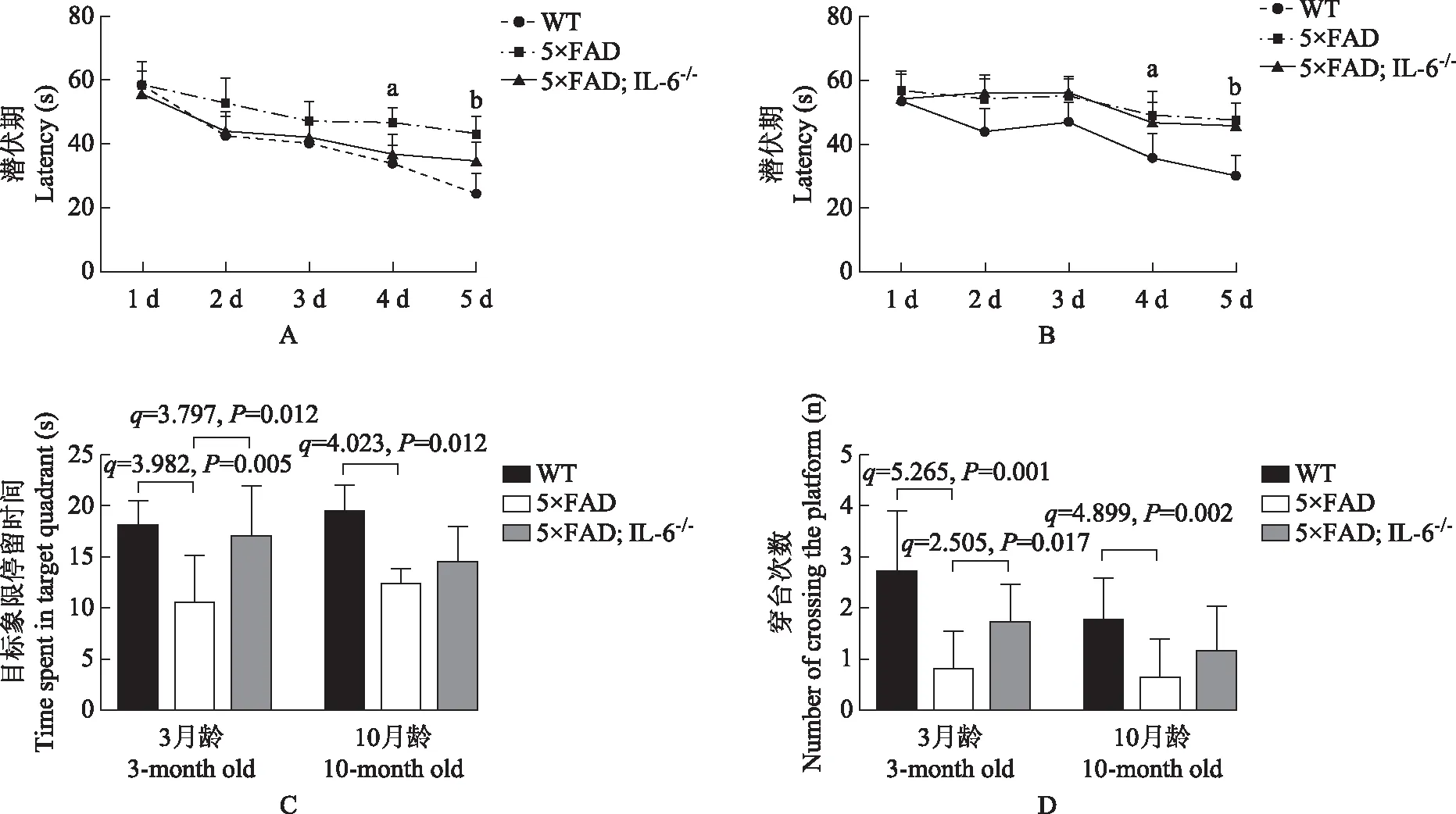
与WT组小鼠相比,aP<0.05,bP<0.01
蛋白免疫印迹实验结果与同月龄WT小鼠相比,3月龄5×FAD小鼠的IL-6蛋白相对表达量差异无统计学意义(q=42.201,P=0.333),10月龄5×FAD小鼠的IL-6蛋白相对表达量显著增加且差异有统计学意义(q=83.630,P<0.001);与同月龄5×FAD小鼠相比,3月龄及10月龄5×FAD;IL-6-/-小鼠的IL-6蛋白相对表达量显著降低,差异有统计学意义(q=45.390,P<0.001;q=164.411,P<0.001)(图4)。
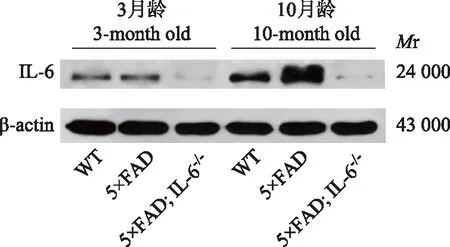
Mr:相对分子质量
HE染色结果3、10月龄WT、5×FAD、5×FAD;IL-6-/-小鼠海马及大脑皮层HE染色显示,神经元排列紧密有序,细胞膜和细胞核形态结构正常,神经元具有完整性和有序性,未见严重的病理性损伤改变(图5)。
图5 各组小鼠海马齿状回(A)及大脑皮层(B)HE染色结果
免疫组织化学染色结果与同月龄WT小鼠相比,3、10月龄5×FAD小鼠海马(q=19.872,P=0.001;q=53.840,P<0.001)及大脑皮层(q=23.314,P<0.001;q=17.245,P=0.001)Aβ表达显著增多,差异有统计学意义;3、10月龄5×FAD;IL-6-/-小鼠海马(q=387.732,P=0.004;q=6.386,P=0.008)及大脑皮层(q=149.723,P=0.014;q=6.482,P=0.048)Aβ表达显著增多,差异有统计学意义。与同月龄5×FAD小鼠相比,3、10月龄5×FAD;IL-6-/-小鼠海马(q=13.494,P=0.002;q=45.681,P<0.001)及大脑皮层(q=16.831,P=0.001;q=14.181,P=0.001)Aβ表达显著减少,差异有统计学意义(图6)。
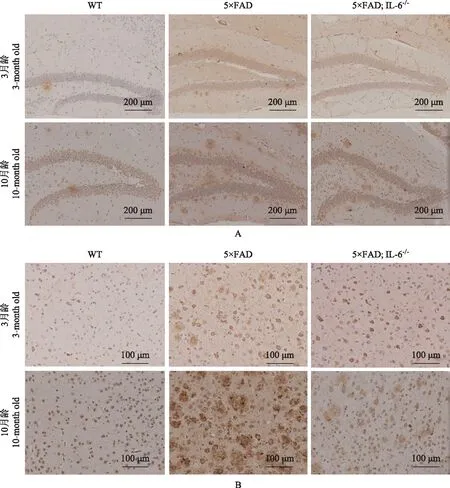
图6 各组小鼠海马(A)及大脑皮层(B)β淀粉样蛋白的免疫组织化学染色结果
讨 论
神经炎症与AD的发病有关,血清中IL-6浓度升高与老年人AD发病率呈正相关。正常情况下,血清中IL-6水平极低,而老年人血清中IL-6浓度明显升高[13]。对汉族人群IL-6单核苷酸多态性分析发现,rs7802308的T等位基因、rs1800796的G等位基因以及rs1800796和rs1800795的单倍型G-C与迟发性老年痴呆的患病风险降低相关[14]。IL-6不仅参与免疫反应,在中枢神经系统正常生理过程中也发挥关键作用,参与神经元和神经胶质细胞的发育成熟、调节神经元和突触功能[15]。在中枢神经系统中,IL-6主要由星形胶质细胞合成,小胶质细胞和神经元也可少量合成[16]。IL-6通过糖蛋白-130进行信号传导,激活Janus激酶/信号转导和转录激活因子3、腺苷酸依赖性蛋白激酶等信号通路[17]。通常认为炎症在神经系统疾病中发挥有害作用,例如抑制新的神经元生成及小胶质细胞过度激活[18]。
IL-6基因修饰小鼠模型在体研究证明IL-6在神经炎症及自噬过程中起关键作用。已有研究发现,在中枢神经系统中过表达IL-6的小鼠神经元数量减少[19],体外实验也证实IL-6能够抑制神经干细胞分化成神经元[20]。IL-6转基因小鼠脑内星形胶质细胞和小胶质细胞增生、高表达IL-6的同时,IL-1α、IL-1β、肿瘤坏死因子-α和多种急性期反应蛋白的表达也明显上调,进一步促进神经变性[19]。而IL-6基因敲除的小鼠星形胶质细胞反应几乎全部消失,小胶质细胞的激活也大大减弱。老龄IL-6基因敲除小鼠海马P53蛋白的累积明显降低,促进细胞凋亡蛋白Bax和抑制细胞凋亡蛋白Bcl-2、P21的表达水平没有变化,而与自噬相关的第10号染色体缺失的磷酸酶及张力蛋白同源基因、结节性硬化症蛋白2和损伤调节自噬调节剂1的mRNA水平显著升高[21],这表明IL-6的减少可能保护海马免受与年龄相关的细胞损伤的累积。强直后增强(post-tetanic potentiation,PTP)和长时程增强(long-term potentiation,LTP)是突触传递功能可塑性的重要表现形式,IL-6能够抑制大鼠海马突触可塑性,使海马CA1区PTP和LTP的剂量依赖性降低,这可能与有丝分裂原活化蛋白激酶/细胞外调节蛋白激酶的抑制有关[22]。然而在某些AD模型小鼠中,IL-6有利于AD病理症状的减轻,例如在APP转基因小鼠中注射腺病毒过表达IL-6,神经胶质细胞增生及Aβ沉积减少,可能是由于神经胶质细胞对Aβ的吞噬作用增强所致[22]。
目前关于IL-6在AD模型小鼠大脑病理进程中的作用及调节机制的研究较少。本研究通过杂交,成功繁育出IL-6基因敲除的5×FAD转基因小鼠模型。饲养繁育过程中,子代小鼠生长发育正常。本研究行为学分析结果显示IL-6基因敲除可明显改善3月龄5×FAD小鼠的空间记忆能力,而对10月龄5×FAD小鼠记忆能力没有明显影响。已有研究证明IL-6基因敲除的小鼠可减缓与年龄相关的记忆衰退[20],与本研究结果一致。其原因可能是IL-6基因敲除在AD发病早期可以改变小鼠大脑中的免疫状态,抑制5×FAD小鼠脑内Aβ在细胞外的累积,从而改善5×FAD小鼠记忆能力;而到发病后期,IL-6基因敲除所发挥的作用无法阻挡5×FAD小鼠脑内Aβ的不断累积,导致不可逆的记忆损伤,因此IL-6基因敲除在AD病程后期发挥的作用有限。
综上,本研究通过构建IL-6基因敲除的5×FAD小鼠,证实IL-6基因敲除对5×FAD小鼠大脑的早期保护作用,其实验结果可为AD研究提供参考。但IL-6基因敲除对5×FAD小鼠记忆改善及Aβ沉积减少的作用机制还有待深入研究。
