茶多酚对心力衰竭大鼠肾素-血管紧张素-醛固酮系统和转化生长因子-β1/Smads信号通路的影响
2022-07-06万林峰袁志军
万林峰,袁志军,陈 虎
宜春市人民医院药学部,江西宜春 336000
心力衰竭(heart failure,HF)是由心脏结构或功能异常引起的复杂的临床综合征,几乎所有的心血管疾病最终都会导致HF的发生。HF影响全球2600多万人,由于其高死亡率、高发病率和高医疗费用,HF仍然是世界公共卫生的主要负担之一[1]。HF的发病率随着年龄的增长而急剧上升,其主要病因是冠心病、心脏瓣膜异常和高血压[2]。血管紧张素转换酶抑制剂、利尿剂、β-肾上腺素受体阻断剂、血管紧张素受体Ⅰ拮抗剂和正性肌力药物是目前治疗HF的主要方案。然而,长期使用这些药物会导致一系列不良反应,如电解质紊乱、体液不足和低血压等[3]。因此,需要开发新的抗HF药物。茶多酚是绿茶的主要生物活性成分,具有抗氧化、抗炎、抗衰老、降低血压、抗癌等多种作用[4]。已有研究表明,茶多酚会触发钠/钾-腺苷三磷酸酶/肉瘤基因受体,激活强心甾类固醇样信号通路,并提供蛋白激酶C依赖性的保护,防止大鼠心脏缺血/再灌注损伤[5]。目前,茶多酚对HF的作用及其机制尚不明确。现有证据显示,肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的过度激活导致HF时内皮细胞功能障碍[6]。因此,抑制RAAS的过度激活可能是改善HF的一个潜在治疗策略。以往的研究表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smads通路参与了心脏的病理重塑,这种重塑是通过诱导间质纤维化和心肌细胞肥大,导致胶原过度堆积和细胞外基质沉积来响应压力超负荷而发生的[7]。而抑制TGF-β1的表达对预防心肌纤维化具有潜在价值。因此,本研究旨在探究茶多酚是否通过调节RAAS和TGF-β1/Smads信号通路的过度激活在HF大鼠中发挥保护作用,以期为明确茶多酚对HF的作用机制及开发新的HF治疗策略提供科学依据。
材料和方法
材料茶多酚(纯度≥98.0%,批号84650-60-2)购自北京索莱宝科技有限公司,卡托普利(国药准字H31020617)购自上海旭东海普药业有限公司,血浆肾素活性(plasma renin activity,PRA)ELISA检测试剂盒购自上海博谷生物科技有限公司,Masson三色染色试剂盒购自南京森贝伽生物科技有限公司,血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)、醛固酮(aldosterone,ALD)、白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒购自南京建成生物工程研究所,TGF-β1抗体购自圣克鲁斯生物技术(上海)有限公司,Ⅰ型和Ⅲ型胶原、磷酸化Smad(phosphorylated Smad,p-Smad)2和Smad2抗体购自英国Abcam公司,p-Smad3和Smad3抗体购自美国GeneTex公司,GAPDH抗体购自北京义翘神州生物技术有限公司,BCA蛋白定量检测试剂盒购自上海碧云天生物技术有限公司。
动物分组与建模SPF级健康雄性SD大鼠32只,6~7周龄,体重180~200 g,饲养于SPF级动物实验房,环境温度(23±2)℃、湿度50%~60%、光照/黑暗周期为12 h,自由进食和饮水。所有大鼠适应环境一周后,随机分为假手术组(Sham组)、模型组(Model组)、卡托普利治疗组(PC组)和茶多酚治疗组(TP组),每组8只。除Sham组外,其余各组采用丝线结扎左冠状动脉前降支法建立心肌梗死后HF大鼠模型[8]。大鼠用10%水合氯醛(300 mg/kg)腹腔麻醉后,连接心电图,用自动呼吸机(潮气量10~12 ml,呼吸频率90次/min,呼吸比1∶2)插管通气。暴露大鼠心脏、主动脉和肺动脉,6-0丝线结扎左冠状动脉前降支,可见左心室前壁部分心肌变苍白,室壁运动减弱,心电图Ⅰ、Ⅱ导联ST段明显抬高。Sham组大鼠进行相同手术操作,但不结扎血管。所有大鼠逐层缝合伤口。术后2周,超声心动图测定大鼠射血分数(ejection fraction,EF),当EF<55%时,即为HF模型建模成功。随后,所有大鼠每天给药1次,连续给药8周,其中,PC组灌胃卡托普利5 mg/kg[9],TP组灌胃茶多酚100 mg/kg[10],其余组灌胃等量生理盐水。
超声心动图所有大鼠末次给药24 h后,10%水合氯醛(300 mg/kg)腹腔麻醉后,行超声心动图检查大鼠心功能情况,检测指标包括:左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左心室收缩末期内径(left ventricular end-systolic diameter,LVEDs)、EF和左心室短轴缩短率(left ventricular short axis shortening rate,LVFS)。
心脏质量指数和左心室质量指数所有大鼠末次给药24 h后,称量大鼠体重。10%水合氯醛(300 mg/kg)腹腔麻醉后,取各组大鼠心脏,并称其重量。根据公式,计算以下指标:心脏质量指数(heart mass index,HMI)=心脏质量/体重;左心室质量指数(left ventricular mass index,LVMI)=左心室质量/体重。
HE染色心脏称重后,10%福尔马林固定组织24 h。梯度酒精脱水,二甲苯透明。将已透明的组织块置于融化的石蜡中,待石蜡完全浸入组织块后进行包埋、切片。石蜡切片常规脱蜡至水。切片放入苏木素染液中染色3 min,自来水冲洗;1%盐酸酒精分化3 s,自来水冲洗;0.6%氨水返蓝,自来水冲洗;伊红染液中染色1 min;梯度酒精脱水,二甲苯透明;滴加中性树胶,盖上盖玻片封固,显微镜下观察拍照。
Masson染色根据Masson三色染色试剂盒说明书所示,进行实验操作。石蜡切片常规脱蜡至水。用配制好的铁苏木素染液染色10 min;盐酸乙醇分化液分化、水洗;氨水水溶液返蓝,水洗;去离子水洗1 min;丽春红酸性品红染色液染色5 min;乙酸水溶液洗1 min;磷钼酸水溶液洗2 min,乙酸水溶液洗1 min;苯胺蓝染色液染色2 min,乙酸水溶液洗1 min。乙醇脱水,二甲苯透明,中性树胶封固。染色结果中,细胞核呈蓝色,胞质呈红色,胶原蛋白呈蓝色。Image Pro Plus 6.0软件分析心肌纤维化程度。
免疫组织化学石蜡切片常规脱蜡至水,高温高压法进行组织抗原修复。内源性过氧化物酶阻断剂(3%过氧化氢)室温孵育5 min。滴加10%牛血清白蛋白封闭液,37 ℃条件下封闭1 h。Ⅰ型胶原抗体(1∶200)和Ⅲ型胶原抗体(1∶200)4 ℃条件下孵育过夜。二抗(1∶500)37 ℃条件下孵育1 h。切片经清洗后,加入DAB显色剂,室温显色5 min。自来水终止显色。苏木素染液染色40 s,水洗1 min。1%盐酸酒精分化3 s。切片梯度酒精脱水,二甲苯透明,中性树胶封固。Image Pro Plus 6.0软件分析心肌Ⅰ型和Ⅲ型胶原的表达。
ELISA检测所有大鼠末次给药24 h后,10%水合氯醛(300 mg/kg)腹腔麻醉后,腹主动脉取血。血液室温静置20 min后,3000 r/min离心10 min,取上清液,-80 ℃条件下保存。按照ELISA试剂盒说明书所示,检测各组大鼠血清中AngⅡ、ALD、PRA、IL-1β、IL-6和TNF-α的水平。
Western blot检测取大鼠心脏组织,充分剪碎后加入蛋白裂解液,冰上裂解30 min。离心收集所得上清液,BCA蛋白定量检测试剂盒检测蛋白浓度。各组样品分别取30 μg蛋白加入上样孔中,进行SDS-PAGE凝胶电泳,随后进行转膜操作。5%脱脂奶粉室温封闭2 h,分别加入TGF-β1(1∶1000)、p-Smad2(1∶1000)、Smad2(1∶1000)、p-Smad3(1∶1000)、Smad3(1∶1000)和GAPDH(1∶5000)抗体,置于4 ℃条件下孵育过夜。二抗(1∶5000)室温条件下孵育1 h。滴加ECL超敏化学发光液至膜上,暗室曝光,应用Image Pro Plus 6.0软件进行蛋白条带的灰度分析。
统计学处理采用SPSS 21.0软件进行数据统计分析。正态分布计量资料以均值±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
结 果
心功能指标变化Sham组大鼠心脏超声表现正常,波形明显且稳定;Model组超声表现异常,波形消失;PC组和TP组超声波形逐渐恢复(图1)。与Sham组比较,Model组大鼠LVEDd[(4.99±0.31)mm比(3.83±0.23)mm;t=8.473,P=0.003]和LVEDs[(4.42±0.37)mm比(3.15±0.18)mm;t=6.256,P=0.002]明显升高,而EF[(40.31±7.85)%比(74.74±3.35)%;t=13.174,P=0.002]和LVFS[(21.15±4.55)%比(45.01±3.07)%;t=11.853,P=0.001]则明显降低;与Model组比较,PC组和TP组大鼠LVEDd[(4.08±0.25)mm比(4.99±0.31)mm;t=6.367,P=0.003和(4.25±0.23)mm比(4.99±0.31)mm;t=5.264,P=0.003]和LVEDs[(3.56±0.21)mm比(4.42±0.37)mm;t=5.253,P=0.002和(3.64±0.25)mm比(4.42±0.37)mm;t=5.974,P=0.001]明显降低,而EF[(59.96±8.64)%比(40.31±7.85)%;t=11.264,P=0.002和(57.33±7.09)%比(40.31±7.85)%;t=10.356,P=0.001]和LVFS[(33.64±4.32)%比(21.15±4.55)%;t=8.246,P=0.002和(31.63±4.57)%比(21.15±4.55)%;t=7.824,P=0.001]则明显升高。
HMI和LVMI比较Sham组、Model组、PC组、TP组的HMI分别为(2.64±0.22)、(3.55±0.31)、(2.69±0.21)、(2.89±0.32)mg/g,差异有统计学意义(F=7.245,P=0.011);LVMI分别为(1.86±0.13)、(2.37±0.28)、(1.91±0.11)、(1.92±0.15)mg/g,差异有统计学意义(F=7.245,P=0.011)。与Sham组比较,Model组大鼠HMI(t=5.246,P=0.009)和LVMI(t=6.235,P=0.008)明显升高;与Model组比较,PC组和TP组大鼠HMI(t=5.012,P=0.007;t=4.953,P=0.005)和LVMI(t=5.531,P=0.003;t=5.483,P=0.004)明显降低。
心肌病理变化HE染色结果显示,Sham组大鼠心肌细胞结构完整、排列紧密有序,细胞形态规整,无明显损伤,无明显炎性细胞浸润;Model组大鼠心肌细胞排列紊乱,间隙增宽,肌纤维间疏松水肿,并伴有明显的炎性细胞浸润;PC组和TP组大鼠心肌细胞排列与Model组比较趋于整齐(图2)。
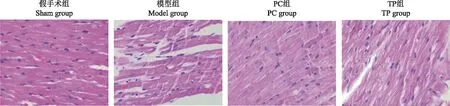
图2 HE染色检测各组大鼠心肌病理变化(×200)
细胞外基质重塑变化与Sham组比较,Model组大鼠心肌纤维化程度[(24.23±4.38)%比(6.58±0.71)%;t=9.748,P=0.001]明显升高,Ⅰ型胶原[(16.43±2.11)%比(2.61±0.29)%;t=11.754,P=0.001]和Ⅲ型胶原[(17.23±2.18)%比(3.12±0.46)%;t=10.573,P=0.001]表达也明显增加;与Model组比较,PC组和TP组大鼠心肌纤维化程度[(13.56±1.52)%比(24.23±4.38)%;t=6.734,P=0.001和(16.69±1.88)%比(24.23±4.38)%;t=5.362,P=0.001]明显降低(图3),Ⅰ型胶原[(7.16±0.84)%比(16.43±2.11)%;t=5.373,P=0.001和(9.28±1.05)%比(16.43±2.11)%;t=4.364,P=0.001]和Ⅲ型胶原[(6.75±0.83)%比(17.23±2.18)%;t=6.764,P=0.001和(9.22±1.03)%比(17.23±2.18)%;t=4.579,P=0.001]表达也明显减少(图4)。
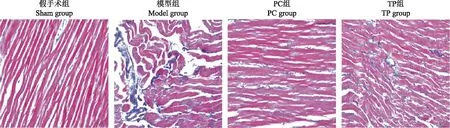
图3 Masson染色检测各组大鼠心肌纤维化(×200)
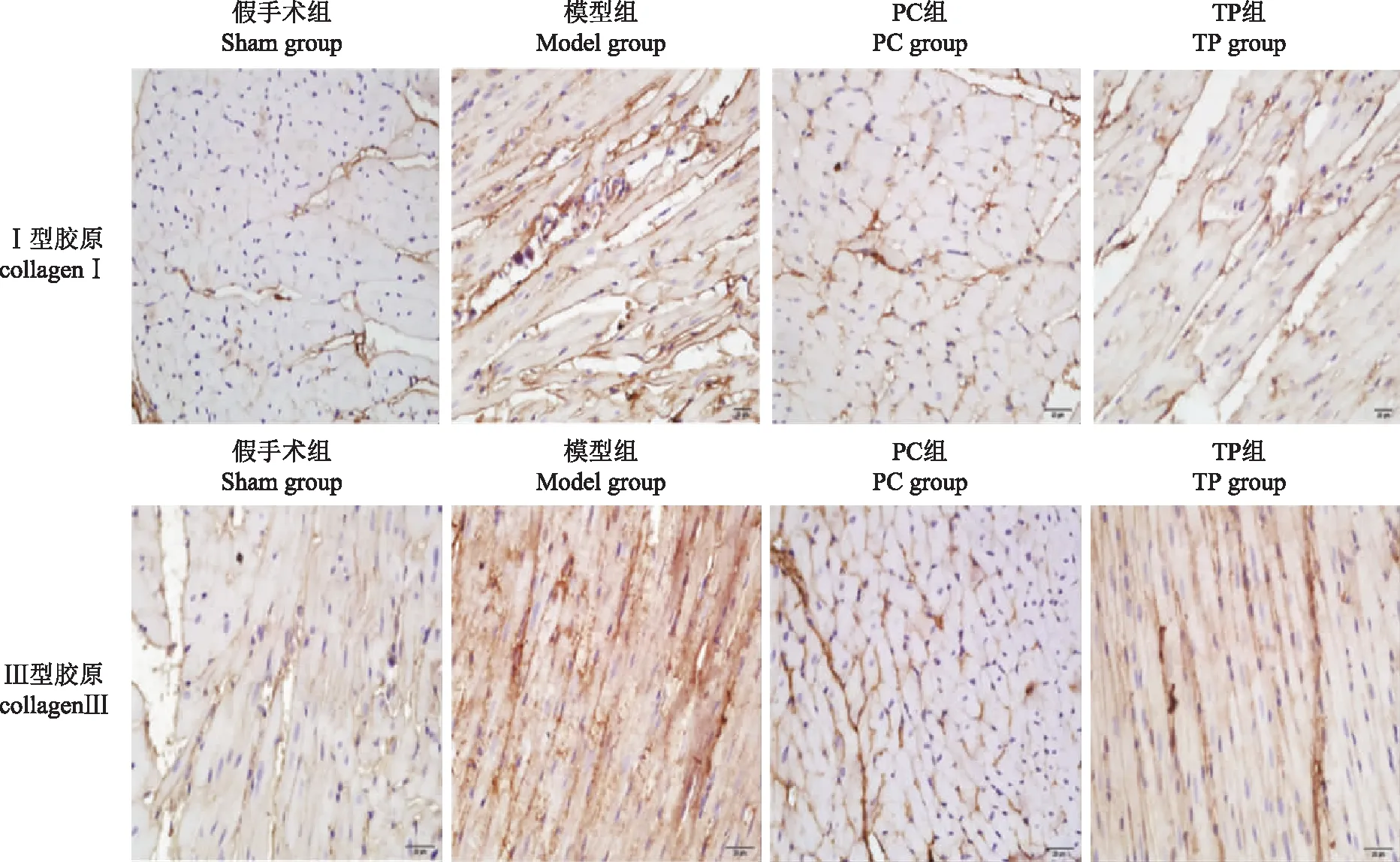
图4 免疫组织化学检测各组大鼠Ⅰ型和Ⅲ型胶原的表达(×200)
RAAS和炎症指标水平变化与Sham组比较,Model组大鼠血清中AngⅡ[(2.93±0.34)ng/ml比(1.68±0.22)ng/ml;t=4.246,P=0.001]、ALD[(184.92±21.09)pg/ml比(116.87±13.51)pg/ml;t=5.385,P=0.004]、PRA[(3.94±0.36)ng/ml比(2.73±0.29)ng/ml;t=4.386,P=0.004]水平明显升高,IL-1β[(0.37±0.04)ng/ml比(0.18±0.02)ng/ml;t=4.393,P=0.001]、IL-6[(153.53±14.30)pg/ml比(96.37±9.86)pg/ml;t=6.375,P=0.002]和TNF-α[(118.86±12.52)pg/ml比(71.23±6.83)pg/ml;t=4.753,P=0.002]水平也明显升高;与Model组比较,PC组和TP组大鼠血清中AngⅡ[(1.87±0.19)ng/ml比(2.93±0.34)ng/ml;t=3.126,P=0.001和(2.06±0.25)ng/ml比(2.93±0.34)ng/ml;t=2.853,P=0.001]、ALD[(128.64±13.26)pg/ml比(184.92±21.09)pg/ml;t=3.854,P=0.004和(147.35±15.46)pg/ml比(184.92±21.09)pg/ml;t=3.164,P=0.004]和PRA[(3.11±0.27)ng/ml比(3.94±0.36)ng/ml;t=3.126,P=0.004和(3.22±0.26)ng/ml比(3.94±0.36)ng/ml;t=3.063,P=0.004]水平明显降低,IL-1β[(0.23±0.03)ng/ml比(0.37±0.04)ng/ml;t=2.964,P=0.001和(0.28±0.02)ng/ml比(0.37±0.04)ng/ml;t=2.765,P=0.001]、IL-6[(114.02±12.55)pg/ml比(153.53±14.30)pg/ml;t=4.865,P=0.002和(120.33±11.49)pg/ml比(153.53±14.30)pg/ml;t=4.275,P=0.002]和TNF-α[(85.34±9.05)pg/ml比(118.86±12.52)pg/ml;t=3.146,P=0.002和(93.63±8.56)pg/ml比(118.86±12.52)pg/ml;t=2.973,P=0.002]水平也明显降低。
TGF-β1/Smads通路相关蛋白表达与Sham组比较,Model组大鼠TGF-β1(0.56±0.06比0.13±0.01;t=6.365,P=0.001)、p-Smad2/Smad2(1.12±0.13比0.15±0.01;t=13.755,P=0.001)和p-Smad3/Smad3(1.36±0.15比0.18±0.01;t=11.657,P=0.002)蛋白表达水平均明显升高;与Model组比较,PC组和TP组大鼠TGF-β1(0.23±0.02比0.13±0.01;t=4.657,P=0.001和0.27±0.03比0.13±0.01;t=4.176,P=0.001)、p-Smad2/Smad2(0.25±0.02比1.12±0.13;t=9.687,P=0.001和0.48±0.05比1.12±0.13;t=6.753,P=0.001)和p-Smad3/Smad3(0.78±0.07比1.36±0.15;t=6.477,P=0.002和0.83±0.09比1.36±0.15;t=4.754,P=0.002)蛋白表达水平均明显降低(图5)。
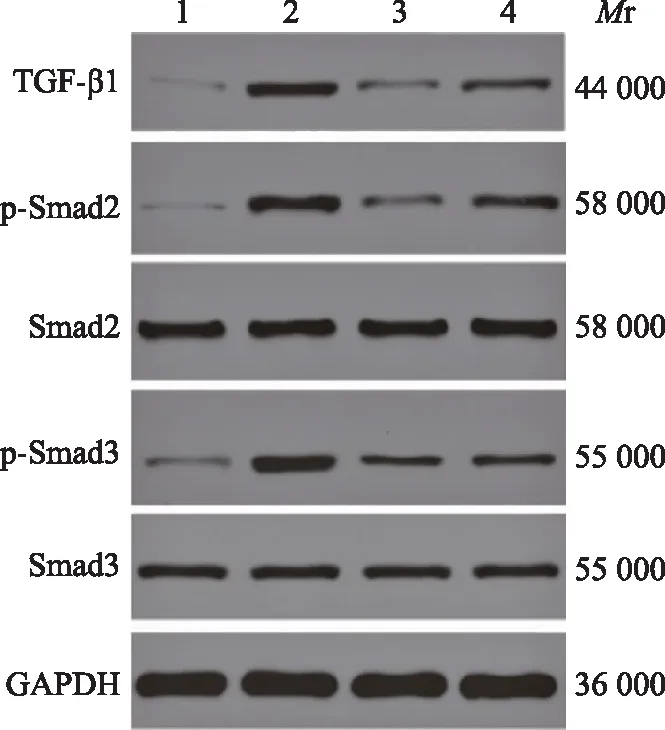
Mr:相对分子质量;1:假手术组;2:模型组;3:PC组;4:TP组;TGF-β1:转化生长因子-β1
讨 论
HF是由心脏结构或功能异常引起的心室射血或充盈障碍的复杂临床综合征。HF不仅患病率高,而且预后差,已成为老年人死亡的主要原因之一[11]。大多数学者认为左心室的病理性重构是HF发生的最重要的病理生理机制。心功能减退和左室肥厚是左室重构的主要表现[12]。目前临床上对HF的治疗,一般是在扩张血管、心搏骤停、利尿等对症治疗的基础上,采用β-受体阻滞剂和血管紧张素转换酶抑制剂来抑制HF时的神经内分泌激活,从而延缓和预防心肌重构,降低患者的住院率和死亡率。但总的来说,治疗HF的总体疗效并不理想[13]。
绿茶的主要功能成分是类黄酮、氨基酸和多糖。作为茶叶中的主要黄酮类化合物,TP占茶叶干重的30%[14]。TP在预防癌症、糖尿病、心血管和神经系统疾病中发挥重要的作用[15]。长期服用绿茶提取物可对正常心脏产生积极作用,提高能量利用率,改善正常心肌细胞的力学性能和细胞内钙动态[16]。TP对糖尿病心肌病具有突出的治疗作用,TP治疗可明显改善糖尿病心肌病大鼠心脏结构和功能,改善大鼠心肌病理变化[17]。此外,TP对心肌缺血再灌注损伤具有保护作用,TP治疗可改善大鼠心功能。在缺血再灌注早期,TP通过改善心肌能量代谢,抑制心肌细胞缓慢钙内流,从而起到一定的保护作用[18]。本研究结果显示,TP治疗可显著改善HF大鼠心功能,抑制左心室肥厚。此外,TP治疗可明显抑制HF大鼠血清中IL-1β、IL-6和TNF-α水平的升高。本研究结果表明,TP可改善心肌梗死后HF,在HF中发挥抗炎作用。
RAAS是调节血管张力、血容量和心血管功能的中枢系统,与疾病进展密切相关[19]。RAAS的慢性激活可促进和维持HF,在HF的发病机制中也起着不可或缺的作用[20]。研究证实,RAAS的主要成分AngⅡ、ALD和PRA在HF患者中显著增加[21]。此外,临床试验表明,血管紧张素转换酶抑制剂可以减缓HF的发展,降低心血管疾病的发病率和死亡率[22]。当RAAS在心肌梗死中被激活时,组织中AngⅡ和ALD含量会升高,并且伴随组织纤维化和组织炎症加重,这可能导致左心室功能障碍、心室重构和心肌细胞坏死,从而进一步加速HF的发展[23]。本研究结果显示,HF大鼠血清中AngⅡ、ALD和PRA水平明显升高,IL-1β、IL-6和TNF-α水平也明显升高,而TP治疗可明显抑制HF大鼠AngⅡ、ALD、PRA、IL-1β、IL-6和TNF-α的水平。本研究结果表明,TP可能通过抑制RAAS的过度激活和炎症反应的发生,在HF中发挥保护作用。
TGF-β1是心室重构的重要调节因子,通过调节心肌生长、肌成纤维细胞激活和细胞外基质生成参与心肌纤维化过程[24]。此外,Smad2和Smad3作为TGF-β1的重要下游信号,在TGF-β1诱导肌成纤维细胞分化过程中起着至关重要的作用,对组织纤维化具有重要促进作用[25]。磷酸化后Smad2/3可与Smad4结合形成参与基因转录调控的复合物,从而促进胶原的表达,促进心肌纤维化的形成和发展。而抑制TGF-β1/Smads 信号转导途径,可明显抑制心肌纤维化过程[26]。本研究结果显示,HF大鼠心肌中TGF-β1表达、Smad2和Smad3磷酸化水平均明显升高。此外,HF大鼠心脏纤维化程度、Ⅰ型和Ⅲ型胶原表达均明显升高。而TP治疗可抑制TGF-β1表达、Smad2和Smad3磷酸化水平,改善HF大鼠心脏纤维化程度,降低Ⅰ型和Ⅲ型胶原表达。本研究结果表明,TP可能通过抑制TGF-β1/Smads 通路的激活,抑制HF大鼠心肌纤维化过程,从而在HF中发挥保护作用。
综上,本研究结果显示,TP可能通过抑制RAAS和TGF-β1/Smads 通路的激活,抑制HF大鼠炎症反应的发生和心肌纤维化过程,从而在HF中发挥保护作用。研究成果为明确TP在HF中的作用机制及开发新的HF治疗策略提供了科学依据。
