生地黄汤HPLC指纹图谱的建立及10种成分的含量测定
2022-07-06吴梦苑樊强强翟秉涛程江雪邹俊波郭东艳
吴梦苑,樊强强,王 梅,翟秉涛,程江雪,邹俊波,郭东艳*
1.陕西中医药大学,秦药特色资源研究与开发国家重点实验室(培育)/陕西省中药基础与新药研究重点实验室,西安 712046;2.陕西中医药大学附属医院,西安 712000
生地黄汤源于唐代孙思邈的《千金方》,由生地黄和大黄组成,其质量比为30∶1。方中生地黄为主药,具有凉血止血、滋阴补肾的功效;大黄为辅药,辅助地黄活血化瘀止血。全方具有滋阴补肾、化瘀止血的功效[1-2],主要用于治疗便血和功能失调性子宫出血[3]。现代医学研究表明,地黄具有造血、促进血管内皮细胞增殖、抗氧化、提高免疫力等作用[4-7];大黄具有致泻、止血、调节机体免疫力、抗病毒等药理作用[8]。
目前,有关生地黄汤的研究主要集中于药效学研究,生地黄汤对肾虚血瘀-崩漏模型大鼠的凝血系统、血液黏度、抗炎、抗氧自由基及肾功能有明显的改善作用,也有对生地黄汤成分效应的相关性研究[2,9-12],但尚未见生地黄汤指纹图谱的相关研究报道。因此,本研究用高效液相色谱法(high performance liquid chromatography,HPLC)建立生地黄汤指纹图谱,从不同产地的生地黄、大黄样品中获得更多的化学信息。采用多种化学模式相结合的方法进行分析,对多种成分进行含量测定,从定性与定量方面对生地黄汤进行评价和质量控制,有效区分10批生地黄汤样品,为生地黄汤的质量控制和评价提供依据。
1 仪器与试药
1.1 仪器
LC-2030C 3D Plus型高效液相色谱仪(日本岛津公司);DFT-100A 型便携式100 g高速粉碎机(温岭市林大机械有限公司);MH-1000 型调温电热套(天津鑫博得仪器有限公司);Sartorius MC BT125D型十万分之一分析天平(北京科普尔科技发展有限公司);GENESPEED X1 型 离 心 机(Gene Company Limited);KH-400KDE 型高功率超声波清洗器(昆山禾创超声仪器有限公司)。
1.2 试药
梓醇(批号HC5111S1,质量分数为98%),桃叶珊瑚苷(批号HA139441198,质量分数为98%),地黄苷D(批号HS1955D1,质量分数为98%),毛蕊花糖苷(批号HA141444298,质量分数为98%),芦荟大黄素(批号HR16119S1,质量分数为98%),大黄酸(批号HS16105D2,质量分数为98%),大黄酚(批号HC152462198,质量分数为98%),大黄素甲醚(批号HR20425W1,质量分数为98%),均购自宝鸡市辰光生物科技有限公司;没食子酸(批号110831-201602)、大黄素(批号110756-201610)均购自中国食品药品检定研究院;水为娃哈哈纯净水;乙腈为Fisher色谱纯;磷酸(分析纯,天津市科密欧化学试剂有限公司)。
生地黄饮片购自陕西兴盛德药业有限责任公司和安徽普仁中药饮片有限公司,经陕西中医药大学王继涛高级实验师鉴定为玄参科(Scrophulariaceae)植物地 黄[Rehmannia glutinosa(Gaetn.)Libosch.]的新鲜或干燥块根;大黄饮片购自陕西兴盛德药业有限责任公司,经鉴定为蓼科(Polygonaceae)植物掌叶大黄(Rheum palmatumL.)的干燥根和根茎。10批生地黄汤编号为S1~S10。样品信息见表1。
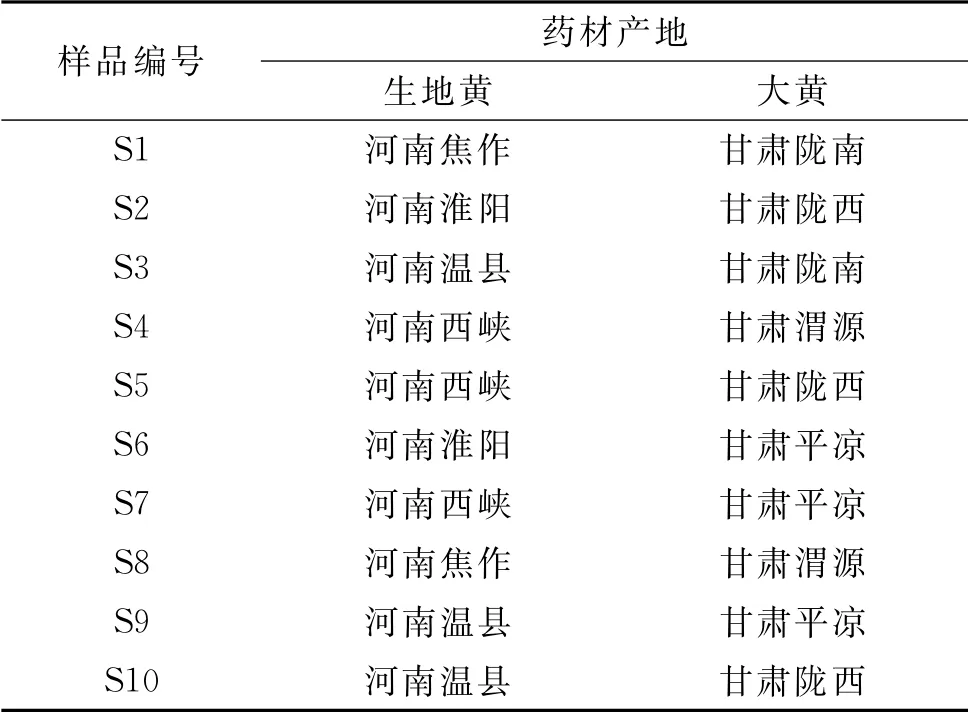
表1 样品信息Tab.1 Sample information
2 方法与结果
2.1 色谱条件
色谱柱:Shimadzu Shim-pack GIST C18(250 mm×4.6 mm,5μm);流动相:乙腈(A)-1 m L·L-1磷酸水溶液(B);梯度洗脱,洗脱条件见表2;检测波长:215 nm;流速:0.8 m L·min-1;柱温:40℃;进样量:5μL。

表2 梯度洗脱程序Tab.2 Procedure of gradient elution
2.2 溶液制备
2.2.1 生地黄汤的制备
按照处方比例称取生地黄60 g、大黄2 g,制备生地黄汤。生地黄60 g,加黄酒375 m L、水125 m L,文火煎至100 m L左右,滤出药液,再加入125 m L黄酒和250 m L 水进行二次煎煮,文火煎煮至药液剩余100 m L左右,过滤,合并2次滤液。大黄2 g粉碎过100目筛后加入药液,超声处理30 min,即得生地黄汤。
2.2.2 对照品溶液的制备
精密称取梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚适量,用色谱甲醇溶解,制成质量浓度分 别 为1.10、1.98、0.55、1.32、1.76、0.99、0.99、0.98、0.98、0.99 mg·m L-1的对照品溶液。
2.2.3 混合对照品溶液的制备
分别精密移取梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚储备液各1 m L,置于10 m L 量瓶中,制成质量浓度分别为110、198、55、132、176、99、99、98、98、99μg·m L-1的混合对照品溶液。
2.2.4 供试品溶液的制备
吸取生地黄汤5 m L,置于50 m L 量瓶中,加入甲醇定容,精密称定质量,超声(功率500 W,频率40 k Hz)处理30 min,离心(4 000 r·min-1)10 min,放冷,用甲醇补足质量,经0.22μm 有机滤膜过滤,即得。
2.3 生地黄汤指纹图谱的建立
2.3.1 精密度实验
精密吸取同一批生地黄汤(S1),按照2.1项下方法重复进样测定6 次,每次5μL,以大黄素为参照峰,记录色谱图。计算得相对峰面积的RSD 值为0.42%~2.93%,表明仪器的精密度良好。
2.3.2 稳定性实验
取2.2.4项下的供试品溶液,分别于制备后0、2、4、8、12、24 h按照2.1项下条件进样测定,以大黄素为参照峰,记录色谱图。计算得相对峰面积的RSD 为0.48%~2.96%,表明供试品溶液在24 h内稳定性良好。
2.3.3 重复性实验
精密吸取同一批生地黄汤(S1)6份,按照制备供试品溶液的方法配制,按照2.1项下条件进样测定,以大黄素为参照峰,记录色谱图。计算得相对峰面积的RSD 值为0.35%~2.70%,表明该方法的重复性良好。
2.3.4 指纹图谱的建立及相似度评价
取生地黄汤10批次为供试液,按照2.1项下色谱条件,对供试品进行检测。用“中药色谱指纹图谱相似度评价系统(2012版)”进行数据分析,以S1为参照,时间窗宽度范围为0.1 min,用平均法、多点校正和全谱峰匹配,10批生地黄汤指纹图谱和对照指纹图谱见图1。共标定21个色谱峰,其中1 号峰为梓醇、7号峰为桃叶珊瑚苷、8号峰为没食子酸、10号峰为地黄苷D、16号峰为毛蕊花糖苷、17号峰为芦荟大黄素、18号峰为大黄酸、19号峰为大黄素、20号峰为大黄酚、21号峰为大黄素甲醚。以对照指纹图谱为参照,10批样品图谱相似度分别为0.988、0.987、0.981、0.991、0.977、0.977、0.975、0.989、0.989、0.988,均大于0.90,表明生地黄汤的指纹图谱具有较好的相似性,质量稳定,能较好地反映其指纹特征。
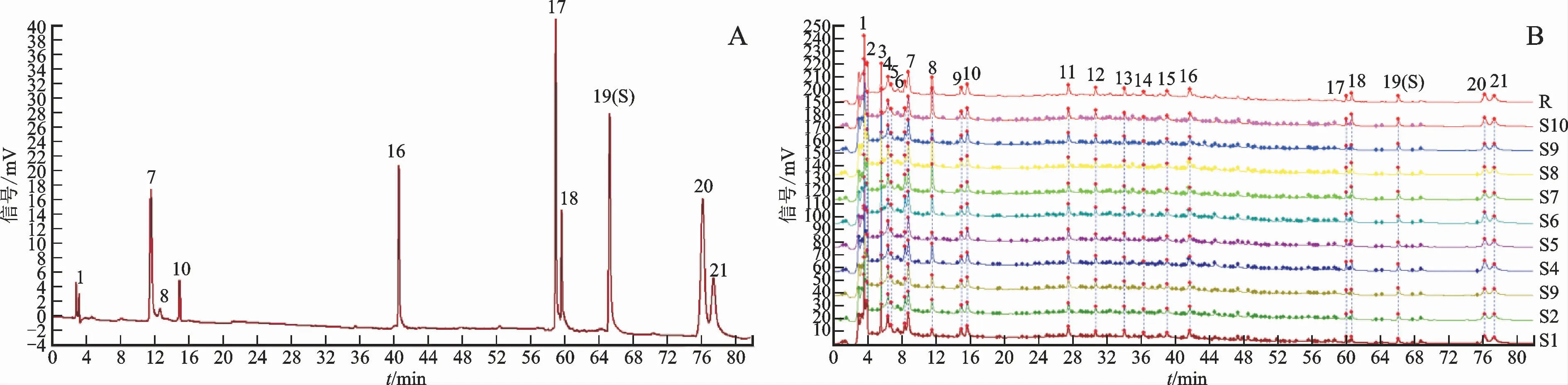
图1 HPLC指纹图谱Fig.1 HPLC fingerprints
2.3.5 聚类分析(CA)
CA 是一种多元分析技术,可根据测量的特征找到相对均匀的聚类[13]。用SPSS 26.0软件对数据进行分析,以每批次中21个共有峰的面积为变量,采用组间连接法,以平方欧氏距离为测度对样品进行聚类分析,结果见图2。当平方欧氏距离为10时,10批次生地黄汤可分为3类,第一类为S2~S7,第二类为S8~S10,第三类为S1。CA 结果表明,不同产地生地黄汤样品之间存在差异,不同产地生地黄汤S4、S5 和S7在品质上存在一定的相关性,其样品中生地黄的产地均为河南西峡。不同产地药材质量的差异对生地黄汤质量控制标准有一定影响。
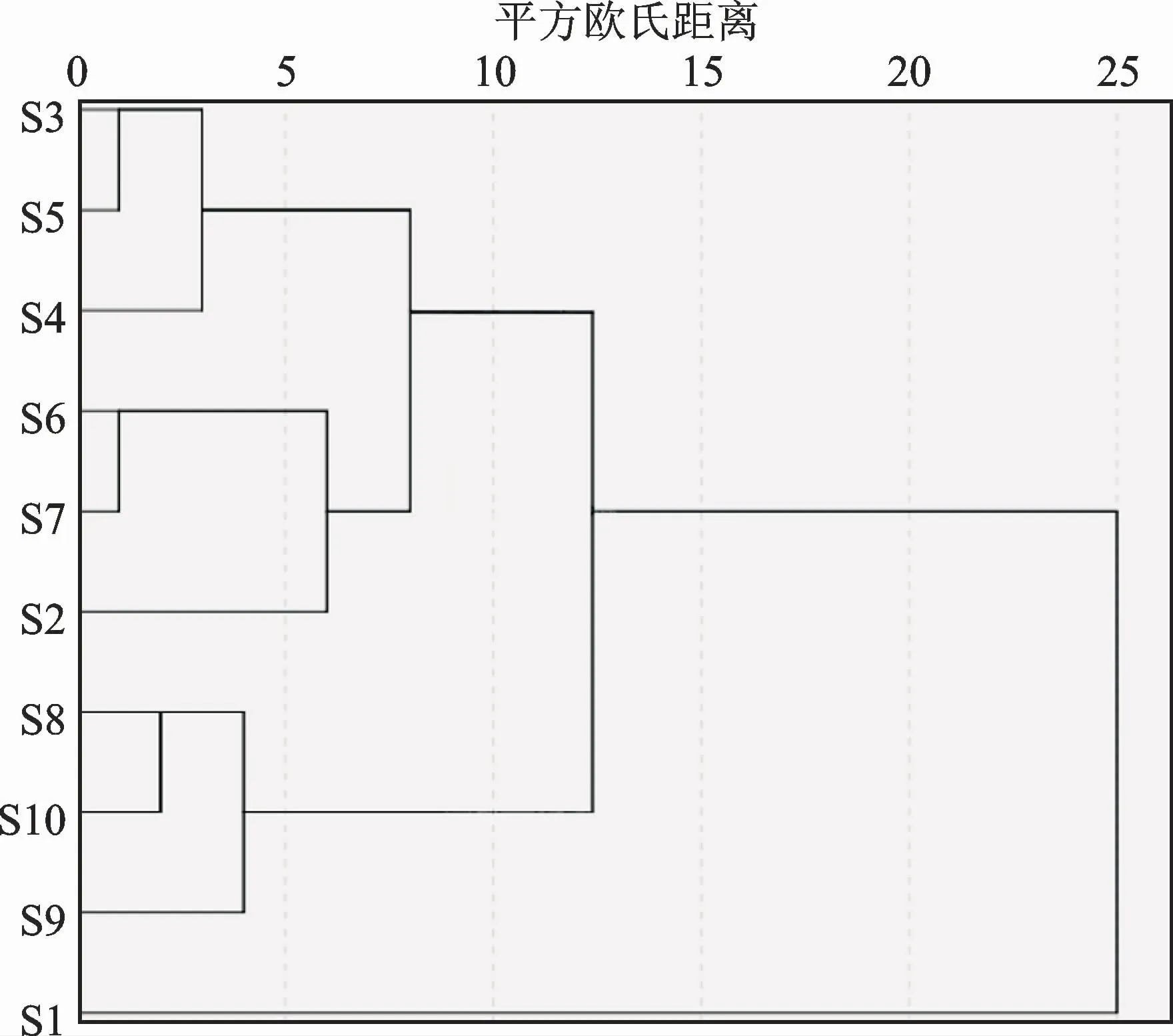
图2 10批生地黄汤样品CA树状图Fig.2 CA of 10 batches of Shengdihuang Decoction samples
2.3.6 主成分分析
主成 分 分 析(principal component analysis,PCA)是一种有效的数据降维方法[14]。以10批次生地黄汤中每批次的21个共有峰的峰面积为变量,用SPSS 26.0软件进行PCA。可以从样品数据中总结出大部分信息,结果见表3。由表3可知,前5 个主成分能较好地反映生地黄汤的基本特征和主成分信息,表明主成分因子1、2、3、4、5可作为生地黄汤的评价指标,其中特征值较大的主成分1是信息量较全面的指标。
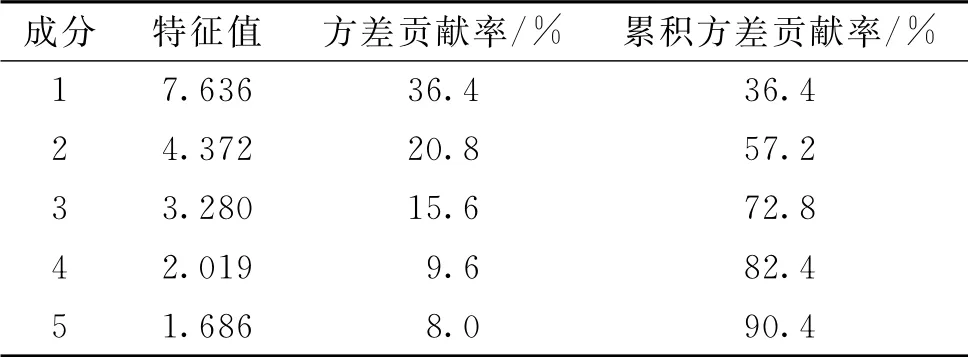
表3 特征值、方差贡献率和累计贡献率Tab.3 Eigenvalues,the variance contribution and the accumulated variance contribution
基于主成分载荷矩阵,得出10批次样品之间的差异不是受单一组分的影响,而是受多组分协同效应的影响。见表4。载荷图用来表示每个峰对主成分综合作用的贡献,每个点表示一个峰,权重越大,表明峰对样本整体分布所发挥的作用越大[15]。主成分载荷图见图3。由表4和图3可知,色谱峰1、2、3、4、6、8、9、10、21是主成分1中权重较大的成分,表明这些成分对药物的整体质量发挥主要作用。

表4 旋转变换后的因子载荷矩阵Tab.4 Factor load matrix after rotation transform
2.3.7 偏最小二乘法-判别分析
偏最小二乘法-判别分析(partial least squaresdiscriminate analysis,PLS-DA)是一种直观、效果明显、预测精度高、解释能力强的监督模式识别方法[16]。将10 批次样品21个共有峰面积导入SIMCA-P 14.1分析软件中,启动PLS-DA 分析程序生成矩阵图、载荷散点图和变量重要性投影(variable importance in Projection,VIP)值图,结果见图4、图5、图6。
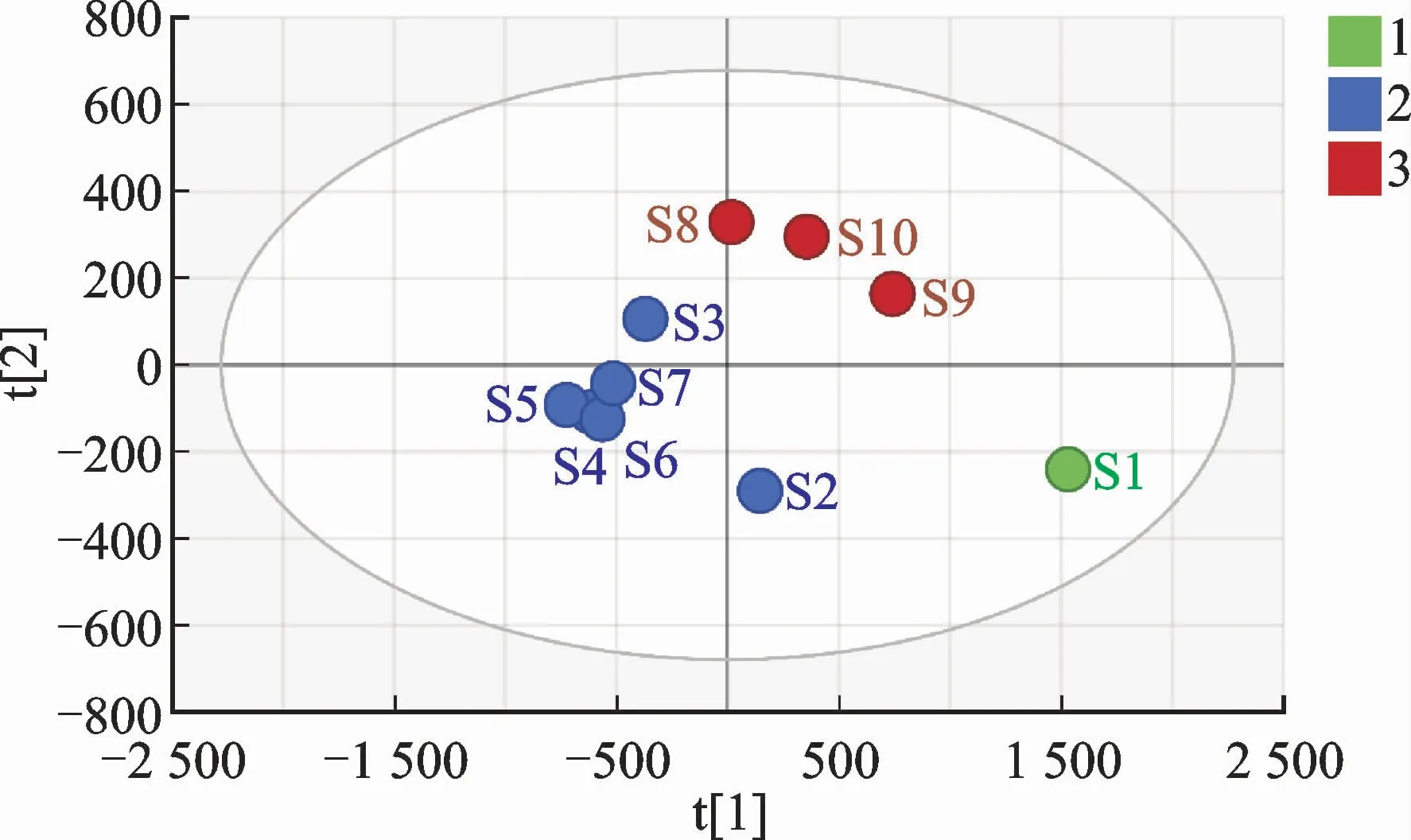
图4 PLS-DA得分矩阵Fig.4 PLS-DA score matrix
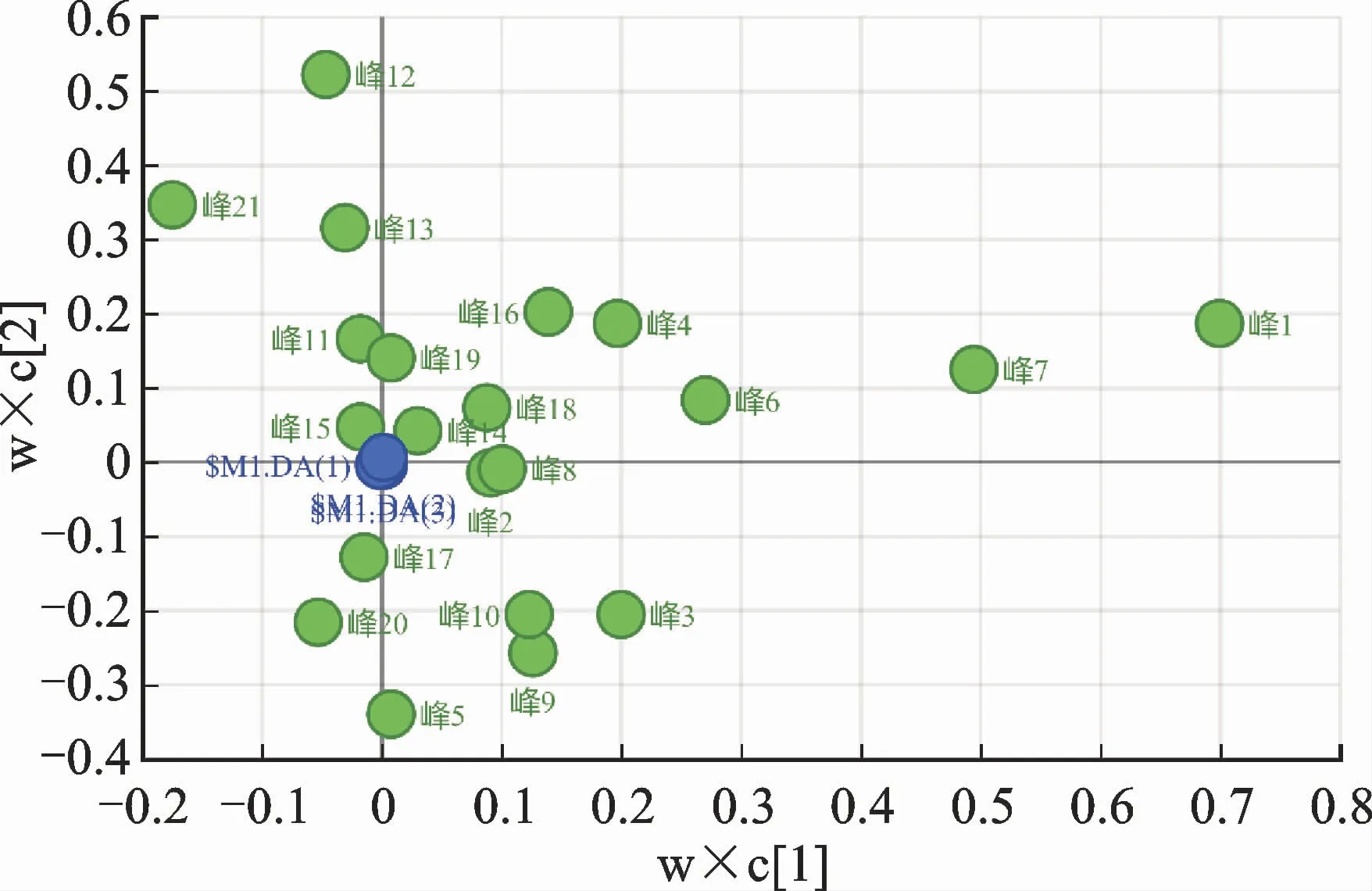
图5 PLS-DA载荷散点图Fig.5 PLS-DA loading plot
结果显示,10批次生地黄汤样品共聚为3类,S2~S7为第1类,S8~S10为第2类,S1为第3类,此分类结果与CA 和PCA 分析结果相一致。
载荷散点图中每一个点均代表一个变量,距离原点位置越远,则表明该变量权重值越大,对样本的识别能力也越强。结合图6可知,每个点的影响度排序为峰1>峰7>峰12>峰21>峰5>峰3>峰6>峰13>峰9>峰10>峰8>峰4>峰20>峰16>峰11>峰19>峰2>峰18>峰17>峰15>峰14。

图6 PLS-DA VIP值图Fig.6 VIP plot of PLS-DA
其中峰1(梓醇)、峰7(桃叶珊瑚苷)、峰12、峰21(大黄素甲醚)、峰5,峰3,峰6,VIP值>1,说明差异有统计学意义,可以选作差异标志物,其依次为峰13、峰9、峰10(地黄苷D)、峰8(没食子酸)、峰4、峰20(大黄酚)、峰16(毛蕊花糖苷)、峰11、峰19(大黄素)、峰2、峰18(大黄酸)、峰17(芦荟大黄素)、峰15、峰14,故选取差异性较大且已知的10种成分进一步进行含量测定。
2.4 多成分含量测定
2.4.1 色谱条件
按照2.1项下色谱条件进样测定。
2.4.2 线性关系考察
吸取2.2.3项下的混合对照品溶液,加色谱纯甲醇稀释至不同质量浓度水平,进样分析,记录色谱图及峰面积,以质量浓度为横坐标(x)、峰面积为纵坐标(y),进行线性回归。结果见表5。
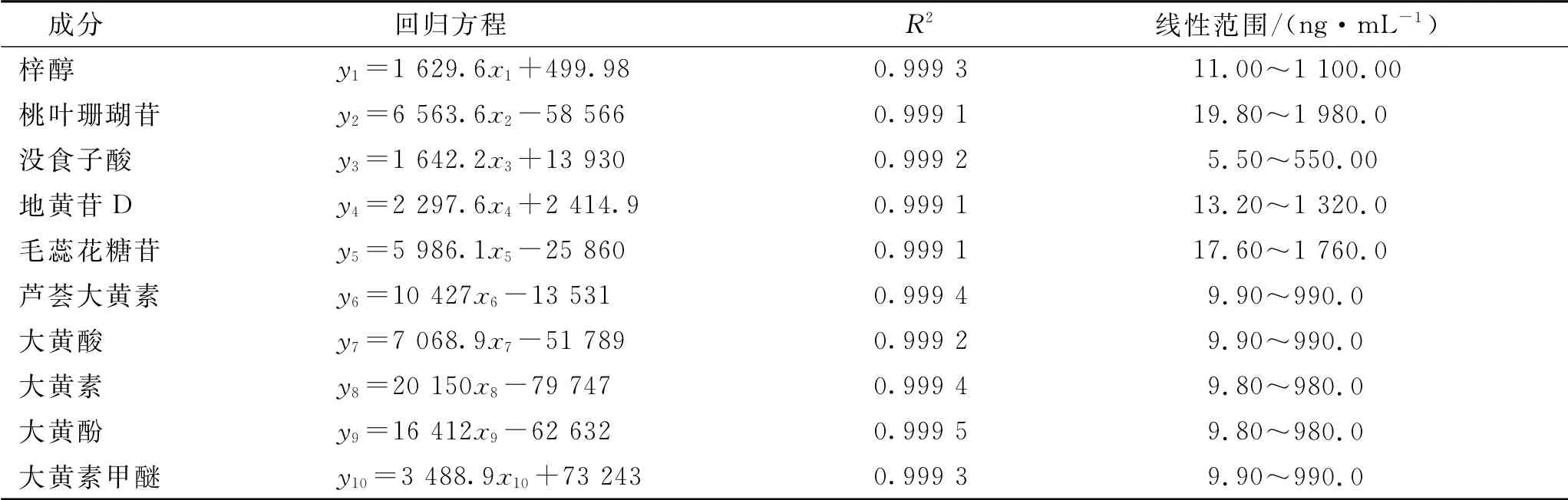
表5 10种成分的回归方程和线性范围Tab.5 Regression equations and linear ranges of the 10 constituents
2.4.3 精密度实验
精密吸取同一供试品溶液(S1),按照2.4.1项下方法重复进样测定6次,测定梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚,各成分峰面积的RSD 值依 次 为1.66%、2.48%、2.08%、2.26%、0.48%、0.45%、0.42%、0.68%、1.05%、2.50%,表明仪器的精密度良好。
2.4.4 稳定性实验
取2.2.4项下的供试品溶液,分别于制备后0、2、4、8、12、24 h 按照2.4.1 项下方法进样,测定梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚,各成分峰 面 积 的RSD 依 次 为2.63%、2.96%、2.22%、0.80%、1.55%、0.47%、1.05%、2.07%、0.89%、1.53%,表明供试品溶液在24 h内稳定性良好。
2.4.5 重复性实验
取S1批次生地黄汤,按制备供试品溶液的方法配制6份,按2.4.1项下方法进样测定,测得梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的平均质量浓度分别为1.88、5.33×10-2、1.41×10-1、2.84×10-1、1.00、1.80×10-3、9.19×10-2、2.16×10-3、6.28×10-2、9.27×10-4mg·m L-1;质量浓度的RSD 值 分 别 为0.98%、2.80%、1.12%、2.79%、2.87%、2.10%、1.96%、2.85%、3.14%、2.85%,表明该方法的重复性良好。
2.4.6 加样回收率实验
精密吸取已知含量的生地黄汤(S1)9份,按照供试品溶液的制备方法制备9份供试品溶液,分别加入适量的对照品。按照2.4.1项下方法进样测定,计算梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的平均加样回收率。计算得梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的平均加样回收率分别为97.62%、98.97%、97.05%、96.30%、98.58%、96.97%、98.83%、97.67%、96.93%、98.55%,RSD值分别为1.53%、0.56%、1.94%、2.43%、1.03%、1.86%、0.83%、1.34%、2.21%、0.97%,表明该方法的准确度良好。
2.4.7 样品含量测定
取10批生地黄汤供试品溶液,按2.4.1项下方法测定,计算各种成分的质量浓度,结果见表6。结果表明,10批样品中梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的质量浓度依次为0.67~1.88、1.30×10-2~5.33×10-2、2.33×10-2~27.15×10-2、1.87×10-1~3.03×10-1、0.53~1.05、1.01×10-3~2.19×10-3、4.3×10-2~9.9×10-2、1.8×10-3~2.6×10-3、4.6×10-2~8.2×10-2、9.3×10-4~14.0×10-4mg·m L-1,其中梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷等成分的质量浓度较高,不同批次间各组分质量浓度差异较大,这主要是受原料质量的影响。
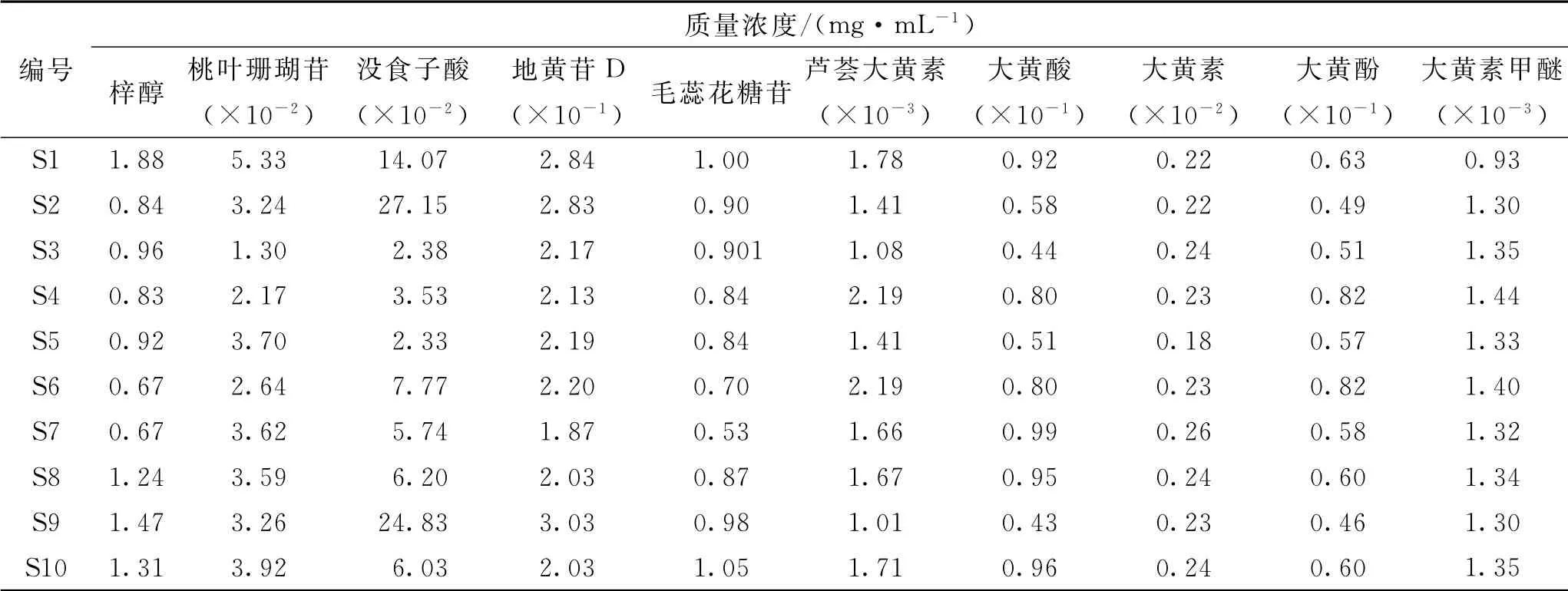
表6 10批生地黄汤中10种成分的质量浓度Tab.6 Contents of 10 compounds in 10 batches of Shengdihuang Decoction
3 讨论
3.1 色谱条件的筛选
本研究考察了不同流动相体系(乙腈-1 mL·L-1磷酸水溶液、乙腈-2 m L·L-1磷酸水溶液、乙腈-水、甲醇-水),不同的柱温(30、35、40℃),不同的检测波长(215、254、290 nm)对色谱峰的影响。结果表明,将乙腈-1 m L·L-1磷酸水溶液作为流动相,柱温为40℃,检测波长为215 nm作为色谱条件时,出峰数量较多、峰形较好且峰面积较大。
3.2 指纹图谱分析
大黄素是大黄的主要活性成分,且大黄素色谱峰响应值较高,出峰时间稳定、适中,因此选择大黄素为参照峰。本研究建立10 批次生地黄汤的HPLC 指纹图谱,共标定21个共有峰,并将21个共有峰进行化学模式识别分析。对10 批样品进行CA,结果表明,可将其分为3类,该实验结果可能与药材产地具有一定相关性,如含有河南西峡生地黄的地黄汤聚为一类。PCA 结果表明,样本KMO 值大于0.65,Bartlett检验结果也具有显著性差异(P<0.05)。PLS-DA 分析结果表明,模型解释率参数R2Y=0.828,预测能力参数R2X=0.546,两者均大于0.5,差异小于0.3,表明该模型具有较好的拟合度、较强的稳定性和可预测性。设置分类Y 矩阵变量随机排列200 次做置换检验,得Q2 拟合直线截距为-0.0571,小于0.05,证明了在该分类中不存在过拟合的现象。结果表明,3种化学模式识别分析的结果一致,可将10批次生地黄汤物质基准分为3类,与配伍药材产地具有一定的相关性。同时,结合10批次生地黄汤指纹图谱共有峰的响应强度,可以看出,在同样条件下,部分样品峰面积较小,部分样本峰面积相对较大,表明不同地区的样品之间存在一定的差异。
3.3 定量指标的选择
中药制剂化学成分复杂,各成分之间可能存在相互作用与影响,但选择具有代表性的化学成分进行含量测定,在一定程度上可以反映中药制剂的质量[17]。目前,尚未见对生地黄汤质量评价的研究报道。该方以生地黄为主药、大黄为辅药,具有滋阴补肾、化瘀止血的功效,主要用于便血和功能失调性子宫出血的治疗。梓醇和毛蕊花糖苷为地黄的主要活性成分,梓醇具有降血糖、抗炎和抗氧化应激等作用[18],毛蕊花糖苷具有调节免疫、保护肝脏和增强记忆力等药理作用[19]。没食子酸对心血管系统疾病、神经系统疾病、糖尿病、肝纤维化和癌症等具有预防和治疗作用[20]。桃叶珊瑚苷具有抗氧化、抗炎、抗菌、保护神经和抗肿瘤等药理活性[21]。大黄的有效生物活性成分主要包括大黄酚、大黄酸、大黄素、大黄多糖等,其中大黄素具有多种药理作用,如抗癌、抗炎、镇痛、保护器官等[22];大黄酚具有多种药理活性,如抗癌、抗肿瘤、保护神经、改善学习和认知障碍、保护心肌等[23];大黄酸具有广泛的药理作用,包括抗炎、抗氧化应激、抗肿瘤、抗纤维化、调脂、降糖、抗病毒、抗菌等多种作用[24]。由于该方生地黄和大黄质量配伍关系为30∶1,可能导致大黄中的各成分含量相对较低,但大黄作为辅药其功效也不可或缺,因此,结合生地黄汤配伍特点及2020年版《中华人民共和国药典》对各药味含量测定成分分析,综合考虑不同批次物质基准指纹图谱共有峰的PLS-DA 分析结果,选择与功效相关且差异性较大的梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚10种成分进行含量测定。
综上所述,本研究建立了10 批次生地黄汤的HPLC指纹图谱,共确定21个共有峰,指认出梓醇、桃叶珊瑚苷、没食子酸、地黄苷D、毛蕊花糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚10种成分,并测定其含量。同时,采用不同的方法进行统计分析,能够较为全面地对生地黄汤进行质量评价,并且为生地黄汤物质基础及后续复方制剂的研发提供依据。
