吡法齐明与贝达喹啉协同作用及机制的初步研究
2022-07-06刘海婷李东硕张蕾王宁王彬丁杨明姚蓉陆宇
刘海婷 李东硕 张蕾 王宁 王彬 丁杨明 姚蓉 陆宇
耐药结核病的迅速出现对结核病化疗提出了挑战,需要开发新的药物和治疗方案,并且对现有抗结核药物间相互作用的研究将有助于开发更好的协同药物组合。吡法齐明(pyrifazimine,TBI-166)是我国自主研发的抗耐药结核病新药,在体外及小鼠体内研究中发现其具有较好的安全性和有效性[1-2],目前正在进行Ⅱ期临床试验。TBI-166的作用机制尚不明确,笔者所在课题组前期对TBI-166的作用机制进行了研究,发现其通过累积活性氧(ROS),降低三磷酸腺苷(ATP)水平,从而发挥抗结核活性[3-4]。由于结核病的治疗依赖于有效的药物组合方案,因此,对TBI-166的药物组合进行抗结核活性研究十分必要。为此,笔者所在课题组基于前期研究结果,着重开展TBI-166与贝达喹啉(bedaquiline,Bdq)、莫西沙星(moxifloxacin,Mfx)、德拉马尼(delamanid,Dlm)、SQ109、PBTZ169的两药组合对3株结核分枝杆菌(MTB)临床分离株(包括2株药物敏感菌、1株耐药菌)的体外抗结核活性,并初步探讨TBI-166与Bdq的协同作用机制,以期发现更有效的抗结核新方案。
材料和方法
一、 材料
1.实验菌株:MTB标准株H37Rv(ATCC 27294)、2株药物敏感性MTB临床分离株(菌株编号:30031和30091),以及1株前广泛耐药结核分枝杆菌(pre-XDR-MTB)临床分离株(菌株编号:13385;对异烟肼、利福平、氟喹诺酮类药物耐药)于北京市结核病胸部肿瘤研究所药物学研究室保存。
2.主要仪器:高压蒸汽灭菌器(日本三洋公司)、超低温冰箱(日本三洋公司)、METTLER TOLEDO电子天平(瑞士梅特勒-托利多集团)、电热恒温水浴锅(广东环凯微生物科技有限公司)、Tecan Infinite 200酶标仪(瑞士帝肯集团公司)、二级生物安全柜(新加坡Esco公司)、二氧化碳恒温培养箱(美国赛默飞世尔科技公司)、MaX-Q8000低温摇床(美国赛默飞世尔科技公司)、1730R微量高速冷冻离心机(美国基因技术公司)。
3.材料及试剂:二分隔培养皿、涂布器、Alamar Blue指示剂(英国AbD Serotec公司);7H9液体培养基干粉、7H10固体培养基干粉(美国Becton Dickinson公司);二甲基亚砜(dimethyl sulfoxide,DMSO;北京索莱宝科技有限公司);丙三醇(北京化工厂);细菌ROS检测试剂盒(上海贝博生物科技有限公司;批号:BB-46111)、ATP检测试剂盒(上海碧云天生物技术有限公司)。
4.实验药物:TBI-166(纯度>99%,由中国医学科学院药物研究所黄海洪教授课题组提供)、异烟肼(isoniazid,INH;纯度≥99%,美国Sigma公司)、利福平(rifampicin,RFP;纯度≥97%,美国Sigma公司)、Bdq(纯度>99%,上海瀚香生物科技有限公司)、Mfx(纯度>98%,上海瀚香生物科技有限公司)、Dlm(美国TargetMol公司)、SQ109(纯度>98%,上海昶衍化工科技有限公司)、PBTZ169(由中国医学科学院医药生物技术研究所刘明亮课题组合成)。
二、 方法
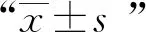
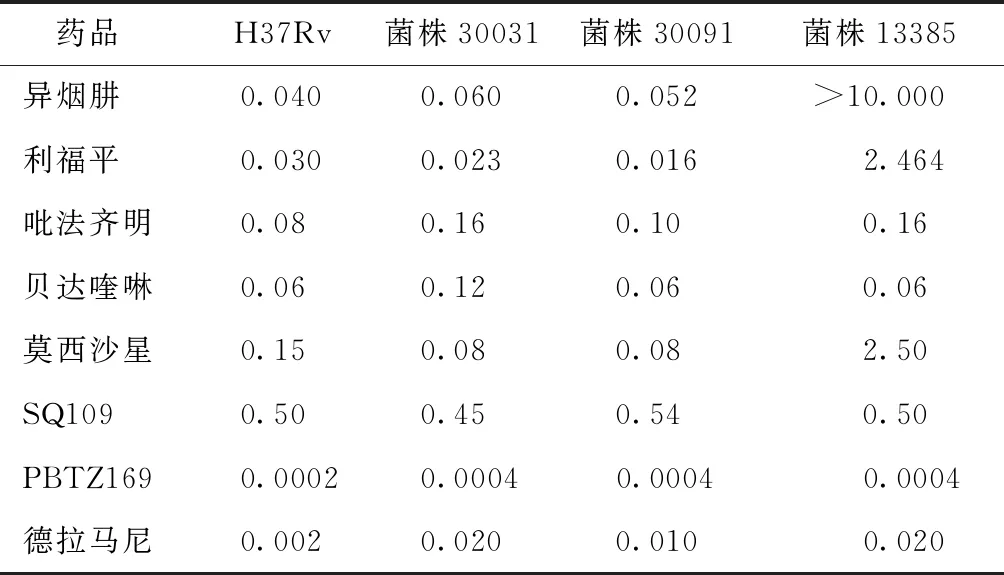
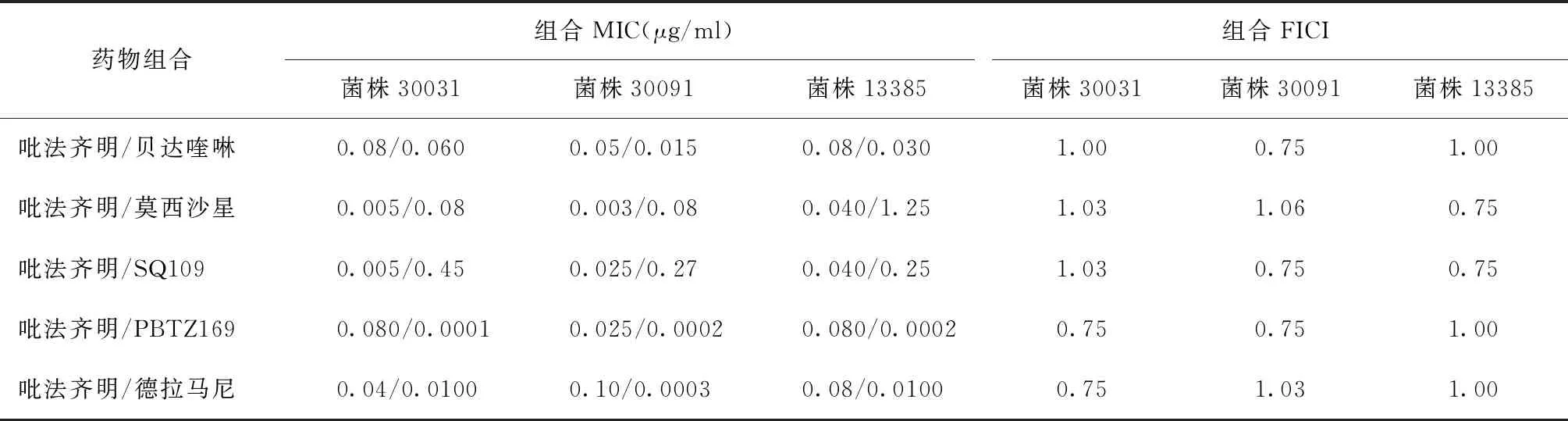
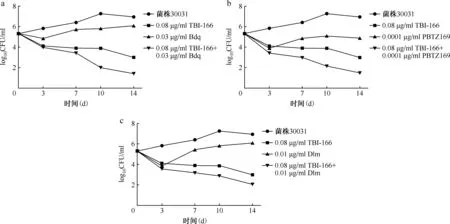
1.棋盘法测定两药组合的相互作用:将TBI-166、INH、RFP、Bdq、Mfx、Dlm、SQ109、PBTZ169以DMSO为溶剂配制成2 mg/ml的储备液,以7H9肉汤进行稀释,通过微孔板阿尔玛蓝染色法(microplate alamar blue assay,MABA)[5],采用连续二倍稀释测定药物对3株MTB临床分离株的最低抑菌浓度(minimal inhibitory concentration,MIC)。应用棋盘法在96孔板中测定TBI-166与其他抗结核药物合用的MIC,96孔板中每孔含有经二倍稀释的TBI-166和另一种抗结核药物(Bdq、Mfx、Dlm、SQ109、PBTZ169),按棋盘方式进行分配[6-7],两者的最终浓度分别为各药物的2×MIC-1/16×MIC。通过观察96孔板中颜色的变化来确定药物联合应用中单药的MIC。组合作用由分级抑菌浓度指数(fractional inhibitory concentration index,FICI)确定,FICI=(MICA联合/MICA单独)+(MICB联合/MICB单独),MICA单独和MICB单独分别表示A药和B药单用时的MIC,MICA联合和MICB联合分别表示A药和B药组合后相应的MIC。两药组合相互作用的判定标准如下:当FICI≤0.5时,两药为协同作用;当0.5 2.时间杀菌曲线法评估含TBI-166的两药组合的抗菌活性:采用时间杀菌曲线法进一步评估具有部分协同或相加作用的含TBI-166两药组合的抗菌效果,各药物浓度设定为1/2MIC或1/4MIC。 具体操作方法:在24孔板中设置各亚抑制浓度(1/2MIC或1/4MIC)的单药孔及两药联用孔,以7H9进行稀释,调整每孔菌终浓度为1×105CFU/ml,将24孔板在37 ℃含5%的CO2培养箱中培养14 d。分别在给药当天(D0)、第3天、第7天、第10天和第14天,吸取100 μl,以无菌1×磷酸盐缓冲液(PBS)作为稀释液进行连续10倍稀释,吸取100 μl的上述稀释菌液涂布在含10%OADC、0.5%丙三醇的7H10固体培养板上培养3~4周。 两药相互作用的定义:与两药组合中抗菌活性最好的单药相比,药物联合作用使活菌数减少量≥2 log10CFU/ml被认为是协同作用;1 log10CFU/ml<活菌数减少量<2 log10CFU/ml被认为是相加作用;活菌数减少量≤1 log10CFU/ml被认为是无关作用;活菌数增加量≥2 log10CFU/ml被认为是拮抗作用[9]。 3.MTB菌体内ATP含量测定:采用ATP检测试剂盒检测MTB经药物处理24 h后菌体内的ATP含量变化,具体操作步骤:(1)药物处理MTB:取培养至对数生长期[吸光度(A)值=0.4]的H37Rv标准株菌液,将菌液加入至50 ml细胞培养瓶中,每瓶10 ml,设置不同处理组:空白对照组(H37Rv标准株)、TBI-166处理组(0.04、0.4、4 μg/ml)、Bdq处理组(0.03、0.3、3 μg/ml)、两药联用组(0.04 μg/ml TBI-166+0.03 μg/ml Bdq、0.4 μg/ml TBI-166+0.3 μg/ml Bdq),分别处理H37Rv标准株菌液24 h后检测菌体内ATP含量。(2)ATP检测:用酶标仪测定波长570 nm下各药物处理组的A值,于每组中吸取4×107个菌体至1.5 ml高压过的EP管中,13 570×g离心5 min,弃上清,用无菌1×PBS重悬菌体,离心,弃上清,重复洗涤2次。加入200 μl裂解液,振荡器振荡混匀,在冰上溶解ATP检测工作液,并按1∶9的比例将ATP检测液加入ATP稀释液中,避光混匀,将96孔黑板中加入100 μl裂解菌液和100 μl稀释后的ATP检测液,酶标仪测定相对光单位(relative light unit,RLU)值。 4.MTB菌体内ROS含量测定:采用细菌ROS检测试剂盒检测MTB经药物处理24 h后菌体内的ROS含量变化,具体操作步骤:(1)药物处理MTB:取培养至对数生长期(A=0.4)的H37Rv标准株菌液,将菌液加入至50 ml细胞培养瓶中,每瓶10 ml,设置不同处理组:空白对照组(H37Rv标准株)、TBI-166处理组(0.04、0.4和4 μg/ml)、Bdq处理组(0.03、0.3、3 μg/ml)、两药联用组(0.04 μg/ml TBI-166+0.03 μg/ml Bdq、0.4 μg/ml TBI-166+0.3 μg/ml Bdq)分别处理H37Rv标准株24 h后用酶标仪测定荧光值。(2)ROS检测:按照试剂盒操作步骤进行,事先将探针稀释液B从-20 ℃冰箱中取出,待其融化后用纯水将其10倍稀释即制得探针稀释液;用10倍稀释后的探针稀释液将探针进行1000倍稀释即配制成染色工作液。从各处理组中吸取108个菌体并于6000×g离心10 min,弃上清,用无菌1×PBS重悬菌体,离心,弃上清,重复洗涤2次。于每管中加入1 ml染色工作液重悬菌体,并在37 ℃下避光孵育30 min,孵育结束后离心收集菌体,用1×PBS重悬菌体,离心,弃上清。于每管中加入500 μl无菌1×PBS,重悬菌体,充分混匀,吸取200 μl加入到96孔黑板中,将上述96孔黑板置于酶标仪中,测定激发波长488 nm,发射波长526 nm下各组荧光值。 采用MABA法测定TBI-166与抗耐药结核病新药对H37Rv菌株及3株MTB临床分离株的MIC值,结果显示,所有菌株均对TBI-166、Bdq、Dlm、SQ109、PBTZ169敏感,其MIC值介于0.0004~0.54 μg/ml(表1)。 表1 抗结核药物对4株结核分枝杆菌菌株的体外最低抑菌浓度 (μg/ml) 棋盘法测定TBI-166与上述药物组合的相互作用结果见表2。结果显示,TBI-166与Bdq、PBTZ169、Dlm的两药组合对菌株30031的相互作用均为部分协同或相加作用,FICI值分别为1.00、0.75、0.75;TBI-166与Bdq、SQ109、PBTZ169两药组合对菌株30091的相互作用均为部分协同,FICI值均为0.75;TBI-166与Bdq、Mfx、SQ109、PBTZ169、Dlm的两药组合对菌株13385的相互作用为部分协同或相加作用,FICI值为0.75或1.00。 单药及两药组合对MTB临床分离株30031的时间杀菌曲线图显示TBI-166与Bdq、PBTZ169两药组合对菌株30031的杀伤具有相加作用,而TBI-166与Dlm两药组合显示无相互作用(图1)。各药物单用时对MTB无明显杀伤作用,当0.08 μg/ml TBI-166分别与0.03 μg/ml Bdq、0.0001 μg/ml PBTZ169 两药联用与MTB孵育14 d后显示具有部分协同杀菌活性,与0.08 μg/ml TBI-166相比活菌量分别降低1.59 log10CFU/ml和1.51 log10CFU/ml(图1a和图1b);0.08 μg/ml TBI-166与0.01 μg/ml Dlm联用与MTB孵育14 d后抗菌活性与0.08 μg/ml TBI-166单独应用时相比活菌量仅降低0.94 log10CFU/ml(图1c),表明两药组合无相互作用。 单药及两药组合对MTB临床分离株30091的时间杀菌曲线图显示TBI-166与Bdq、PBTZ169、SQ109的两药组合均对菌株30091的杀伤具有相加作用,比单药作用后抗菌活性增强(图2)。0.05 μg/ml TBI-166分别与0.03 μg/ml Bdq、0.0002 μg/ml PBTZ169两药联用与MTB孵育14 d后与0.05 μg/ml TBI-166相比活菌量分别降低1.27 log10CFU/ml和1.18 log10CFU/ml(图2a和图2b);而当0.05 μg/mlTBI-166与0.27 μg/ml SQ109联用与MTB孵育14 d后与0.27 μg/ml SQ109相比活菌量降低1.1 log10CFU/ml(图2c),上述结果均表明当Bdq、PBTZ169、SQ109分别与TBI-166组合后能增强TBI-166的抗结核活性。 表2 抗结核药物组合对3株临床分离菌株的部分抑菌浓度指数 注 图a为0.08 μg/ml TBI-166、0.03 μg/ml Bdq单用及两药组合时对菌株30031的时间杀菌曲线图;图b为0.08 μg/ml TBI-166、0.0001 μg/ml PBTZ169单用及两药组合时对菌株30031的时间杀菌曲线图;图c为0.08 μg/ml TBI-166、0.01 μg/ml Dlm单用及两药组合时对菌株30031的时间杀菌曲线图。TBI-166:吡法齐明;Bdq:贝达喹啉;Dlm:德拉马尼;菌株30031:药物敏感性结核分枝杆菌临床分离株图1 单药及两药组合对结核分枝杆菌临床分离菌株30031的时间杀菌曲线图 注 图a为0.05 μg/ml TBI-166、0.03 μg/ml Bdq单用及两药组合时对菌株30091的时间杀菌曲线图;图b为0.05 μg/ml TBI-166、0.0002 μg/ml PBTZ169单用及两药组合时对菌株30091的时间杀菌曲线图;图c为0.05 μg/ml TBI-166、0.27 μg/ml SQ109单用及两药组合时对菌株30091的时间杀菌曲线图。TBI-166:吡法齐明;Bdq:贝达喹啉;菌株30091:药物敏感性结核分枝杆菌临床分离株图2 单药及两药组合对结核分枝杆菌临床分离株30091的时间杀菌曲线图 注 图a为0.04 μg/ml TBI-166、0.125 μg/ml SQ109单用及两药组合时对菌株13385的时间杀菌曲线图;图b为0.04 μg/ml TBI-166、0.0001 μg/ml PBTZ169单用及两药组合时对菌株13385的时间杀菌曲线图;图c为0.04 μg/ml TBI-166、0.015 μg/ml Bdq单用及两药组合时对菌株13385的时间杀菌曲线图;图d为0.04 μg/ml TBI-166、0.005 μg/ml Dlm单用及两药组合时对菌株13385的时间杀菌曲线图;图e为0.04 μg/ml TBI-166、0.625 μg/ml Mfx单用及两药组合时对菌株13385的时间杀菌曲线图。TBI-166:吡法齐明;Bdq:贝达喹啉;Dlm:德拉马尼;Mfx:莫西沙星。菌株13385:前广泛耐药结核分枝杆菌临床分离株图3 单药及两药组合对结核分枝杆菌临床分离株13385的时间杀菌曲线图 单药及两药组合对MTB临床分离株13385的时间杀菌曲线图显示TBI-166与SQ109、PBTZ169的两药组合对菌株13385的杀伤具有协同作用,比单药作用后抗菌活性明显增强(图3)。0.04 μg/ml TBI-166分别与0.125 μg/ml SQ109、0.0001 μg/ml PBTZ169两药联用与MTB孵育14 d后分别与两药组中活性较好的单药(0.125 μg/ml SQ109和0.04 μg/ml TBI-166)相比活菌量降低3.58 log10CFU/ml和2.82 log10CFU/ml(图3a和图3b);TBI-166与Bdq、Dlm、Mfx的两药组合对菌株13385的杀伤具有相加作用,当0.04 μg/ml TBI-166与0.015 μg/ml Bdq、0.005 μg/ml Dlm、0.625 μg/ml Mfx联用与MTB孵育14 d后与0.04 μg/ml TBI-166相比活菌量分别降低1.70 log10CFU/ml、1.84 log10CFU/ml、1.90 log10CFU/ml(图3c至图3e),上述结果均表明当SQ109、PBTZ169、Bdq、Dlm、Mfx分别与TBI-166组合后能增强TBI-166的抗结核活性。 采用不同浓度的TBI-166与Bdq刺激H37Rv标准株24 h后,空白对照组、0.04 μg/ml TBI-166组、0.4 μg/ml TBI-166组、4 μg/ml TBI-166组、0.03 μg/ml Bdq组、0.3 μg/ml Bdq组、3 μg/ml Bdq组、0.04 μg/ml TBI-166+0.03 μg/ml Bdq组、0.4 μg/ml TBI-166+0.3 μg/ml Bdq组菌体内RLU值分别为756 971.20±69 110.53、557 022.17±112 487.20、498 944.17±56 804.81、446 099.40±28 559.58、450 618.67±85 299.64、208 599.20±24 078.74、47 879.40±6562.80、359 801.40±40 648.56、115 160.67±19 129.79,各给药组菌体内ATP含量呈下降趋势,差异有统计学意义(F=75.109,P<0.001)。其中,0.4 μg/ml TBI-166+0.3 μg/ml Bdq组菌体内的RLU值明显低于0.3 μg/ml Bdq单药组,菌体内ATP含量下降最明显。 采用不同浓度的TBI-166与Bdq刺激H37Rv标准株24 h后,空白对照组、0.04 μg/ml TBI-166组、0.4 μg/ml TBI-166组、4 μg/ml TBI-166组、0.03 μg/ml Bdq组、0.3 μg/ml Bdq组、3 μg/ml Bdq组、0.04 μg/ml TBI-166+0.03 μg/ml Bdq组、0.4 μg/ml TBI-166+0.3 μg/ml Bdq组菌体内ROS荧光值分别为10 229.75±522.38、11 311.50±357.59、12 319.25±212.97、16 471.60±252.49、11 683.00±505.73、13 715.00±907.93、12 995.50±769.50、15 765.67±337.96、21 014.33±1189.19,各给药组菌体内ROS荧光值明显高于空白对照组,差异有统计学意义(F=115.403,P<0.001),即在TBI-166、Bdq的刺激下将诱导菌株ROS的产生。两药组合组菌体内ROS含量与单药组相比进一步增长,其中,0.4 μg/ml TBI-166+0.3 μg/ml Bdq组ROS含量上升最明显,明显高于0.3 μg/ml Bdq组。 结核病的治疗需要组合用药,现有的药物方案尚无法满足结核病的治疗需求,因此,迫切需要开发新的药物及药物方案缩短结核病的治疗疗程。亚胺吩嗪类药物具有较强的抗结核活性,其中,氯法齐明具有广泛的抗结核作用,但由于其会引起皮肤红染等不良反应,使用受限。经过广泛的药物化学筛选最终发现了TBI-166[1]。TBI-166作为我国抗耐药结核病新药,已完成临床单药的安全性及有效性评估。由于单药治疗往往会导致MTB耐药性的出现,因此,对TBI-166与现有抗结核药物的组合研究是非常必要的。既往对TBI-166与一线及二线抗结核药物组合的抗结核活性研究中发现INH和RFP对TBI-166的抗结核活性无明显作用,而Bdq、吡嗪酰胺的加入却明显增强了TBI-166的抗结核活性[10]。随着对抗结核药物的广泛研究,目前出现了几种有效且具有新作用机制的抗结核新药,如质子解偶联剂SQ109、DprE1酶抑制剂PBTZ169、分枝菌酸合成抑制剂Dlm等,对这些新药的研究有望缩短结核病疗程。鉴于TBI-166将与抗耐药结核病核心药物及有潜力的新药组成新方案用于耐药结核病的治疗,笔者所在课题组前期评估了TBI-166与抗耐药结核病A组药物(Bdq和Mfx)及新型抗结核药物(Dlm、SQ109、PBTZ169)的两药组合对MTB标准株H37Rv的抗结核活性,发现Bdq、SQ109、PBTZ169与TBI-166的两药组合具有协同杀菌活性(数据未展示),但由于菌株比较单一,因此,本研究进一步评估TBI-166与抗结核药物(Bdq、Mfx、Dlm、SQ109、PBTZ169)的两药组合对3株临床分离株的体外抗结核活性。 体外联合药物敏感性试验显示,TBI-166与Bdq、PBTZ169对临床药物敏感及耐药菌株均表现出部分协同或相加作用,并且Bdq、PBTZ169的加入使TBI-166的MIC降低至其MIC的1/4~1/2。同时,笔者采用了时间杀菌曲线对TBI-166的协同药物组合进行了14 d的杀菌实验研究,结果显示,0.08 μg/ml TBI-166分别与0.03 μg/ml Bdq、0.0001 μg/ml PBTZ169两药联用与药物敏感菌株30031孵育14 d后,两药联用组的活菌量与两药组中活性较好的单药(0.08 μg/ml TBI-166)相比分别降低1.59 log10CFU/ml和1.51 log10CFU/ml;0.05 μg/ml TBI-166分别与0.03 μg/ml Bdq、0.0002 μg/ml PBTZ169两药联用与药物敏感菌株30091孵育14 d后,与0.05 μg/ml TBI-166组相比活菌量分别降低1.27 log10CFU/ml和1.18 log10CFU/ml;而在菌株13385中,笔者发现TBI-166与PBTZ169的两药组合具有协同杀菌活性,与Bdq的两药组合具有相加作用。当0.04 μg/ml TBI-166与0.0001 μg/ml PBTZ169联用14 d后,活菌量与0.04 μg/ml TBI-166组相比降低2.82 log10CFU/ml。然而,在联合药物敏感性试验中,笔者发现TBI-166与Dlm的两药组合对敏感株30031表现出部分协同抗菌活性,但时间杀菌实验显示0.08 μg/ml TBI-166与0.01 μg/ml Dlm两药联用与药物敏感菌株30031孵育14 d后,两药联合组的活菌量与TBI-166组相比仅降低0.94 log10CFU/ml,提示TBI-166与Dlm的两药组合无相互作用。 同时,对体内外筛选出的协同药物组合作用机制的探讨将有利于基于靶标的新药发现。前期研究发现,TBI-166与Bdq具有较强的协同杀菌活性。药物产生协同作用可能是基于增加单药疗效和降低MTB耐药性的产生等。本研究中,笔者测定不同浓度的TBI-166与Bdq单用及两药组合作用于H37Rv标准株24 h后ATP及ROS含量的变化,结果显示,TBI-166与Bdq均能诱导菌体内ROS的产生并且降低ATP水平,与既往研究认为TBI-166可能通过累积ROS[3]、降低ATP水平而发挥抗菌活性,Bdq可抑制F0F1ATP合成酶阻止ATP合成发挥杀菌活性一致[11]。笔者进一步评估了TBI-166与Bdq两药组合后对菌体内ATP及ROS的影响,结果显示,当TBI-166与Bdq两药联用后,ATP水平与单药组相比进一步降低,而ROS含量进一步升高。本课题组前期研究发现,TBI-166可在Ⅱ型NADH醌氧化还原酶(Type-Ⅱ NADH-quinone oxidoreductase,NDH-2)的作用下被NADH还原为活性形式,之后与O2自发反应产生ROS[4]。既往在对Bdq处理耻垢分枝杆菌后的蛋白质组学研究中发现NDH-2表达上调[12],在Bdq处理MTB后的蛋白质组学研究中发现NADPH表达下调[13]。基于此,笔者推测Bdq与TBI-166联用后,菌体内有更多的NADPH在NDH-2的作用下被还原,电子释放增多,进而导致TBI-166的还原当量增加、ROS的产生增加。由于TBI-166增强醌氧化还原酶介导的氧化还原反应使NADPH/NADP+比值下降,导致NAD+还原当量减少,下游呼吸链电子传递受阻,同时TBI-166与Bdq的刺激使丙酮酸的氧化及三羧酸循环受阻,最终导致菌体内的ATP合成大大减少。 本研究存在以下不足:(1)体外协同作用研究选取的临床菌株数较少,后期研究还需加大样本量进一步验证;(2)协同作用仅是体外实验的发现,还需要体内模型及人体试验的验证;(3)作用机制研究仅针对MTB标准菌株且尚需深入研究。 综上,本研究通过体外棋盘法及时间杀菌实验评估了TBI-166与抗结核新药对3株MTB临床分离株的抗结核活性,发现TBI-166与Bdq、PBTZ169的两药组合对MTB敏感株及耐药株均具有协同杀菌活性;并且推测TBI-166与Bdq可能是通过作用于MTB呼吸链,进一步累积ROS、降低ATP水平来发挥协同杀菌作用。 利益冲突所有作者均声明不存在利益冲突 作者贡献刘海婷:直接参与(包括:实施研究、采集数据、分析/解释数据)、文章撰写(起草文章);李东硕、张蕾:直接参与(实施研究);王宁:直接参与(分析/解释数据);王彬、丁杨明、姚蓉:工作支持(支持性贡献);陆宇:工作支持(获取研究经费、行政/技术/材料支持、指导、支持性贡献)三、统计学处理
结 果
一、棋盘法测定结果
二、时间杀菌曲线法评估结果
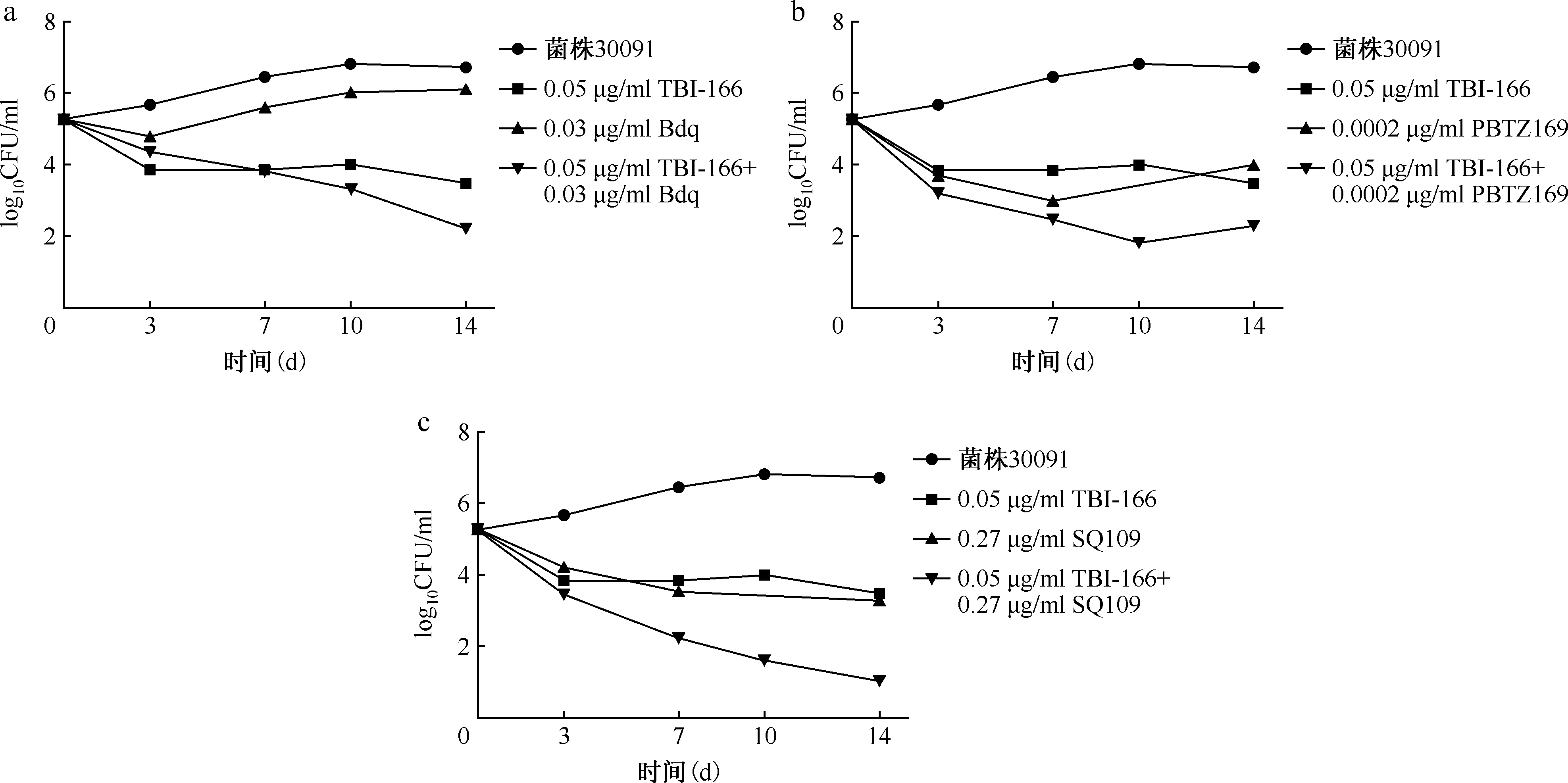
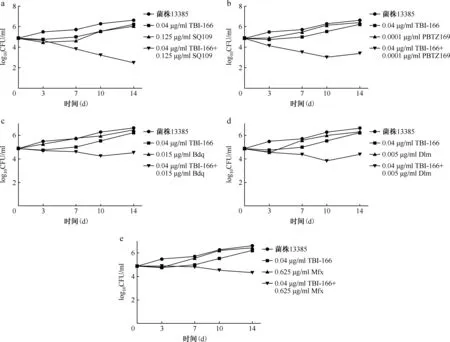
三、MTB菌体内ATP含量测定
四、MTB菌体内ROS含量测定
讨 论
