淋巴结结核伴发急性髓系白血病M5型一例
2022-07-06詹丹婷邱锦帆查依敏王凌伟
詹丹婷 邱锦帆 查依敏 王凌伟
血液系统恶性肿瘤患者在治疗过程中使用激素、免疫抑制剂后合并结核病的情况并非罕见,考虑与肿瘤本身及治疗造成的免疫功能低下有关。确诊结核病后在治疗过程中伴发白血病鲜有报道。我科2020年收治1例确诊淋巴结结核患者抗结核治疗2个月后出现急性髓系白血病(M5型)患者。通过对本例患者的临床诊治过程进行分析,旨在提高呼吸科、结核科医生对肺结核合并血液系统恶性肿瘤的诊断意识。
临床资料
患者,男,73岁,农民,因“反复发热4个月余”,于2020年5月10日收住深圳市人民医院呼吸与危重症医学科。患者4个月前无明显诱因出现发热,最高体温39.3 ℃,以夜间发热为主,伴乏力、纳差、盗汗。否认脱发、关节痛、晨僵、光敏感、牙龈出血、黑便等。入院检查:血常规白细胞 21.61×109/L(正常范围 4.0×109/L~10.0×109/L),血红蛋白104 g/L(正常范围 120~170 g/L),血小板 345×109/L(正常范围 100×109/L~300×109/L),中性粒细胞绝对值19.99×109/L(正常范围 2.0×109/L~7.5×109/L),淋巴细胞比例4.80%(正常范围 20%~40%);乳酸脱氢酶 562 U/L(正常范围 110~240 U/L),超敏C反应蛋白测定(hs-CRP)84.4 mg/L(正常范围 0~5 mg/L)。血结核感染T细胞斑点试验(T-SPOT.TB)阴性。胸部CT扫描(图1)示左下肺小结节,双肺少许炎症,右肺门淋巴结钙化,纵隔淋巴结轻度增大。彩色多普勒超声提示左锁骨上窝淋巴结(约21 mm×9 mm)及双侧腹股沟淋巴结增大。2020年5月15日外周血涂片:白细胞增多,中性粒细胞比例明显增高,可见中性中幼粒细胞及下阶段粒细胞,中性粒细胞胞浆内见中毒颗粒及空泡,可见巨多分叶核细胞,未见原始细胞。2020年5月18日肺泡灌洗液(BALF):GeneXpert MTB/RIF检测阴性、痰涂片未见肿瘤细胞。2020年5月19日正电子发射计算机断层显像(PET)-CT(图2~5):双侧锁骨上窝、双肺门、纵隔内见多发淋巴结增大[1R、2R、3P、4R、4L、7、8R、8L组,最大者约32 mm×22 mm,最大标准摄取值(SUVmax)15.1,平均标准摄取值(SUVave) 11.3],代谢增高,考虑为淋巴瘤病灶,但难以除外淋巴结活动性结核或其他炎症的可能;脾脏稍增大,脾脏(SUVmax3.2)及骨髓(SUVmax4.3)代谢弥漫性增高,考虑为反应性增生;双肺多发磨玻璃样、类结节状或斑片状阴影,部分病灶代谢轻度增高,考虑为双肺感染性病变。2020年5月21日行左侧锁骨上淋巴结穿刺活检,病理检查提示多组织细胞、中性粒细胞浸润,伴小淋巴细胞增生;局灶上皮样细胞呈栅栏状排列,中央见炎性坏死形成(图6)。免疫组织化学(IHC)结果示:CD20(+)、CD3(+)、CD68(+)、细胞角蛋白(CK)(-)、ALK(-)、CD30(-)。个别细胞非洲淋巴细胞瘤病毒编码核糖核酸(EBER)(+),抗酸染色(+),六胺银染色(+)。入院后给予哌拉西林他唑巴坦、左氧氟沙星抗感染治疗。2020年5月25日复查白细胞9.10×109/L,血红蛋白82 g/L,血小板 211×109/L,中性粒细胞绝对值8.36×109/L,淋巴细胞比例 6.4%,乳酸脱氢酶 438 U/L,铁蛋白 2836 μg/L(本院正常范围23.9~330.2 μg/L),甘油三酯 1.66 mmol/L(正常范围 0.4~2.3 mmol/L),血红细胞沉降率 64 mm/1 h(正常范围 0~20 mm/1 h)。经血液科、影像科、病理科会诊后诊断为淋巴结结核。2020年5月29日外院给予异烟肼/利福平/吡嗪酰胺治疗,用药第3天体温降至正常,胃纳、精神好转。期间未有发热,未复查。2020年7月15日患者再次发热,体温最高38.1 ℃,查血常规:白细胞 1.39×109/L,中性粒细胞绝对值 0.59×109/L,血红蛋白 104 g/L,血小板 64×109/L,考虑抗结核药物所致白细胞减少,停药1周并于2020年8月4日第2次收治入院。入院诊断:淋巴结结核,白细胞、血红蛋白、血小板减少性质待定:药物性?入院后查 hs-CRP 101.97 mg/L,降钙素原(PCT)正常。乳酸脱氢酶 359 U/L,γ谷氨酰转肽酶148 U/L,直接胆红素6.58 umol/L;甘油三酯 0.85 mmol/L;真菌1-3-β-D葡聚糖(G试验)、风疹病毒IgG抗体、风疹病毒IgM抗体、巨细胞病毒IgG抗体、巨细胞病毒IgM抗体、疱疹病毒Ⅰ+Ⅱ型IgM、弓形体IgG抗体、弓形体IgM抗体、肿瘤标志物(糖基抗原19-9、糖基抗原125、神经元特异性烯醇酶、甲胎蛋白、癌胚抗原、细胞角蛋白)均未见异常。血人类疱疹病毒核酸检测(EB-DNA) 阴性。未测铁蛋白及自然杀伤细胞(NK 细胞)。2020年8月5日外周血涂片:白细胞极少,中性粒细胞胞浆易见中毒性颗粒,淋巴细胞、单核细胞比例增高,可见约4%异型淋巴细胞,未见原幼细胞。彩色多普勒超声示双侧锁骨上区(Ⅳ区)可见肿大淋巴结,左侧(约19 mm×7 mm)较前缩小。胸部增强CT扫描示:双肺多个结节,部分为钙化结节。双肺上叶少许小叶间隔增厚;右侧肺门多个小淋巴结(图7~8)。入院后给予重组人粒细胞刺激因子升白细胞、重组人促血小板升板15 000 U,1次/d,连用3 d。复查白细胞 2.14×109/L,血红蛋白 85 g/L,血小板 33×109/L,中性粒细胞绝对值 1.36×109/L,仍反复低热,最高体温37.8 ℃。行骨髓穿刺活检术,骨髓病理检查:符合急性单核细胞白血病(FAB,M5b)(图9~10)。免疫组织化学结果:髓过氧化物酶 MPO(散在+),CD68(+),CD30(-),HMB-45(-),Ki67(约40%+),Cyclin D1(-),S-100(-),Langerin(-),抗酸染色(-),六胺银(-)。流式细胞免疫荧光:送检标本中未见明显CD34+或CD117+细胞;单核细胞占有核细胞总数约 59.9%,伴免疫表型异常;其中有部分原单和幼单细胞:单核细胞免疫表型为 CD34-,CD117-,CD33+,HLADR+,CD14+,CD36+,CD64+,CD56+,CD11b+,CD13+,CD15+部分,CD4+;另可见约8.4%的异常B淋巴细胞,其免疫表型未见CD19+,CD20-,CD5-,CD10-,CD200-,胞膜/胞内免疫球蛋白Kappa/Lambda轻链表达不明显。修正诊断:急性髓细胞白血病M5型;淋巴结结核。2020年11月30日随访患者返回原籍后未治疗,在当地医院因“重症肺炎”去世。
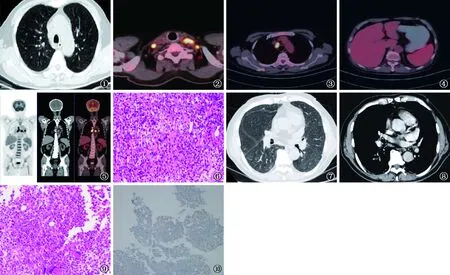
图1 2020年5月7日 胸部CT扫描。双肺散在炎症渗出图2~5 2020 年5月19日正电子发射计算机断层显像(PET)-CT显示,双侧锁骨上窝、双肺门、纵隔内见多发淋巴结增大,代谢增高;脾脏稍增大,脾脏及骨髓代谢弥漫性增高 图6 2020年5月21日(淋巴结组织)镜下可见大量组织细胞、中性粒细胞浸润,伴小淋巴细胞增生;局灶上皮样细胞呈栅栏状排列,中央见炎性坏死形成(HE ×40) 图7~8 2020年8月5日 胸部增强CT 扫描。双肺上叶少许小叶间隔增厚;右侧肺门多个小淋巴结 图9~10 2020年8月28日(骨髓组织)镜下可见肿瘤细胞替代正常骨髓组织,肿瘤细胞主要为多边形细胞,胞质丰富,呈嗜酸性(HE ×40);细胞核呈圆形、卵圆形、肾形,可见核沟;核分裂象易见;另可见少许多核巨细胞,符合M5型白血病(MPO 染色 ×20)
讨 论
恶性血液肿瘤患者罹患结核病约为普通人群的9倍,其中以白血病最为常见[1]。一项针对2585例白血病患者的单中心回顾性研究显示,白血病患者结核病患病率为1.7%,75%的患者在确诊白血病3个月内诊断为肺结核;84.1%的患者诊断结核病时白血病处于未缓解期(或不稳定期)[2]。白血病患者结核病患病率高,与原发病、化疗、骨髓移植等造成CD4+T淋巴细胞减少、CD8+T淋巴细胞功能下降、CD4+/CD8+比值下降,机体免疫力下降、原有结核病灶复燃有关[2-3]。其中,急性髓系白血病患者的结核病患病率明显高于其他类型恶性血液病[1,4]。恶性血液病患者的结核病以肺外结核为主,最常累及淋巴结,其次为骨髓、皮肤、泌尿系统等[1]。
本例患者反复发热4个月,符合“发热待查”标准[5]。在不明原因发热的感染性因素中分枝杆菌感染是位列首位的病因,以肺结核和淋巴结核最为常见[6]。患者伴纳差、盗汗、乏力等结核中毒症状,予经验性广谱抗感染治疗无效。首次入院外周血涂片未见原始幼稚细胞,虽然PET-CT提示骨髓代谢活跃,脾大,但经过住院检查并无急性白血病、淋巴瘤及其他实体肿瘤、风湿结缔组织病等证据,淋巴结穿刺活检抗酸染色阳性、抗结核治疗后第3 d体温即降至正常并维持近2个月,复查B超显示颈淋巴结较前缩小,因此考虑该患者淋巴结结核诊断明确。患者血T-SPOT.TB阴性。文献报道,肺外结核、恶性肿瘤、低外周血淋巴细胞计数(包括CD4+T淋巴细胞计数<200/μl)、高龄(>70岁)是导致T-SPOT.TB假阴性的因素[7]。患者首次入院外周血淋巴细胞计数明显下降(0.46×109/L),故考虑该患者T-SPOT.TB阴性与白血病、年龄、低淋巴细胞计数多方面因素有关。
结核病伴发白血病最早可发生在结核病治疗后2个月内。本例患者抗结核治疗后45 d出现白细胞、血红蛋白、血小板减少,确诊为急性髓系白血病,是迄今为止有报道患结核病后伴发白血病最短时间的患者。需要鉴别患者是否首次入院已经存在白血病。患者入院时PET-CT检查提示脾大及骨髓代谢活跃,推测可能已经存在异常髓系原始细胞的增殖,但尚未达到白血病诊断标准。尽管该患者抗结核治疗有效,但首次住院时如可以完善骨髓穿刺活检将有助于评估当时是否同时已存在白血病。
患者首次入院时,发热持续大于7 d,脾肿大,白细胞无下降,血红蛋白>90 g/L,血小板、甘油三酯正常,铁蛋白明显升高,外周血涂片未见嗜血现象,满足2004年嗜血细胞综合征(hemophagocytic lymphohistiocytosis, HLH)国际诊断标准[8]8条中的3条,但因未检测NK细胞活性及可溶性白细胞介素-2受体,无法判断当时是否存在结核相关的HLH。虽然HLH在经过积极治疗原发病后可改善,但患者仅仅使用抗结核药物治疗3 d体温即正常,病情改善过于迅速,不符合HLH的临床发展过程。
本例患者在使用抗结核治疗过程中出现血液系统异常,首先考虑是抗结核药物不良反应。抗结核药物相关不良反应发生率约为58.0%~69.2%,以耳毒性、精神神经反应、胃肠道失调、关节疼痛、癫痫、肝炎、皮肤反应等较为常见[9]。血液系统异常占抗结核药物总不良反应的3.3%~10%,多发生在接受抗结核药物治疗1~2月之内[10]。包括粒细胞减少、血小板减少、贫血、骨髓抑制和溶血,严重者可发生再生障碍性贫血、骨髓纤维化[11]。该类患者预后差,严重者可导致死亡[12]。该患者停用抗结核药物、升白细胞治疗后白细胞、血红蛋白、血小板减少无改善,无法用抗结核药物相关不良反应解释。结核病患者出现血液系统异常,尚需警惕结核病本身可诱发类白血病反应(leukemoid reaction,LK)。类白血病反应是机体的一种防御反应,因感染、创伤等刺激因素使机体处于高度应激状态,发生白细胞过度增殖及异常释放,由于血常规表现类似白血病,因而称其为类白血病反应[13]。结核病所致类白血病反应最常见于急性粟粒型肺结核[14],多发生在病情尚未得到控制阶段。临床上原发病灶明显,白细胞中度增高,多数<100×109/L,以分叶核及杆状核粒细胞为主,原粒细胞少见嗜酸及嗜碱粒细胞不增高,粒细胞中毒性改变明显,血红蛋白及血小板多为正常,一般无肝脾、淋巴结肿大,骨髓象无明显改变,多仅表现为活跃或明显活跃,Ph染色体(-),经积极抗结核治疗后类白血病反应可消失[13,15]。当鉴别有困难时,宜作动态观察,必要时可先行抗结核治疗,并不急于抗白血病治疗[14]。随着结核治愈或好转,类白血病可消失。而本例患者,经抗结核治疗后,体温维持正常近40 d,颈部淋巴结有所缩小,好转后出现血液系统异常,难以用类白血病反应解释。本例患者在经过停药、升白细胞治疗效果欠佳以及排除结核加重因素后,无法用一元论解释时,通过及时完善骨髓穿刺活检术以明确诊断。
另外,选择何种病理活检方式值得思考。淋巴结穿刺简单易行,但标本量较少,而诊断淋巴瘤或淋巴细胞增殖性疾病往往需要较大的标本,建议此类患者应用淋巴结活检取代淋巴结穿刺。
综上所述,抗结核治疗过程中需密切监测血液系统各项指标及肝肾功能,对于抗结核后不明原因血液系统异常的患者,应及时完善骨髓穿刺及相关检查除外血液系统疾病可能。肺外结核治疗继发白血病也以髓系白血病为主,虽然非常罕见,但值得积累更多的案例并进行相关的研究。
利益冲突所有作者均声明不存在利益冲突
作者贡献詹丹婷:采集数据、撰写论文、修改论文;邱锦帆和查依敏:采集数据;王凌伟:分析/解释数据、获取研究经费、指导撰写和修改
