中性粒细胞/淋巴细胞比值评估B型主动脉夹层合并阻塞性睡眠呼吸暂停的临床价值
2022-07-05姜丹丹苏伟明陈取伍定辉姚向阳王婉瑜
姜丹丹 苏伟明 陈取 伍定辉 姚向阳 王婉瑜
(1 厦门大学附属第一医院肺科,厦门,361000;2 厦门大学附属第一医院心脏外科,厦门,361000;3 厦门大学附属第一医院呼吸与危重症医学科,厦门,361000)
阻塞性睡眠呼吸暂停(Obstructive Sleep Apna,OSA)是以睡眠时反复发生睡眠暂停及低通气为特征的常见临床病症。OSA可引起多系统并发症[1-3],其中心血管疾病因其发病率高、起病迅速及预后不良最引人关注。近年来,越来越多的研究证实OSA并发主动脉夹层(Aortic Dissection,AD)的病例不在少数[4-6]。AD是心血管最危重症之一,若发病48 h内未得到及时救治,病死率可高达50%~68%[7]。根据经典的斯坦福(Stanford)分型方法,AD可分为A型和B型,前者常需要急诊手术,后者病情多可在药物治疗下得到基本控制。由于患者缺乏对疾病的认知以及心血管外科医师对OSA的警觉性不足,越来越多的研究发现AD患者中同时患有OSA者常未被诊断[8-10]。因此,如何在AD患者中快速筛选出高危OSA意义重大。
多导睡眠监测(Polysomnography,PSG)是目前诊断OSA的金标准,但因费用较昂贵、耗时且不易操作,在各医院特别是基层医疗机构难以开展,这使得多种初筛量表在临床上得到广泛应用,STOP-Bang评分以简单易行、灵敏度高的优点成为其中的代表,但仍有不少缺乏典型症状的OSA患者被漏诊。中性粒细胞/淋巴细胞比值(Neutrophil to Lymphocyte Ratio,NLR)是近年来被证明与OSA及其严重程度密切相关的新型炎症指标[11],其能否有助于识别AD并发OSA患者值得进一步研究。因A型主动脉夹层(Type A AD,TAAD)通常需急诊手术,剧烈胸痛、术后伤口疼痛和手术应激等多种因素会显著影响患者夜间睡眠,因此本研究将此类患者予以排除。本研究拟探讨OSA在B型主动脉夹层(Type B AD,TBAD)患者中的发病率以及NLR评估TBAD合并OSA患者的临床价值,以期为OSA与AD共同患病机制研究,提高共同患病患者生命质量及改善疾病预后提供参考。
1 资料与方法
1.1 一般资料 选取2017年1月至2021年7月于厦门大学附属第一医院心脏外科住院并诊断为TBAD的患者共188例作为研究对象,根据PSG结果分为观察组(n=109)和对照组(n=79)。观察组中男88例,女21例,平均年龄(50.38±11.35)岁。对照组中男61例,女18例,年龄17~79岁,平均年龄(47.03±10.57)岁。所有受试者均签署了知情同意书。
1.2 纳入标准 参考《主动脉夹层诊断与治疗规范中国专家共识》[12],对所有的研究对象进行严格筛选。
1.3 排除标准 排除伴局灶或全身性感染性病变、近期肿瘤病史、自身免疫疾病、急性肾功能衰竭、急性肢体缺血、血流动力学不稳定等情况,排除妊娠、哺乳期及服用避孕药的女性。
1.4 研究方法
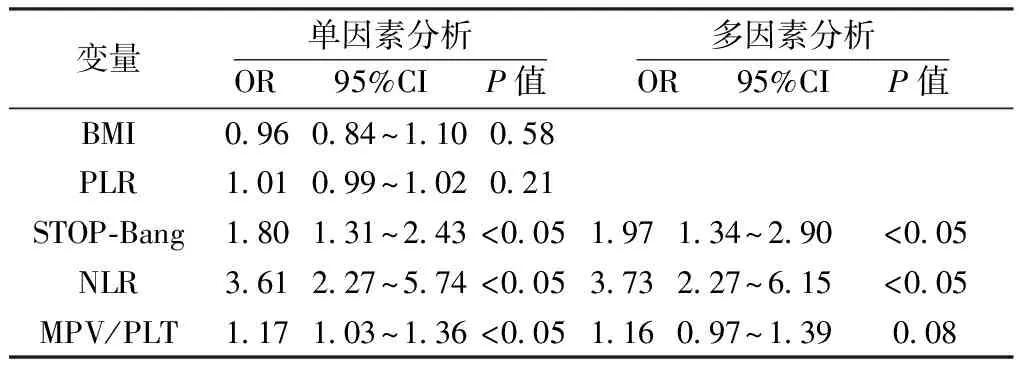
1.4.1 收集资料 收集研究对象的病史和其他一般资料。受试者于入院24 h内采集血标本并在2 h内送检上机,收集指标包括:白细胞计数(White Blood Cell Count,WBC)、中性粒细胞比例、淋巴细胞比例、血小板计数(Platelet Count,PLT)、平均血小板体积(Mean Platelet Volume,MPV)、C反应蛋白(C-reactive Protein,CRP)及D-二聚体,并计算NLR、血小板与淋巴细胞比值(Platelet to Lymphocyte Ratio,PLR)及平均血小板体积与血小板比值(Mean Platelet Volume to Platelet Count Ratio,MPV/PLT)。
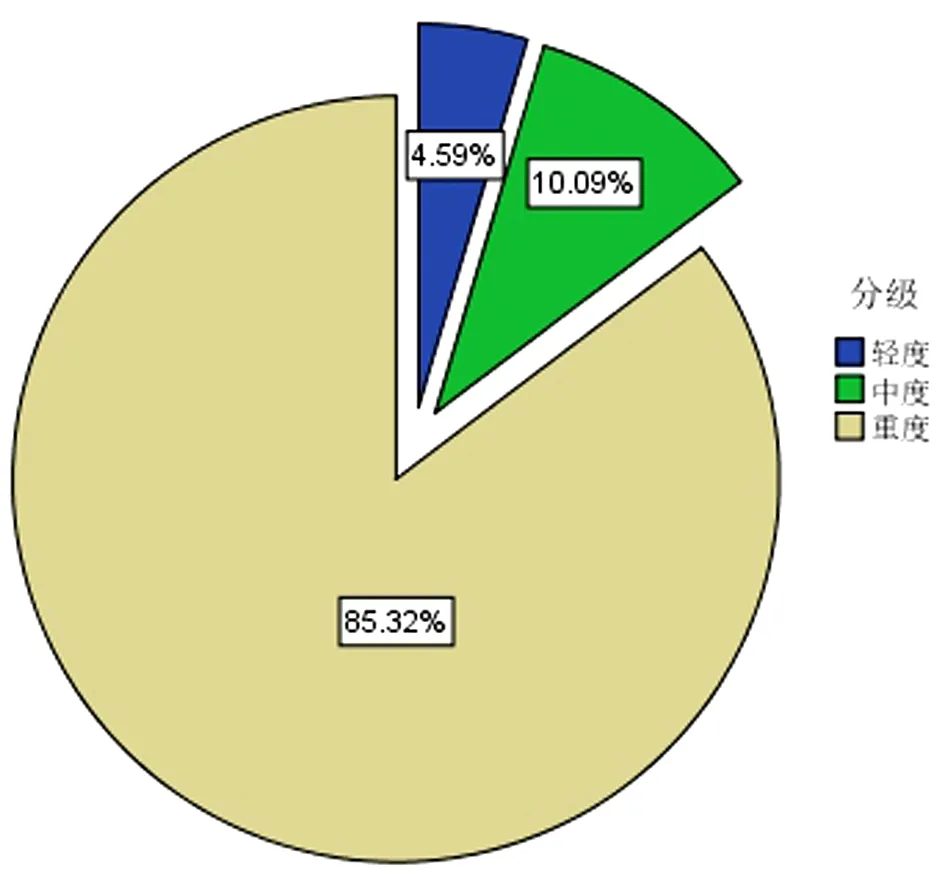
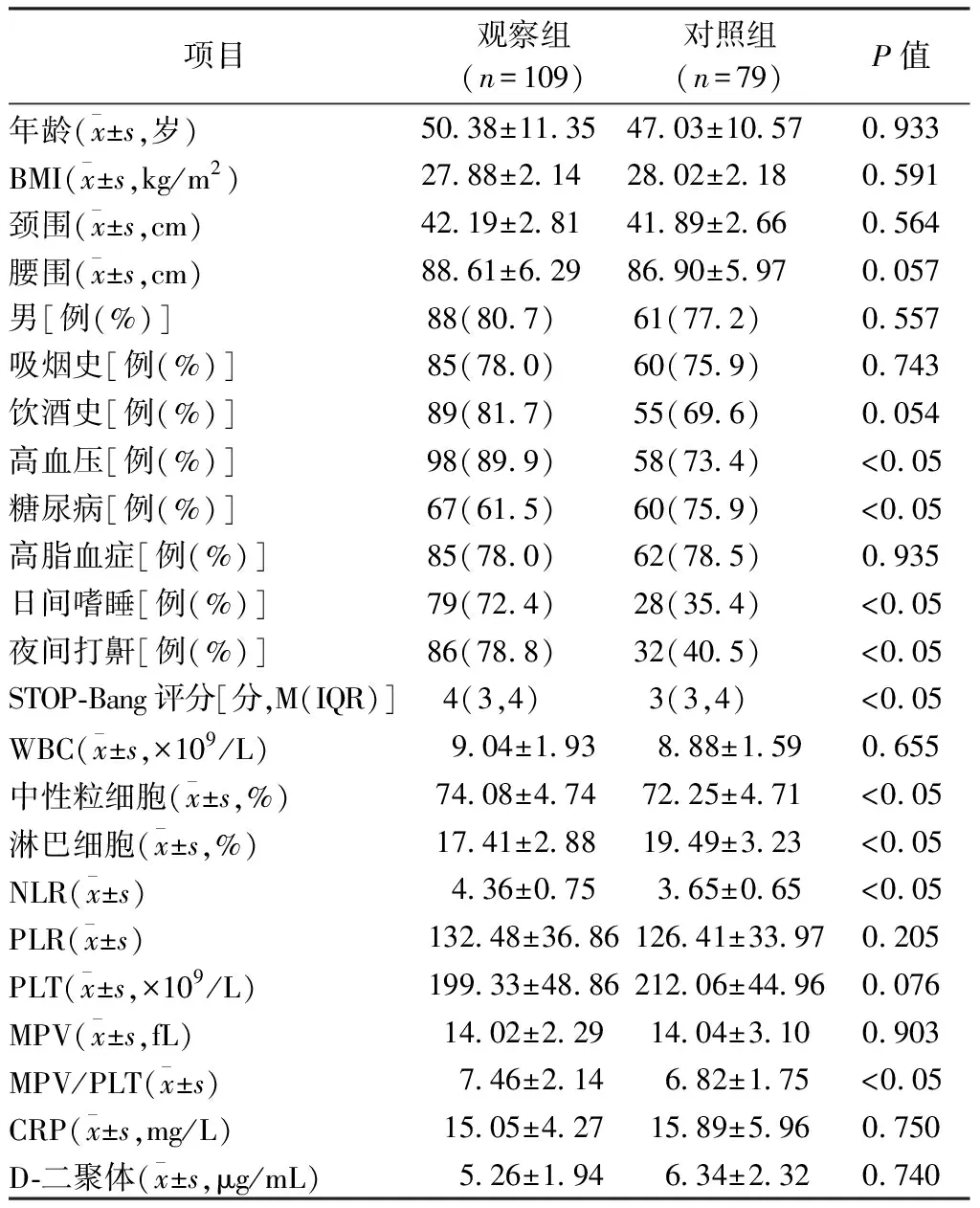
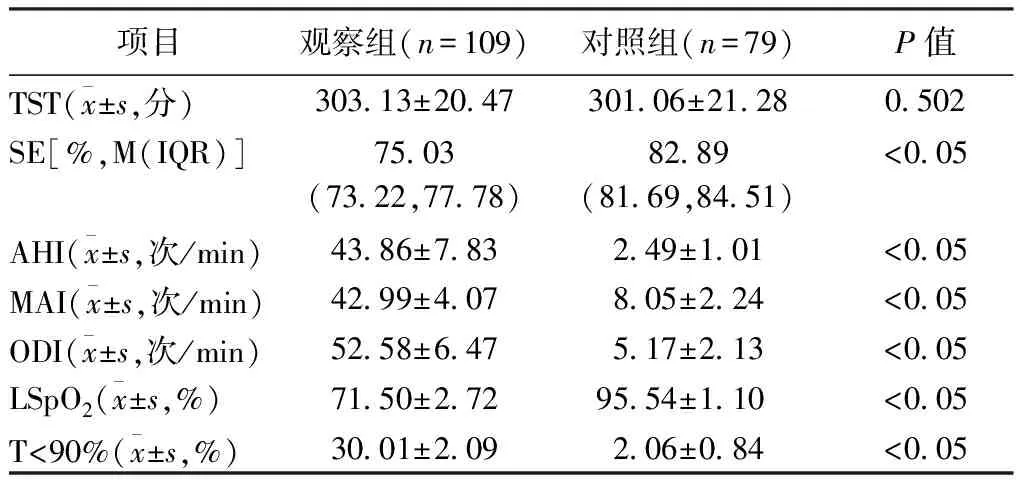
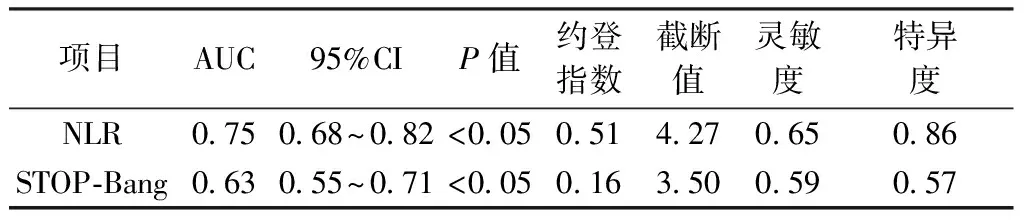
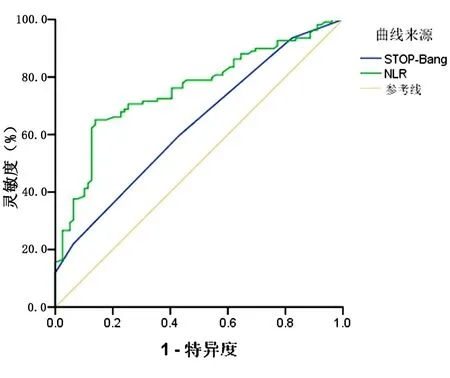
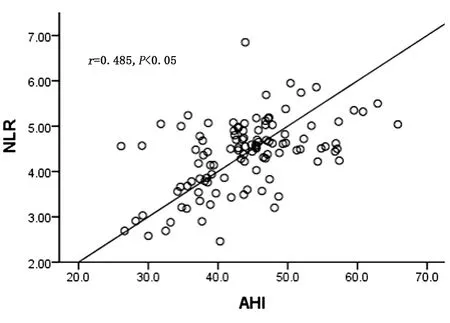
1.4.2 睡眠监测及相关事件 所有患者均在我院睡眠中心使用Polysmith(USA)睡眠监测系统进行至少7 h的PSG监测。受试者在PSG监测当晚填写STOP-Bang评分,监测当天禁服乙醇、咖啡、镇静剂和催眠剂。监测内容包括脑电、眼电、肌电、心电、口鼻呼吸气流、鼾声、体位、胸腹运动和血氧饱和度。记录数据由同一PSG专职医师给予逐帧复核,根据2018年《成人阻塞性睡眠呼吸暂停多学科诊疗指南》[13]进行相关事件判读,氧减指数(Oxygen Desaturation Index,ODI)为平均每小时出现血氧饱和度较基础水平下降>3%的次数;同时记录呼吸暂停及低通气指数(Apnea and Hypopnea Index,AHI)、微觉醒指数(Micro-arousal Index,MAI)、总睡眠时间(Total Sleep Time,TST)、睡眠效率(Sleep Efficiency,SE)、夜间最低血氧饱和度(Lowest Oxygen Desaturation,LSpO2)及血氧饱和度低于90%时间占比(the Percentage of Time Spent at Oxygen Desaturation<90%,T<90%);根据AHI判定OSA严重程度:5次/h 2.1 基线特征 58%TBAD患者同时患OSA,且轻、中、重度OSA占比分别为4.59%,10.09%,85.32%,中重度OSA总占比高达95.41%。见图1。2组患者的基线特征比较,观察组高血压及糖尿病比例高于对照组,差异有统计学意义(P<0.05),观察组伴日间嗜睡、夜间打鼾比例及STOP-Bang评分均显著高于对照组(P<0.05),而2组患者在年龄、男性比例、体质量指数(Body Mass Index,BMI)、颈围、腰围、高脂血症比例等资料比较差异均无统计学意义(均P>0.05)。见表1。 图1 观察组中不同严重程度OSAS占比分布 2.2 生化指标及PSG参数 2组患者生化指标比较显示血NLR、MPV/PLT、中性粒细胞及淋巴细胞比例等指标差异有统计学意义(P<0.05),2组间WBC、PLR、PLT、MPV、CRP及D-二聚体等指标差异无统计学意义(P>0.05)。见表1。PSG指标显示2组TST比较差异无统计学意义(P>0.05),观察组SE、LSpO2及T<90%低于对照组,AHI、ODI及AI高于对照组,差异有统计学意义(P<0.05)。见表2。 表1 2组患者临床特征及血液学指标比较 表2 2组患者PSG睡眠参数比较 2.3 OSA的预测指标及效能 多因素Logistic回归分析结果显示NLR(OR=3.73,P<0.05)和STOP-Bang评分(OR=1.97,P<0.05)是OSA的独立危险因素。见表3。ROC分析表明:NLR对OSA的诊断效能显著高于STOP-Bang评分(P<0.05)。见图2及表4。NLR诊断OSA的AUC为0.75,最佳判读值为4.27,灵敏度为65.1%,特异度为86.1%。见表4。STOP-Bang评分诊断OSA的AUC为0.63,最佳判读值为3.50,灵敏度为59%,特异度为57%。NLR对OSA的诊断效能显著高于STOP-Bang评分(P<0.05)。 表3 合并OSA相关的单因素及多因素Logistic回归分析 表4 NLR及STOP-Bang评分对OSA的诊断价值 图2 NLR和STOP-Bang评分诊断OSA的ROC曲线 2.4 NLR与AHI相关性分析 经Spearman秩相关分析,NLR与AHI正相关(r=0.485,P<0.05)。见图3。 图3 NLR与AHI在合并观察组中的相关性分析 本研究发现NLR和STOP-Bang评分是OSA的独立危险因素,前者灵敏度及特异度高于后者,显示出更高的诊断价值。本研究还发现58%TBAD患者合并OSA,与Wang等[5]研究中的66.2%发病率接近,高于Zhou等[14]研究中45%的发病率。造成差异的原因可能是小样本单中心研究的局限性,如此高的共同患病率也提示我们,如何快速对OSA及其严重程度做出准确的判断意义重大。 近年来,OSA与AD共同患病报道屡见不鲜,引起了多领域学者关注并促进了对其发病机制的探讨。目前实验与临床研究均已证实,反复呼吸暂停引发的间歇性低氧及频繁觉醒和微觉醒,均可引起交感神经过度兴奋[15],造成呼吸暂停瞬间动脉血压骤升而导致难治性高血压。另外,气道塌陷继发的吸气努力造成胸腔内负压增高,Suzuki等[16]研究证实呼吸暂停发生时胸腔内负压可达(-53.6±2.9)cm H2O(1 cm H2O=0.098 kPa),瞬间最大值可至-147.4 cm H2O,而正常人群的胸腔内负压为-5~-8 cm H2O,血管内外压力的骤然变化造成主动脉跨壁压增大及管壁剪切力升高,AD风险随之增大[17]。除此之外,OSA长期反复缺氧引起氧化应激反应及活性氧增加,导致机体炎症反应增强[18]。Bai等[19]研究提出主动脉壁中层纤维的强度与血液中多种炎症介质如白细胞介素-6和肿瘤坏死因子-α水平负相关,这意味着OSA相关的慢性系统性炎症可直接削弱主动脉中层纤维强度进而导致AD。另有研究证实,继发于OSA的血管内皮功能紊乱及动脉粥样硬化均是促进AD发生与发展的重要因素[20]。 在AD人群中筛选高危OSA患者具有重要意义。OSA患者睡眠时发生的间歇低氧及片段化睡眠能引起血流动力学改变及神经内分泌变化,诱发并加速AD进展。既往研究证实中重度OSA发生AD的相对危险度是无或轻度OSA的4.43倍[14]。OSA还对AD远期预后有重要影响,Wang等[21]开展的一项包含51例AD合并OSA患者及40例未合并OSA患者为期36个月的随访研究发现,观察组全因病死率(27.5%)显著高于未合并组全因病死率(10.0%)。对于需要手术的AD患者,未经治疗的OSA的术前麻醉风险亦大幅提高[22],术后并发症、术后插管困难发生率、住院总时间及需要入住ICU病房概率均明显增高[23],合并未经诊断及治疗的OSA术后患者突发心脏骤停的案例报道并不罕见[24]。除各类心血管并发症的风险,未经治疗的OSA患者平均寿命也明显低于普通人群[25],因此,探寻可用于AD人群筛选OSA的指标对于阻遏AD发展及改善预后具有重要意义。STOP-Bang评分是临床上初筛OSA常用方法之一,随着在临床实践中的广泛应用,许多问题也凸显出来。首先,STOP-Bang评分诊断OSA的特异度较低,这就造成了大量假阳性患者涌入睡眠中心行价格昂贵、操作烦琐的PSG监测,造成待检患者拥堵及医疗资源的浪费。其次,用固定界值识别不同人群高危OSA显然是不严谨的,鉴于STOP-Bang评分中包含性别得分差异的条目,诊断界值可能受到测试对象中性别比例的影响。Orbea等[26]提出,STOP-Bang评分在妇女人群应用时需要降低其预测OSA的截断值。因此,在AD与OSA共同患病人群中寻找更简单、快速且经济高效的标志物成为亟须解决的问题。 慢性全身性炎症已被证实可导致主动脉中膜退化,增大AD发生风险[27],因此血液炎症指标或可成为共同患病患者诊断OSA的有效指标。NLR是一个已在多种疾病中被广泛研究的新型炎症标志物,它的数值由非特异性免疫的中性粒细胞及特异性免疫反应的淋巴细胞共同决定,因此,NLR可反映体内炎症负荷且较其他炎症指标更稳定、持久且可靠。目前已有不少研究证实了NLR与OSA诊断及严重度关系密切,一项包含2 259例OSA患者的Meta分析显示,OSA患者血NLR显著高于对照组且重度OSA患者升高更明显[11]。Al-Halawani等[28]观察了使用下颌前移矫治器治疗OSA前后研究对象血NLR水平的变化,发现中、重度OSA患者血NLR显著高于轻度OSA患者,在随后的亚组分析中发现经有效治疗的OSA患者NLR与AHI呈现同步下降,这就提示NLR是一项可反映OSA病情严重度并可用OSA治疗效果评估的理想指标。 虽然NLR与OSA关系密切,但目前尚未见到关于探讨NLR对于AD人群OSA诊断意义的研究报道,本研究首次发现NLR是TBAD合并OSA的独立危险因素,且NLR与OSA严重程度正相关(r=0.485,P<0.05),这与Uygur等[29]关于NLR与AHI正相关(r=0.437,P<0.001)的研究相符。本研究还发现,NLR诊断OSA的灵敏度为65%,特异度为86%,均高于STOP-Bang评分对于OSA的预测效能。这可能是因为NLR不易受研究对象性别比例的影响,且不易受主观因素干扰,较STOP-Bang评分更为客观。综上所述,本研究发现NLR是一个可用于TBAD人群预测OSA及严重程度的简便、经济且可信的炎症指标,我们期待更多研究验证本研究观点并深入探究NLR是否可作为AD合并OSA患者治疗效果评估的指标。 本研究最大的局限性在于NLR诊断OSA的灵敏度较低,仅为65%,这可能受制于小样本单中心研究的局限性,且本研究中共同患病患者多为重度OSA,机体内炎症负担重造成NLR较高,高截断值造成诊断灵敏度降低,我们期待更多大样本的多中心研究,进而增强NLR诊断OSA阈值的稳定性及可信性。其次,由于缺乏随访我们并不能断言NLR对OSA的诊断价值是否会随时间而变化。然而,本研究是第一个开展的探究NLR在AD与OSA共同患病患者中临床价值的相关研究,根据本研究结果,我们建议TBAD合并高NLR的患者,特别是伴随日间嗜睡及夜间打鼾,有必要行整夜PSG睡眠监测或Ⅲ型便携式多导睡眠监测仪监测。 综上所述,对于TBAD患者,NLR对OSA的诊断效能高于STOP-Bang评分,且与OSA严重程度显著正相关。NLR对TBAD合并OSA的诊断及病情严重程度评估有较高的临床价值。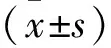
2 结果
3 讨论
